β-烟酰胺单核苷酸对氧糖剥夺PC12细胞自噬的影响
田梦芝,龙佳欣,陈笑一,陈惠媚,2,金泽龙,李思特,谢明霞,杜 可*
1湖南中医药大学;2中医药防治眼耳鼻咽喉疾病湖南省重点实验室,长沙410208
缺血性脑血管疾病包括短暂性脑缺血和脑梗死两型。其中脑梗死在中医诊断学中命名为缺血性脑卒中(ischemia stroke,IS),是由于各种原因所致的局部脑组织区域血液供应障碍,导致脑组织缺血缺氧性病变坏死,进而产生一系列神经功能障碍的疾病。其致死率、致残率高且病理机制复杂,每年给全球造成极大的经济负担[1]。脑细胞氧糖剥夺(oxygen glucose deprivation,OGD)是最常用的IS体外模型,广泛用于基础和临床前脑卒中的研究[2]。
细胞自噬(autophagy)广泛存在于真核细胞内,在调节细胞生存和死亡的过程中起着重要的作用[3,4]。大量研究提示自噬与IS的发生、发展密切相关,有研究表明[5]神经元自噬能减轻缺血性脑损伤,也有研究报道[6]神经元自噬能加重缺血性脑损伤,但具体机制尚不明确。
β-烟酰胺单核苷酸(β-nicotinamide mononucleotide,NMN)存在于多种食物中,对调节细胞衰老和维持机体正常功能至关重要,参与许多重要的细胞内信号通路的转导。有研究报道,体外给予NMN能迅速转化成NAD+而调节细胞衰老和维持机体正常功能[7]。NMN可以补偿IS导致NAD+的减少而改善脑缺血神经元的损伤[8]。这提示NMN在IS中发挥着一定的作用。有研究表明[9],NMN能够促进神经血管再生、改善脑微血管内皮功能、抗炎、抗凋亡。也有少量研究提示[10],其可通过调控自噬来发挥抗缺血性脑损伤的作用,然而NMN调控自噬抗IS的具体机制尚不明确。
本研究旨在构建氧糖剥夺PC12细胞模型,通过体外实验MTT测细胞存活率,透射电镜检测自噬小体、自噬溶酶体,MDC观测自噬小体荧光强度,Western blot检测LC3-II/LC3-I、Beclin1、p62、P-mTOR/mTOR自噬相关蛋白表达情况,以期明确NMN对OGD诱导的PC12 细胞自噬损伤的影响。
1 材料与方法
1.1 材料
1.1.1 细胞
大鼠肾上腺嗜铬细胞瘤细胞PC12细胞株(商品号:TCR9),购自中国科学院上海细胞库,本实验室传代培养。
1.1.2 药品与试剂
β-烟酰胺单核苷酸(货号:S31451-100 mg,上海源叶);3-甲基腺嘌呤(3-methyladenine,3-MA)(批号:265839,MCE);雷帕霉素(Rapamycin,RAPA)(批号:HY-10219,MCE);胎牛血清(批号:2307029,VivaCell);1%青链霉素混合液(批号:42A0378K,普诺赛);DMEM高糖基础培养基(批号:WHB823P261,普诺赛);DMEM无糖基础培养基(批号:WH1022K081,普诺赛);BCA试剂盒(批号:23135865,Biosharp);蛋白酶抑制剂PMSF(批号:21355980,Biosharp);Beclin1(批号:10024164,Proteintech group);LC3(批号:00115896,Proteintech group);mTOR(批号:10018370,Proteintech group);P-mTOR(批号:10020406,Proteintech group);β-actin(批号:21004031,Proteintech group);羊抗鼠二抗(批号:D20802-25,LI-COR);羊抗兔二抗(批号:D21207-05,LI-COR);二甲基亚砜(批号:22102134,Solarbio);细胞自噬检测试剂盒(MDC法)(批号:20221217,Solarbio);2.5% Gluta固定液(批号:20230208,Solarbio)。
1.1.3 主要仪器
超净工作台(SJ-CJ-2FD,苏州苏洁净化设备有限公司);倒置显微镜(AE2000,麦克奥迪实业集团有限公司);三气培养箱(150i,美国Thermo Fisher公司);酶标仪 (ELX800,美国Bio-Tek公司);多功能微孔板检测系统(CytationTM5,美国Bio Tek公司);红外荧光扫描成像系统(Odyssey CLX,美国LI-COR公司)。
1.2 方法
1.2.1 细胞培养
将PC12细胞接种于含有10%的胎牛血清、1%青链霉素混合液的DMEM高糖培养基中,置于37 ℃、5% CO2及湿度饱和的培养箱中培养,适时换液,经1~2次传代后,收集对数期细胞备用。
1.2.2 OGD诱导PC12细胞自噬损伤模型制备
从培养箱中取出PC12细胞,弃掉培养液,用PBS清洗2遍,加入适量的DMEM无糖基础培养基(缺糖),置于94% N2,5% CO2,1% O2条件下缺氧6 h(缺氧)。
1.2.3 MTT法测各组PC12细胞存活率
收集对数增长期细胞,以6×103个/孔接种于96孔板。设置正常对照组(Con)、OGD组、NMN(200、400、800、1 600、3 200 μmol/L)组,共计7组,每组5个复孔,每孔100 μL。37 ℃、5% CO2饱和湿度培养箱下培养24 h。OGD组在上述条件下培养24 h后,换DMEM 无糖培养基,再在94% N2,5% CO2,1% O2条件下培养6 h进行氧糖剥夺处理。NMN各浓度组药物干预24 h,换DMEM无糖培养基,再在94% N2,5% CO2,1% O2条件下培养6 h 进行氧糖剥夺处理。采用MTT法测细胞存活率,每孔加50 μg/mL、100 μL MTT,37 ℃孵育4 h后于490 nm 波长处测定各组吸光度(A)值,按如下公式计算各组细胞存活率(R)。
R=[(A实验-A空白)/(A正常对照-A空白)]×100%
1.2.4 透射电镜观察PC12细胞自噬小体及自噬溶酶体
细胞以1.5×106个/mL的密度接种于6 cm培养皿中,设置Con组、OGD组、NMN组、3-MA组、3-MA+NMN组、RAPA组、RAPA+NMN组。37 ℃、5% CO2饱和湿度培养箱下培养24 h。NMN(800 μmol/L)进行干预,3-MA(5 mmol/L)、RAPA(100 nmol/L)分别在加NMN前30 min加入。各组干预24 h后,除正常组外,其余组换DMEM无糖培养基在 94% N2,5% CO2,1% O2条件下培养6 h,使细胞处于氧糖剥夺状态。弃除旧培养基,用含EDTA的胰酶消化细胞,收集到1.5 mL EP管中,在台式冷冻离心机4 ℃下1 500 r/min离心10 min后弃去上清,用2.5% Gluta固定液固定细胞团,4 ℃冰箱保存过夜,1%锇酸后固定2 h,依次以50%、70%、90%、100%的丙酮脱水,包埋、染色后,用透射电子显微镜观察细胞内体数目和形态,并进行拍照,肉眼计数。
1.2.5 MDC荧光法观测PC12细胞自噬小体
细胞以1×106个/mL密度接种于6孔板,同“1.2.4”一样操作处理后,弃旧培养基,PBS清洗2次,加入60 μL MDC荧光染色液,37 ℃孵育15 min;去除染色液,用PBS清洗3次后在CytationTM5细胞成像多功能检测仪CFP 20倍镜下观察各组自噬小体的荧光斑点,并拍照记录,用Image J分析并计算荧光强度。
1.2.6 Western blot检测LC3-II/LC3-I、Beclin1、p62、mTOR、P-mTOR的表达情况
收集对数增长期细胞,以2.5×106个/mL密度接种于10 cm培养皿中。按“1.2.4”分组培养处理后,弃除旧培养基,预冷PBS清洗2次,含有1% PMSF的RIPA裂解液冰上裂解30 min,4 ℃下12 000 r/min冷冻离心10 min后取上清。定量、电泳后将蛋白转至PVDF膜上,2.5%脱脂牛奶室温封闭2 h,4 ℃孵育一抗过夜,次日室温孵二抗1.5 h。Odyssey CLX双色红外荧光扫描成像系统检测LC3-II/LC3-I、Beclin1、p62、mTOR、P-mTOR的蛋白表达情况,β-actin为内参,计算相对灰度值及P-mTOR/mTOR比值。
1.2.7 统计学处理
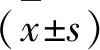
2 结果
2.1 各组细胞存活率情况
如图1所示,与Con组比,OGD 组细胞存活率显著降低(P<0.01)。与OGD组比,NMN 400、800、1 600 μmol/L浓度组的细胞存活率均显著提高(P<0.01),NMN 200 μmol/L、3 200 μmol/L浓度组的细胞存活率无明显差异(P>0.05)。

图1 各组细胞存活率情况
2.2 透射电镜观察各组细胞自噬小体及自噬溶酶体情况
如图2所示,Con组细胞形态正常,胞质均匀,有少量自噬溶酶体。与Con组比,OGD组胞质间隙变大,自噬空泡、自噬小体及自噬溶酶体增多,差异具有统计学意义(P<0.01)。与OGD组相比,NMN组及3-MA组自噬空泡、自噬小体及自噬溶酶体均减少,而RAPA组出现大量空泡及自噬小体和自噬溶酶体,差异具有统计学意义(P<0.01)。与3-MA组相比,3-MA+NMN组自噬空泡、自噬小体及自噬溶酶体减少,差异无统计学意义(P>0.05)。与RAPA组相比,RAPA+NMN组自噬空泡、自噬小体及自噬溶酶体均减少,差异具有统计学意义(P<0.01)。
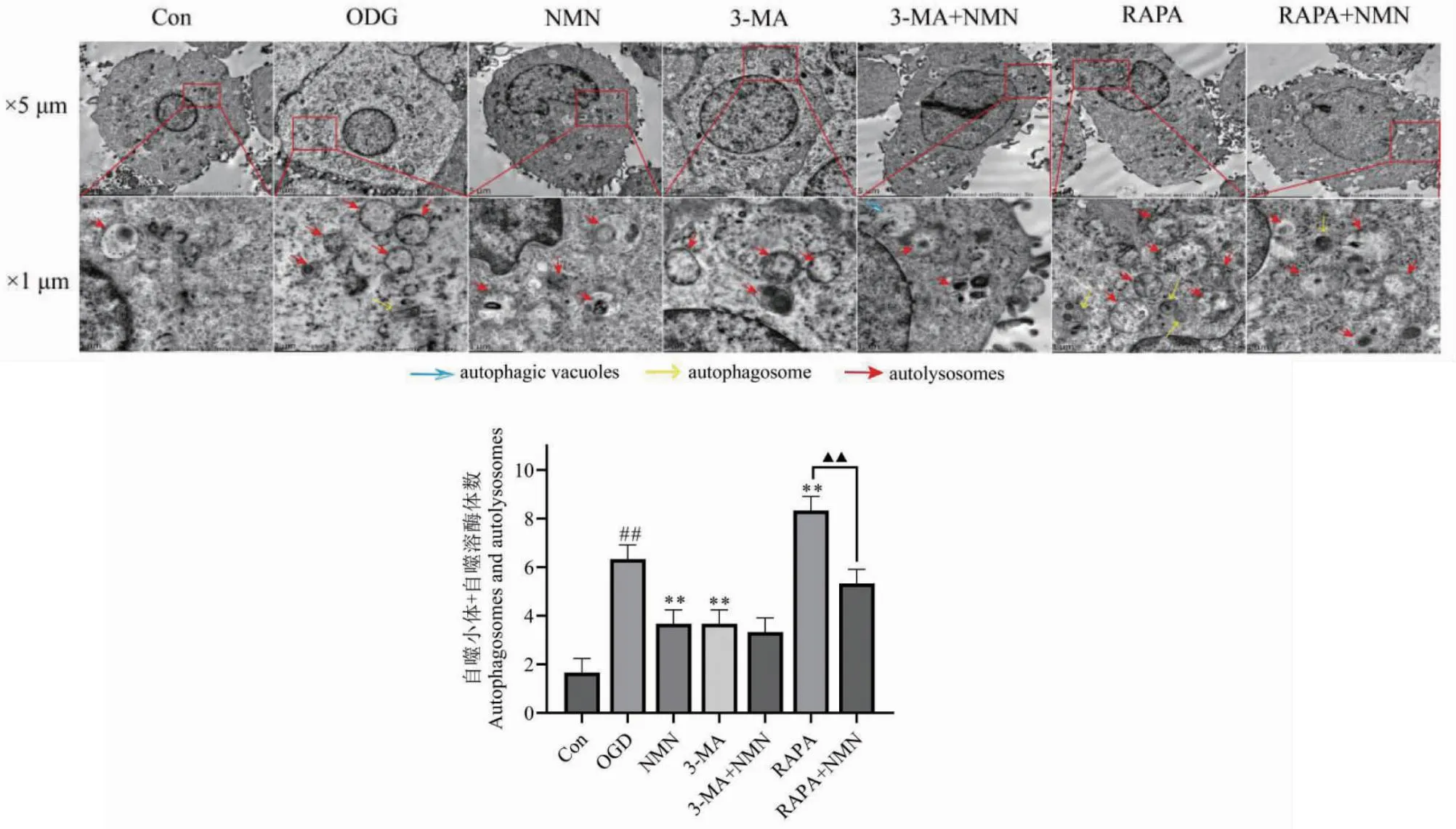
图2 透射电镜观察各组PC12细胞自噬小体及自噬溶酶体
2.3 MDC荧光染色观测各组PC12细胞自噬小体的情况
如图3和表1所示,Con组可见仅有少量荧光斑点,荧光强度较弱。与Con相比,OGD组荧光斑点增多,且荧光强度增强(P<0.01)。与OGD组相比,NMN组、3-MA组荧光斑点显著减少,荧光强度减弱(P<0.01);而RAPA组荧光斑点显著增多,荧光强度增强(P<0.01)。与3-MA组相比,3-MA+NMN组荧光斑点减少,荧光强度减弱,差异具有统计学意义(P<0.01)。与RAPA组相比,RAPA+NMN组荧光斑点显著减少,荧光强度减弱,差异具有统计学意义(P<0.01)。
表1 MDC荧光染色观测各组PC12细胞自噬小体的情况
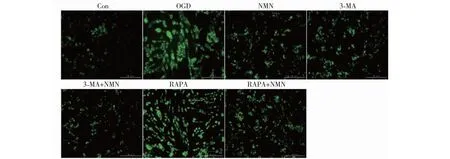
图3 MDC荧光染色观测各组PC12细胞自噬小体的情况(×20)
2.4 各组细胞自噬相关蛋白表达情况
如图4所示,与Con相比,OGD组细胞中LC3-II/LC3-I、Beclin1蛋白表达显著上调(P<0.01),P-mTOR/mTOR、p62蛋白表达显著下调(P<0.01);与OGD组相比,NMN组和3-MA组细胞中LC3-II/LC3-I、Beclin1蛋白表达显著下调(P<0.01),P-mTOR/mTOR、p62显著上调(P<0.01),而RAPA组则刚好相反;与RAPA组相比,RAPA+NMN组细胞中的LC3-II/LC3-I、Beclin1蛋白表达显著下调(P<0.01),P-mTOR/mTOR、p62显著上调(P<0.01)。
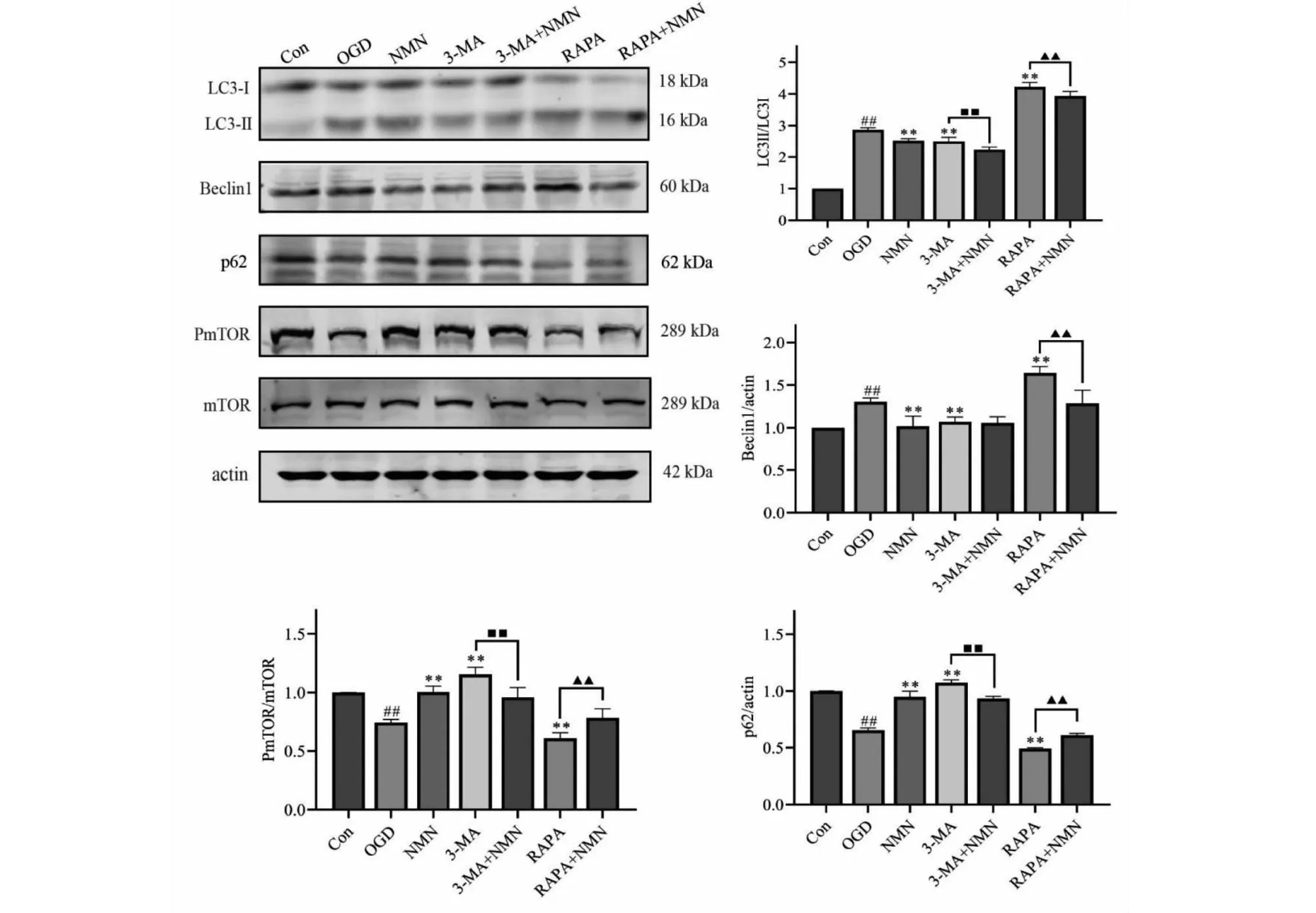
图4 各组细胞自噬相关蛋白表达情况
3 讨论与结论
2017年柳叶刀研究显示[11],脑卒中是造成我国生命损失年数的主要疾病,其病情进展快、致死率和致残率高。其中IS占整个脑卒中的60%~70% ,IS是由于血管阻塞导致大脑某一区域的血液供应减少而引起的[12]。脑组织缺血缺氧后,会引发细胞自噬、细胞凋亡、氧化应激、细胞内钙超载等一系列病理生理反应[13]。IS幸存者康复周期长,加大了全球经济负担[1]。目前,市场上用于防治IS的药物存在诸多禁忌。故不断探索防治IS的药物是非常有必要的。OGD是体外研究IS的经典模型[2]。PC12细胞系是研究神经元损伤最常用的细胞系之一,常用于缺血缺氧损伤的研究[14]。故本实验采用OGD PC12细胞模型展开体外研究。
NMN是人体内天然存在的物质,也存在于很多食物之中,分子量为334.22。为烟酰胺磷酸核糖转移酶反应的产物,也是NAD+的关键前体之一[7]。有研究发现[15],通过调节生物体内NMN的水平,对心脑血管疾病、神经退行性疾病及老化退行性疾病等有较好的治疗和修复作用。也有研究报道[16],给予NMN可减少大鼠MCAO模型的梗死面积和神经功能损伤。在本实验中,通过MTT证明了OGD能使PC12细胞存活率降低,NMN在400、800、1 600 μmol/L浓度可提高OGD PC12细胞存活率,其中800 μmol/L浓度时存活率最高;而在 NMN 200、3 200 μmol/L浓度时的细胞存活率无明显差异,这说明200 μmol/L浓度还未能达到提高OGD诱导的PC12细胞存活率的有效浓度,而3 200 μmol/L浓度则可能是浓度过高而对细胞本身产生了一定的损害。
细胞自噬被称为Ⅱ型细胞程序性死亡,是指细胞在自噬相关基因的调控下,利用溶酶体降解自身受损、变性或衰老的大分子物质以及细胞器以维持其生存、分化、生长及稳定的过程[3]。研究表明[17],IS后会诱发自噬,同时自噬也伴随着IS病理过程的发生发展,在IS的急性期、亚急性期、恢复期和后遗症期四个分期中扮演不同的调控作用[18]。
mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶,相对分子质量为289 kDa。其不同蛋白质结合,可形成2种不同复合物,即mTORCl和mTORC2。mTORCl对雷帕霉素敏感,负责整合生长因子和营养信号,主要调控细胞自噬、核糖体生物发生、蛋白翻译和脂质合成等[19]。mTOR被认为是自噬的阀门。研究表明,磷酸化mTOR可以减轻氧糖剥夺损伤,发挥保护细胞的作用[20]。3-MA是一种常用的自噬抑制剂[21]。RAPA是mTOR抑制剂,可通过抑制mTORC1诱导自噬的发生,也被叫作自噬激活剂[22]。本实验设置3-MA、RAPA 组,用以干预调控OGD诱导的PC12细胞自噬;同时也设置了3-MA、RAPA与药物联用组来观察NMN是否能对抗3-MA或RAPA对OGD诱导的PC12细胞自噬的影响。
Beclin-1、LC3和p62蛋白水平可作为自噬作用的重要检测指标。Beclin1是一个成熟的自噬调节因子,与自噬呈正相关。Beclin1与VPS15、VPS34 、ATG14等蛋白相互作用来执行自噬和膜运输功能[23]。LC3是酵母中的泛素样修饰剂 ATG8的同源物,被认为在自噬过程中起作用。LC3经过ATG4处理后失去C末端残基转变成LC3-I。LC3-I经历泛素化样酶促反应级联,共价连接至自噬体膜的脂质分子磷脂酰乙醇胺,转变成LC3-Ⅱ[24],LC3-II/LC3-I比值升高则说明自噬水平升高[25]。p62是反映自噬活性的标记蛋白,其蛋白的水平与自噬呈负相关,即出现自噬时,在细胞质中p62蛋白不断被降解;当自噬活性减弱、自噬功能缺陷时,p62蛋白会在细胞质中不断累积[26]。本实验通过Western blot技术证实了NMN能够下调 Beclin1、LC3-II/LC3-I蛋白相对表达量,上调P-mTOR/mTOR、p62蛋白表达量。此外还运用透射电镜技术和MDC法证实了NMN可减少OGD PC12细胞的自噬小体、自噬溶酶体数量及荧光斑点和强度。以上说明NMN能够抑制OGD诱导的PC12细胞自噬。
综上,提示一定剂量的NMN可抗OGD诱导的PC12细胞自噬损伤,从而发挥细胞保护作用,并且这种保护作用可能和mTOR相关通路有关。本研究可为NMN防治OGD诱导的细胞自噬损伤提供一定的靶标参考,为天然化合物NMN的开发积累一定实验室数据。

