不同乳酸菌发酵留兰香纯露的抗氧化活性比较
蔡春静,李璇,王莹,张元成,楚杰*
(1.齐鲁工业大学(山东省科学院)生物研究所,山东济南 250013;2.山东昌龙农业科技有限公司,山东济南 251600)
留兰香,别名绿薄荷,属唇形科,多年生草本植物[1]。留兰香具有疏风清热、解表和中、理气止痛的功效,可用于治疗感冒头痛、胃痛、咳嗽、腹胀、吐泻、痛经、肢麻、跌扑肿痛[2]等。研究表明,留兰香中含有的香芹酮,不仅具有显著的抗炎作用[3],其抗炎机制可能与减少巨噬细胞的产生及炎性迁移、抑制促炎因子表达等炎症反应进程调控有关[4];而且留兰香油还具有明显的抗氧化作用[5]。目前,留兰香植株收割后加工提取留兰香油,在留兰香精油蒸馏过程中产生的副产物——留兰香纯露,主要包含微量的香精油和水溶性混合物。与精油相比,其中含有丰富的黄酮苷、木脂素苷、萜苷以及酚酸类化合物。由于市场上对纯露的价值缺乏认知,加工企业在获得挥发油后,纯露多被作为工业废水排放,不仅使环境受到污染,也是对留兰香资源的极大浪费。研究表明,留兰香纯露有较好的自由基清除能力和总抗氧化能力。
近年来,化妆品产业呈现出蓬勃发展的态势,皮肤问题愈发成为人们关注的热点,紫外线辐射引起的皮肤氧化是导致皮肤损伤、老化的重要原因[6-7]。研究发现,长期使用添加化学抗氧化剂的化妆品对生物体有潜在的毒副作用[8]。因此,开发以天然成分为主的抗氧化产品是近年来的研究重点。本文选用不同乳酸菌发酵的留兰香纯露作为研究对象,研究其所具有的抗氧化能力,以期为后续其在食品、日用化学品、医药等领域的开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
鼠李糖乳杆菌(Lactobacillusrhamnosus)LR-1、植物乳杆菌(Lactobacillusplantarum)LP-1、粪肠球菌(Enterococcusfaecalis)EF-1、嗜酸乳杆菌(Lactobacillusacidophilus)LA-1:山东省科学院生物研究所工业微生物实验室保存;留兰香纯露:山东昌龙农业科技有限公司。
2,2-联氨-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)]:北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):梯希爱(上海)化成工业发展有限公司;K2S2O8、Na2HPO4:天津市科密欧化学试剂有限公司;FeSO4、NaH2PO4:国药集团化学试剂有限公司;邻苯三酚、水杨酸:上海麦克林生化科技股份有限公司;MRS 培养基:青岛高科园海博生物技术有限公司。所有试剂均为分析纯。
1.2 仪器与设备
V-5600 分光光度计:上海元析仪器有限公司;HH-3A 数显恒温水浴锅:常州国华电器有限公司;HWS-150 恒温恒湿培养箱:上海精宏实验设备有限公司;GZC-30013 智能光照培养箱:合肥右科仪器设备有限公司。
1.3 方法
1.3.1 菌种活化
从保存鼠李糖乳杆菌、植物乳杆菌、粪肠球菌、嗜酸乳杆菌的甘油管中取50 μL 接种到MRS 培养基中,37 ℃恒温培养24 h。
1.3.2 不同乳酸菌发酵留兰香纯露
将活化的鼠李糖乳杆菌、植物乳杆菌、粪肠球菌、嗜酸乳杆菌以3%接种量分别接种到留兰香纯露体积分数分别为20%、40%、60%、80%、100% 的MRS 培养液中,37 ℃恒温培养24 h,稀释涂平板,记录活菌数。
1.3.3 不同乳酸菌发酵的留兰香纯露的体外抗氧化力测定
1.3.3.1 样品制备
不同浓度的留兰香纯露:用无菌水将留兰香纯露稀释成体积分数为20%、40%、60%、80%、100% 的留兰香纯露稀释液。
不同浓度乳酸菌发酵的留兰香纯露:将1.3.2 制备的不同体积分数发酵后的留兰香纯露用相同浓度纯露分别稀释成相同活菌数,避免活菌数对后期试验结果造成影响。
1.3.3.2 不同乳酸菌发酵的留兰香纯露清除DPPH 自由基能力的测定
DPPH 自由基清除力测定参照Bae 等[9]的方法并略作改进。配制0.180 mmol/L DPPH 储备液,各取2 mL DPPH 储备液与样品充分摇匀后37 ℃避光反应30 min,517 nm 测吸光度。空白组以2 mL 无菌水代替DPPH 溶液,对照组以2 mL 无菌水代替样品,相同方法处理。每组设置3 个平行试验,结果取其平均值。DPPH 自由基清除率(X,%)计算如式(1)。
式中:A0、A1、A2分别为DPPH 自由基清除能力测定反应中配制的对照组、样品组、空白组反应液在517 nm 波长处测得的吸光度。
1.3.3.3 不同乳酸菌发酵的留兰香纯露清除ABTS+自由基能力的测定
ABTS+自由基清除能力测定参考李新[10]的方法并略作改进。将ABTS 溶液(7.00 mmol/L)与硫酸二氢铵溶液(2.45 mmol/L)按体积比1∶1 混合,避光放置12~16 h,即为ABTS 储备液,将其用无水乙醇稀释40~50 倍,使稀释液在波长734 nm 处吸光度为0.70±0.02(无水乙醇调零),即ABTS 工作液。加入6 mL ABTS工作液与3 mL 样品,充分摇匀后25 ℃下避光反应30 min,以无水乙醇调零,735 nm 测定吸光度。空白组以6 mL 无菌水代替ABTS 工作液,对照组以3 mL 无菌水代替样品,相同方法处理。每组设置3 个平行,结果取其平均值。ABTS+自由基清除率(Y,%)计算如式(2)。
式中:A0、A1、A2分别为ABTS+自由基清除能力测定反应中配制的对照组、样品组、空白组反应液在735 nm 波长处测得的吸光度。
1.3.3.4 不同乳酸菌发酵的留兰香纯露清除·OH 能力的测定
·OH 清除能力测定参考张新霞[11]的方法并略作改动。加入6 mmol/L 的FeSO4溶液、样品及相同摩尔数的H2O2、水杨酸溶液各2 mL,充分摇匀后静置反应30 min,以去离子水调零,510 nm 测吸光度。空白组以2 mL 无菌水代替水杨酸,对照组以2 mL 无菌水代替样品,相同方法处理。每组设置3 个平行,结果取其平均值。·OH 清除率(P,%)计算如式(3)。
式中:A0、A1、A2分别为·OH 清除能力测定反应中配制的对照组、样品组、空白组反应液在510 nm 波长处测得的吸光度。
1.3.3.5 不同乳酸菌发酵的留兰香纯露清除O2-自由基能力的测定
O2-自由基清除能力测定参照周江菊等[12]的方法并有所修改。加入4.5 mL 50 mmol/L 的Tris-HCl 缓冲液(pH8.2)及1 mL 样品,充分摇匀后,25 ℃水浴25 min。再加入2 mL 10 mmol/L 邻苯三酚溶液,25 ℃水浴5 min,最后加入1 滴浓盐酸终止反应。以去离子水调零,299 nm 测定吸光度。空白组以2 mL 无菌水代替邻苯三酚溶液,对照组以1 mL 无菌水代替样品,相同方法处理。每组设置3 个平行试验,结果取其平均值。·O2-清除率(Z,%)计算如式(4)。
式中:A0、A1、A2分别为·O2-清除能力测定反应中配制的对照组、样品组、空白组反应液在299 nm 波长处测得的吸光度。
1.3.3.6 不同乳酸菌发酵的留兰香纯露总还原力的测定总还原力的测定参照Ahmadi 等[13]的方法并稍作修改。加入2.5 mL 0.2 mol/L 磷酸盐缓冲液、2.5 mL 1% 铁氰化钾以及1 mL 样品,充分摇匀后,50 ℃水浴20 min。再加入2.5 mL 10% 三氯乙酸,4 000 r/min 离心10 min,最后取5 mL 上清液、5 mL 无菌水以及1 mL 0.1% 三氯化铁,静置10 min。以去离子水调零,700 nm 测吸光度。空白组以1 mL 无菌水代替样品,相同方法处理。每组设置3 个平行试验,结果取其平均值。总还原力(B)计算如式(5)。
式中:A0、A1分别为总还原力测定反应中配制的空白组、样品组反应液在700 nm 波长处测得的吸光度。
1.4 数据处理与分析
采用Excel 2019 软件处理数据,数据以平均值±标准差表示,数据采用单因素方程分析——最小显著性差异(least significant difference,LSD)检验进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 不同乳酸菌发酵留兰香纯露的活菌数
前期研究发现不同乳酸菌抗氧化能力存在差异,但不同乳酸菌的抗氧化机制尚未完全阐明。因此,选取4种不同的乳酸菌对不同体积分数的留兰香纯露进行发酵,通过比较其在不同体积分数的留兰香纯露中的发酵生长情况,分析比较体外抗氧化能力差异,不仅可以挖掘具有优良抗氧化特性的乳酸菌,而且为下一步留兰香纯露的开发应用提供参考。不同乳酸菌发酵的留兰香纯露的活菌数见表1。

表1 不同乳酸菌发酵的留兰香纯露的活菌数Table 1 Bacteria counts in the spearmint hydrolates fermented by different lactic acid bacteria CFU/mL
由表1 可知,经4种不同乳酸菌发酵的不同体积分数的留兰香纯露活菌数各有差异,粪肠球菌及植物乳杆菌发酵的20%、40% 纯露活菌数均高于0% 纯露的乳酸菌发酵液,说明低浓度的留兰香纯露可以促进植物乳杆菌及粪肠球菌的生长。但经鼠李糖乳杆菌、嗜酸乳杆菌发酵的20%、40%纯露以及经4 种菌发酵的60%纯露中的活菌数与初始菌数相比,虽然有所提高,但均低于0%纯露的乳酸菌发酵液,说明不同浓度的留兰香纯露对4 种乳酸菌的生长有一定的影响,这一结论在乳酸菌发酵的80%、100% 纯露可以得到验证,其植物乳杆菌、粪肠球菌及嗜酸乳杆菌发酵后其活菌数均低于接种量。
为了进一步探究以上4 种乳酸菌在留兰香纯露中的发酵生长情况,以0% 纯露的4 种乳酸菌发酵液和未经发酵的留兰香纯露为对照,对4 种乳酸菌发酵的不同体积分数的留兰香纯露(20%、40%、60%)进行体外抗氧化试验评价。
2.2 不同乳酸菌发酵的不同体积分数的留兰香纯露的体外抗氧化能力比较
2.2.1 不同乳酸菌发酵的不同体积分数的留兰香纯露对DPPH 自由基的清除能力
DPPH 在有机溶剂中较为稳定,在517 nm 波长处有强吸收,当自由基清除剂存在时,单电子与抗氧化剂中的质子配对而被还原,溶液变浅,吸光度降低,且这种颜色变浅的程度与配对电子数呈化学剂量关系,即吸光度越低,样品清除自由基能力越强,从而用于评价样品的抗氧化能力[14]。因此采用该方法测定不同乳酸菌发酵的不同体积分数的留兰香纯露对DPPH 自由基的清除率,结果见表2 及图1。

图1 乳酸菌发酵的不同体积分数留兰香纯露对DPPH 自由基的清除作用Fig.1 DPPH free radical scavenging effects of different volume fractions of spearmint hydrolates fermented by lactic acid bacteria

表2 不同乳酸菌发酵的留兰香纯露对DPPH 自由基的清除能力Table 2 DPPH free radical scavenging effects of spearmint hydrolates fermented by different lactic acid bacteria%
研究证明,植物乳杆菌NDC 75017、嗜酸乳杆菌NCFM、植物乳杆菌ATCC 14917、鼠李糖乳杆菌LGG发酵液对DPPH 自由基的清除率为22%~55%[15]。由表2 可知,本试验所用菌株的发酵液对DPPH 自由基清除率明显较高,这也说明不同菌株的抗氧化能力不同。留兰香纯露、乳酸菌发酵液及不同乳酸菌发酵的留兰香纯露均对DPPH 自由基有清除作用。这与已有研究的许多植物纯露都具有一定的抗氧化活性结论相一致[16],且本研究中留兰香纯露对DPPH 自由基的最高清除率高于文献报道的玫瑰纯露[17]、麸炒枳壳纯露、吴茱萸纯露、车前子纯露和黄栀子纯露等[16]。结果显示,4 种乳酸菌发酵的留兰香纯露对DPPH 自由基清除率要高于留兰香纯露和乳酸菌发酵液的清除率。说明留兰香纯露经乳酸菌发酵后其抗氧化活力有了极大提高,其中鼠李糖乳杆菌和植物乳杆菌发酵的留兰香纯露提升尤为显著(P<0.05)。
图1 结果显示,相同体积分数,乳酸菌发酵的留兰香纯露对DPPH 自由基的清除率均高于留兰香纯露,且乳酸菌发酵的留兰香纯露对DPPH 自由基清除率随着体积分数的增加而增加,且呈现一定的浓度依赖性。4 种乳酸菌发酵的留兰香纯露DPPH·清除率均在体积分数为60%时达到最大值,其与相同体积分数留兰香纯露相比分别增加了1.17、1.17、1.15、1.15 倍。研究显示,乳酸菌具有DPPH 自由基清除活性可能与菌体产生的胞外多糖有关,Xu 等[18]研究显示DPPH 自由基清除活性与由双歧杆菌分离出的胞外多糖的浓度呈正相关。乳酸菌发酵的留兰香纯露对DPPH 自由基清除活性可能也与此有关。
2.2.2 不同乳酸菌发酵的不同体积分数的留兰香纯露对ABTS+自由基的清除作用
ABTS+自由基在适当的氧化剂作用下氧化成绿色的自由基阳离子,当有抗氧化物质存在时,ABTS+·的产生会被抑制,使反应体系褪色,吸光度变小,在734 nm 处测定吸光度即可计算出药物的清除能力[19]。本试验采用该方法测定不同乳酸菌发酵的不同体积分数的留兰香纯露对ABTS+自由基的清除作用,结果见表3 及图2。
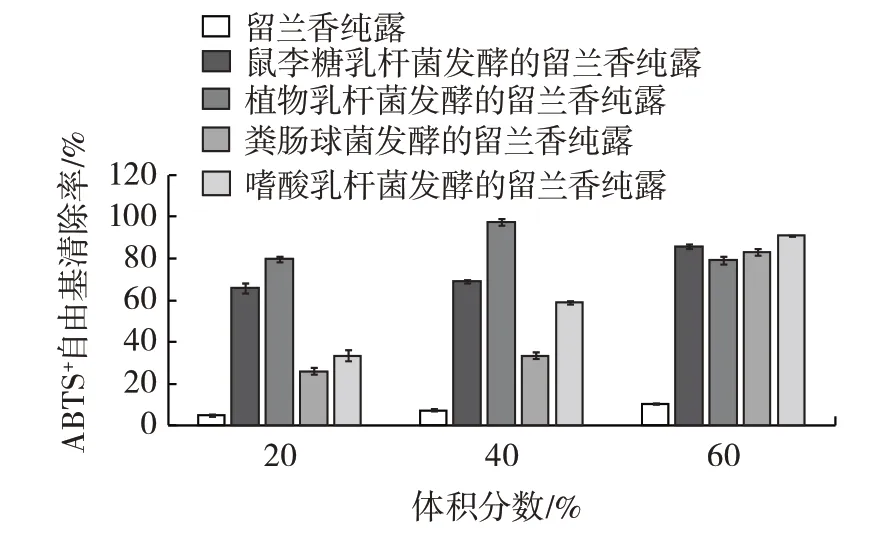
图2 乳酸菌发酵的不同体积分数留兰香纯露对ABTS+自由基的清除作用Fig.2 ABTS+free radical scavenging effects of different volume fractions of spearmint hydrolates fermented by lactic acid bacteria
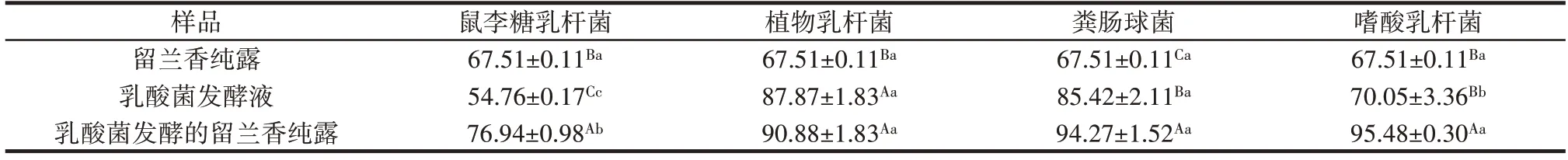
表3 不同乳酸菌发酵的留兰香纯露对ABTS+自由基的清除作用Table 3 ABTS+free radical scavenging effects of spearmint hydrolates fermented by different lactic acid bacteria%
由表3 可知,留兰香纯露、乳酸菌发酵液及不同乳酸菌发酵的留兰香纯露对ABTS+自由基的清除作用均超过50%,证明其均有良好的抗氧化能力。留兰香纯露略低于文献报道的香榧纯露对ABTS+自由基的清除率[20],但留兰香纯露经4 种乳酸菌发酵后对ABTS+自由基的清除率大大提高,且高于留兰香纯露和乳酸菌发酵液。
由图2 看出,ABTS+自由基的清除率与留兰香纯露的体积分数呈正相关,随着体积分数的增加,经鼠李糖乳杆菌、粪肠球菌及嗜酸乳杆菌发酵的20%、40%、60%留兰香纯露对于ABTS+自由基的清除率也随之增加。4 种乳酸菌发酵的留兰香纯露对ABTS+自由基清除能力与相同体积分数的留兰香纯露相比有较大提升,除植物乳杆菌发酵的留兰香纯露是在体积分数为40%时达到最大值外,其余均是在体积分数为60%时达到最大值。
2.2.3 不同乳酸菌发酵的不同体积分数的留兰香纯露对·OH 的清除作用
在体外实验体系中,环境中的Fe3+和Fe2+催化过氧化氢和超氧阴离子反应生成羟基自由基,羟基自由基是活性氧中反应能力最强的一种,几乎可以和细胞内的一切有机物反应,能够杀死红细胞,降解细胞膜、DNA 和多糖类化合物,引起组织细胞病变,导致疾病发生和加速机体衰老[21]。采用水杨酸法对·OH 清除能力进行测定的结果见表4 和图3。

图3 乳酸菌发酵的不同体积分数留兰香纯露对·OH 的清除作用Fig.3 ·OH scavenging effects of different volume fractions of spearmint hydrolates fermented by lactic acid bacteria

表4 不同乳酸菌发酵的留兰香纯露对·OH 的清除作用Table 4 ·OH scavenging effects of spearmint hydrolates fermented by different lactic acid bacteria%
研究显示,菌体具有较强的羟自由基清除能力可归结为在细胞内存在着针对Cu2+和Fe2+的天然螯合物质,Cu2+和Fe2+能够参与机体多种氧化过程,因此乳酸菌对Cu2+和Fe2+的螯合作用,能够从根本上减少羟自由基的产生[22]。这可能是乳酸菌发酵液对·OH 具有较高清除率的原因。由表4 可知,留兰香纯露对·OH的清除率在12% 左右,明显高于报道中高良姜纯露对·OH 的清除率[23]。4 种乳酸菌发酵的留兰香纯露对·OH 的清除作用远高于留兰香纯露及乳酸菌发酵液的清除作用,且相互之间差异显著(P<0.05)。其中嗜酸乳杆菌发酵的留兰香纯露的·OH 清除率最高,达到95.48%,与留兰香纯露及乳酸菌发酵液相比分别增加了6.36 倍、23.06%。
如图3所示,留兰香纯露对·OH 的清除作用相对较低,但经乳酸菌发酵的留兰香纯露对·OH 的清除作用大幅升高,以体积分数60% 尤为显著,与相同体积分数的留兰香纯露相比,·OH 清除率增加7.18、6.54、6.91、7.67 倍。
2.2.4 不同乳酸菌发酵的不同体积分数的留兰香纯露对O2-自由基的清除作用
·O2-是机体在代谢过程中产生的一种具有很强氧化能力的自由基,抗氧化物质清除·O2-是衡量抗氧化能力的一个重要指标[24]。本试验釆用邻苯三酚自氧化方法,在碱性条件下,邻苯三酚可发生自氧化,产生·O2-等中间产物,·O2-又可加快邻苯三酚的自氧化速率,所以可通过检测抗氧化剂对邻苯三酚自氧化速率的影响,反映抗氧化剂对·O2-的清除能力,结果见表5和图4。
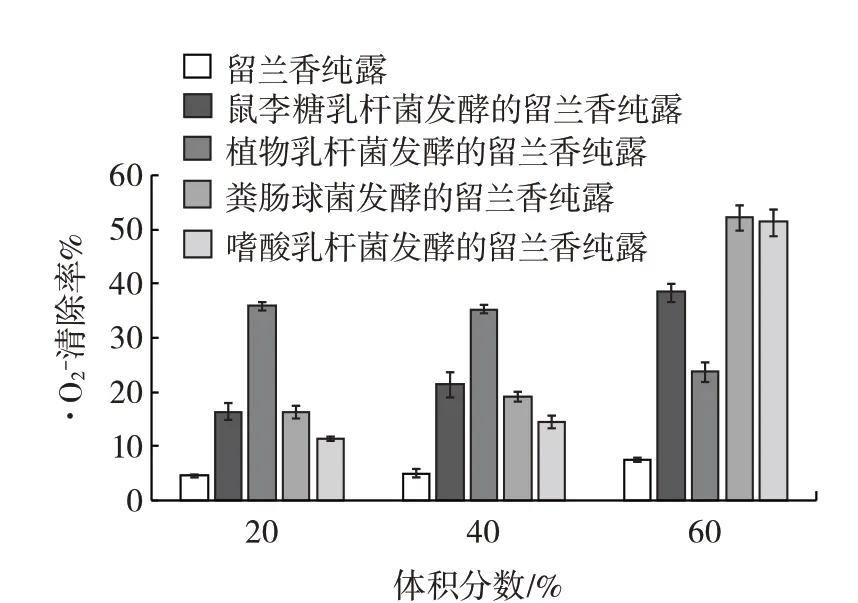
图4 乳酸菌发酵的不同体积分数留兰香纯露对·O2-的清除作用Fig.4 ·O2-scavenging effects of different volume fractions of spearmint hydrolates fermented by lactic acid bacteria

表5 留兰香纯露及乳酸菌发酵的留兰香纯露对·O2-的清除作用Table 5 ·O2-scavenging effects of spearmint hydrolates fermented and not fermented by different lactic acid bacteria%
由表5 看出,粪肠球菌、嗜酸乳杆菌乳发酵的留兰香纯露对·O2-的清除率要明显高于留兰香纯露和乳酸菌发酵液,且差异均显著(P<0.05)。说明纯露与乳酸菌发酵液之间在·O2-的清除作用方面同样存在叠加效应,可以相互促进其对·O2-的清除。
由图4 可知,乳酸菌发酵的留兰香纯露对·O2-清除能力相较于其他自由基稍差,为20%~50%,可能是因为菌体内抗氧化酶含量较少。与其他自由基的清除效果相同,4 种乳酸菌发酵的留兰香纯露对·O2-的清除力有了大幅升高。除植物乳杆菌发酵的纯露以外,其余3 种菌发酵的留兰香纯露均在60% 时清除效果最佳,与留兰香纯露相比分别增加了4.03、5.84、5.73 倍。
2.2.5 不同乳酸菌发酵的不同体积分数的留兰香纯露总还原力比较
研究表明,一般情况下某些物质的抗氧化性与还原性之间存在正相关性,还原力越强,其抗氧化性越强,因此可通过测定物质的还原力来评估其抗氧化能力,若吸光度越大,则还原性越高,抗氧化活性也就越高[25]。因此本试验通过测定其总还原力,侧面反映其抗氧化性,结果见表6 和图5。

图5 乳酸菌发酵的不同体积分数留兰香纯露的总还原力Fig.5 Total reducing power of different volume fractions of spearmint hydrolates fermented by lactic acid bacteria
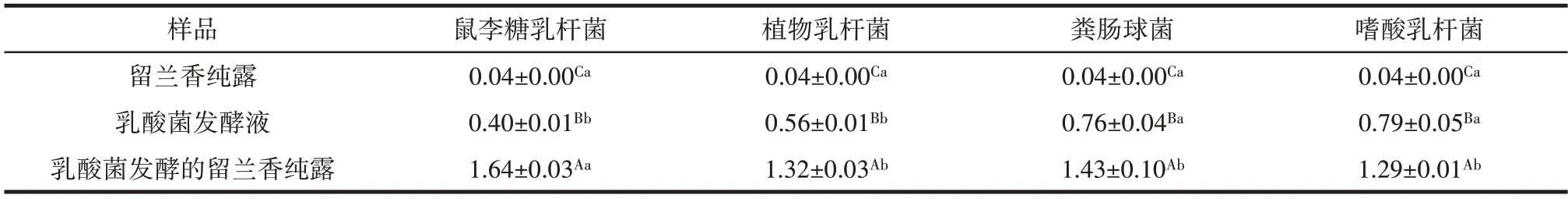
表6 留兰香纯露及乳酸菌发酵的留兰香纯露的总还原力(A700 nm)Table 6 Total reducing power of spearmint hydrolates fermented and not fermented by different lactic acid bacteria
表6 结果显示,4 种乳酸菌发酵的留兰香纯露总还原力与留兰香纯露及乳酸菌发酵液具有显著差异(P<0.05)。其中以鼠李糖乳杆菌增长幅度最大,分别增长了38.04、3.10 倍;其次为粪球杆菌发酵纯露、植物乳杆菌发酵纯露、嗜酸乳杆菌发酵纯露。
由图5 可知,4 种乳酸菌发酵的留兰香纯露的总还原力均远高于留兰香纯露。与上述结论类似,大部分乳酸菌留兰香纯露在体积分数60% 时的总还原力最强。乳酸菌发酵留兰香纯露体积分数在60%时,鼠李糖乳杆菌、植物乳杆菌、粪肠球菌、嗜酸乳杆菌发酵的留兰香纯露的还原力在A700nm处可达到1.2~1.6。
3 结论
本试验结果表明,留兰香纯露具有一定的体外抗氧化活性,且在一定范围内,体积分数越高,抗氧化性越好。与留兰香纯露相比,不同乳酸菌发酵的留兰香纯露在抗氧化方面更具有优势。留兰香纯露与乳酸菌发酵液有叠加效应,导致乳酸菌发酵留兰香纯露对DPPH 自由基、ABTS+自由基、·OH、·O2-的清除能力及总还原力均有大幅提升,尤其在·OH 清除能力和总还原力方面尤为突出。通过对比不同乳酸菌发酵的不同体积分数留兰香纯露的抗氧化力,多数乳酸菌在留兰香纯露体积分数为60% 时,DPPH 自由基、ABTS+自由基、·OH、·O2-的清除能力以及其总还原力最高。本试验仅是对不同乳酸菌发酵的留兰香纯露的抗氧化能力做了初步探讨,留兰香纯露是否可以作为以天然植物成分为主的抗氧化产品还需要进一步深入研究。

