脂蛋白(a)与前循环大动脉闭塞AIS血管内治疗患者临床结局的相关性*
王 芳,郝喜娃,李月春
(1.包头医学院中心临床医学院, 内蒙古包头 014040;2.包头市中心医院)
脑卒中是世界范围内致残和致死的主要原因,急性缺血性卒中(Acute Ischemic Stroke,AIS)是其中最常见的类型[1],并且由前循环大血管闭塞(anterior circulation large vessel occlusion,aLVO))引起的AIS具有更高的致残率和致死率。治疗AIS的首要举措是尽早开通闭塞血管、及时恢复血供,进而挽救缺血灶以及周围的血液低灌注区。大量研究表明,对于aLVO患者,血管内治疗(Endovascular treatment,EVT)是一种显著安全而有效的方式,且患者可获得良好的功能预后[2-3],EVT可直接清除血管壁附着的血栓,加速血管再通,具有更高的再通率[4- 5]。尽管EVT已被证实可减少AIS病死率和改善神经功能结局,但是按照指南推荐评估,EVT患者术后90天随访时仍有半数以上患者未能取得良好的功能结局,几乎有1/6的患者在接受EVT后90天内死亡[6]。因此,探索早期、准确和可靠预测与EVT术后不良结局的相关因素至关重要。
脂蛋白(a)[Lipoprotein(a),Lp(a)]是存在于人体血浆中的一种可遗传特征[7],其结构与低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)极为相似,由载脂蛋白B100(Apolipoprotein B100,ApoB-100)和载脂蛋白(a)[Apolipoprotein (a),Apo(a)]通过二硫键结合形成[8],其特殊的结构特征和属性具有促动脉粥样硬化形成、促炎和促血栓形成的作用,已被证实是与心脑血管疾病存在独立因果关系的危险因素[9-10],并且研究显示Lp(a)与心肌梗死患者静脉溶栓后冠状动脉再通密切相关[11]。我们前期研究也证实Lp(a)对AIS患者静脉溶栓1年时的临床结局有一定的预测价值,然而,Lp(a)是否与前循环大动脉闭塞AIS患者EVT术后临床结局具有相关性尚不完全清楚,因此本研究旨在分析两者之间的相关性,从而为临床上此类患者的治疗提供参考。
1 对象与方法
1.1对象 选择2020年1月至2022年8月就诊于包头市中心医院神经内科行血管内治疗或者静脉溶栓桥接取栓治疗的急性前循环大血管闭塞性脑梗死住院患者265例为研究对象。纳入标准:①年龄≥18岁;②卒中前mRS评分≤2;③有缺血性卒中导致的神经功能缺损症状;④经CTA、MRA或DSA证实为前循环大血管闭塞(颈内动脉、大脑中动脉M1、M2段、大脑前动脉)所致卒中,可在发病24 h内治疗;⑤获得患者或其家属的知情同意,签署静脉溶栓及血管内治疗的知情同意书。排除标准:①有活动性出血或明显出血倾向;②基线血糖<2.7 mmol/L或>22.2 mmol/L;③药物无法控制的严重高血压;④严重心、肝、肾功能不全;⑤术前感染、风湿免疫疾病、肿瘤患者;⑥全脑血管造影(DSA)检查禁忌,严重造影剂过敏或碘造影剂绝对禁忌;⑦CT或MRI提示颅内出血。排除临床资料不完整及拒绝手术的患者。入选患者严格按流程筛选。见图1。
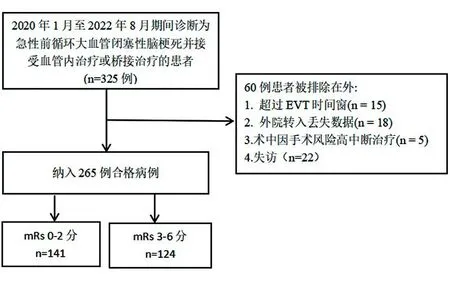
图1 患者筛选流程图
1.2研究方法
1.2.1收集患者基线资料 包括人口基本信息、血管危险因素、既往病史、入院及术后24 h NIHSS评分、TOAST分型、实验室检查、影像学检查(头颅CT或核磁),围手术期及治疗的相关信息包括入院到股动脉穿刺时间(DPT)、发病至首次开通时间等信息。由专业神经内科医师完成上述资料的采集,并记录入院及术后24 h NIHSS评分。
1.2.2生化指标 采集患者入院24 h之内空腹血标本,包括入院血糖、糖化血红蛋白、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、Lp(a),利用生化免疫比浊法检测Lp(a)的水平进行分析。
1.2.3血管内治疗程序 患者入院后经头颅核磁或CT血管成像证实为急性前循环大血管闭塞所致卒中,并通过神经介入团队评估EVT的可行性,在时间窗内接受静脉溶栓治疗后发现效果不佳或病情进展的患者,迅速启动EVT程序进行桥接治疗。对于有静脉溶栓禁忌、超过溶栓时间窗的病人直接进行血管内治疗。对无检查禁忌的患者在术后行头颅核磁或头颅平扫CT评估血管开通情况及有无出血转化。
1.3终点事件及其定义 主要结局:3个月时实现功能独立患者比例即预后良好的患者比例,定义为改良Rankin量表(mRs)评分0~2分。
1.4临床结果评估及随访 疗效评价指标:用mRs评分表评判,术后3个月时mRs 0~2分为预后良好,3~6分为预后不良。mRS评分通过标准化的面对面访谈或电话随访进行盲法评估,随访者是神经内科临床医师或者是经过专门训练的随访者。随访:患者出院3个月时采用面对面或通电话的方式进行随访,通过mRs评分记录患者当时身体状况。随访截至期为2022年11月。
2 结果
2.1两组一般资料比较 研究对象平均年龄为(62.7±12.4)岁,其中男性180例(67.9%),根据mRs评分将患者分为预后良好组和预后不良组。预后良好组患者为141例(53.2%),预后不良组为124例(46.8%),与预后良好组相比,预后不良组的患者年龄较大(P<0.05)、心房颤动发生率较高(P=0.005)、入院时NIHSS评分较高(P<0.05)、大动脉粥样硬化型卒中发生率较低(P<0.05)、心源性栓塞型卒中发生率较高(P<0.05)。并且预后不良组中血糖、糖化血红蛋白、Lp(a)高于预后良好组(P<0.05)。剩余基线资料的组间差异均无统计学意义(P>0.05)。见表1。
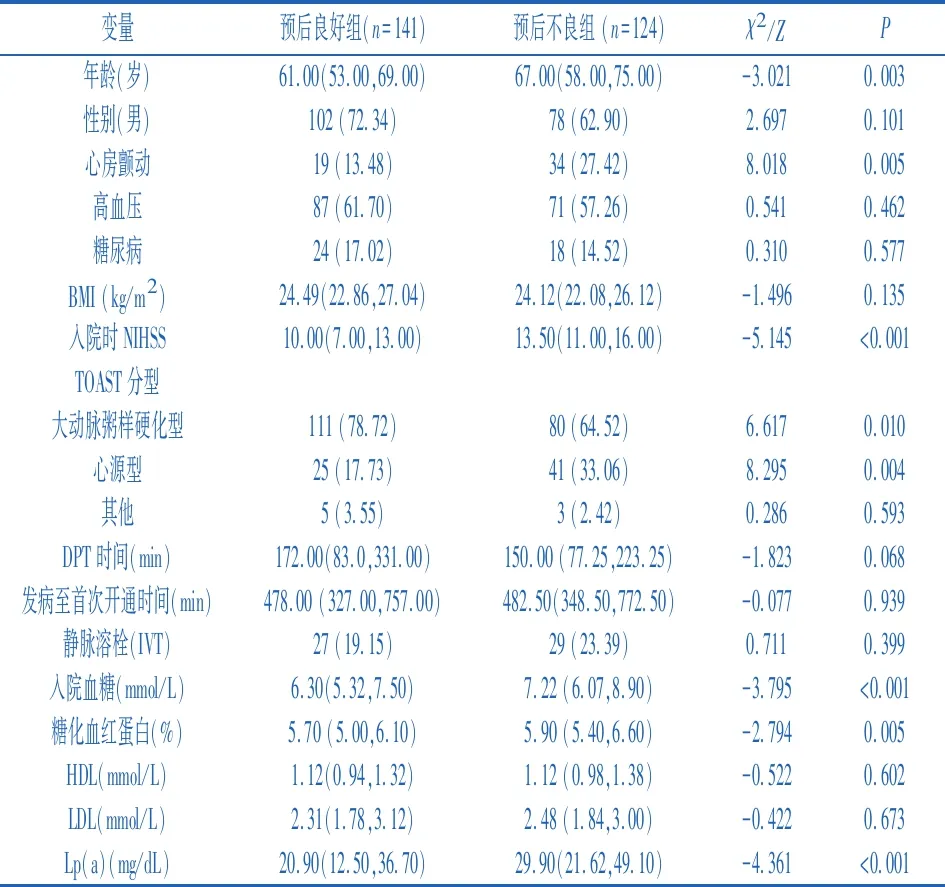
表1 根据EVT患者3个月预后分组的基线特征[n(%),M(P25,P75)]
2.2影响EVT患者预后相关因素的回归分析 以EVT患者术后3个月时的临床预后作为因变量,同时纳入年龄、入院时NIHSS评分、心房颤动、大动脉粥样硬化型卒中、心源型卒中、Lp(a)、入院血糖、糖化血红蛋白为自变量进行多因素Logistics回归分析,结果显示Lp(a)(OR=1.026;95%CI=1.012-1.041;P<0.001)、入院NIHSS评分(OR=1.149;95%CI=1.079~1.223;P<0.001)、年龄(OR=1.028;95%CI=1.004~1.053;P=0.021)依然是EVT患者术后3个月时不良预后的危险因素。见表2。
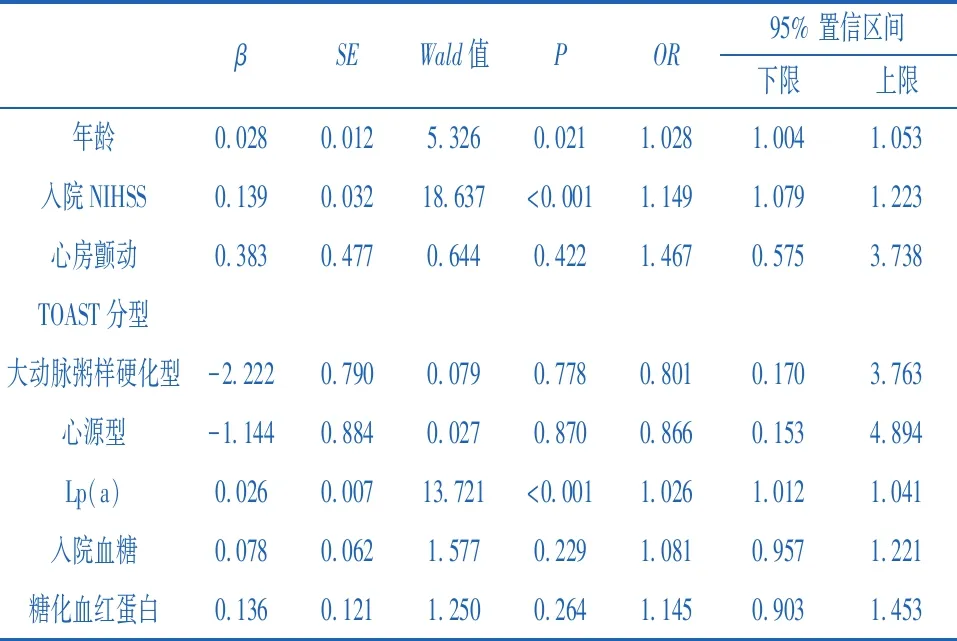
表2 影响EVT患者预后的多因素Logistic回归分析
2.3Lp(a)对EVT患者临床结局的预测价值 本研究提示Lp(a)与AIS患者EVT术后3个月时的不良预后相关,采用ROC曲线确定Lp(a)的最佳截止点,并计算EVT术后3个月时不良结局时的灵敏度和特异度。Lp(a)对EVT术后临床结局预测的ROC曲线显示AUC为0.655,95%CI0.590~0.721(P<0.001),预测截断值为20.95 mg/dL,灵敏度为77.4%,特异度为51.1%,提示Lp(a)对EVT患者术后临床结局有一定的预测价值。见图2。

图2 Lp(a)与EVT患者术后临床结局的ROC曲线分析
3 讨论
本研究首次在前循环大动脉闭塞急性缺血性卒中并行EVT的人群中分析了Lp(a)水平与EVT患者术后3个月预后的关系。研究结果表明,较高水平的Lp(a) 是EVT患者术后3个月时不良预后的独立危险因素,且对其有一定的预测价值。
近年来,随着Lp(a)逐渐受到大众的关注,大量关于Lp(a)与AIS的研究纷纷提示高水平Lp(a)与AIS 疾病风险增加相关,并且是其不良预后的独立危险因素[12-13]。本研究纳入经过EVT的265例前循环大血管闭塞AIS患者,其中有141例(53.2%)取得了良好的预后,结果显示预后不良组Lp(a)水平要高于预后良好组[20.90(12.50,36.70)vs29.90(21.62,49.10)mg/dL,P<0.001],多因素Logistics回归分析结果显示Lp(a)OR=1.026;95%CI=1.012~1.041(P<0.001),提示Lp(a)与EVT患者3个月预后不良独立相关。最近的一项研究发现Lp(a)不仅是冠状动脉狭窄严重程度的独立预测因素,也是此类患者介入术后发生不良心血管事件的独立预测因素[14],本研究中同样发现Lp(a)对EVT患者术后的不良结局有预测价值,ROC曲线显示,AUC为0.655,95%CI0.590~0.721(P<0.001),预测截断值为20.95 mg/dL,灵敏度为77.4%,特异度为51.1%。
Lp(a)水平与AIS患者EVT术后不良预后之间的机制并不完全了解,然而,其特殊的促炎、促动脉粥样硬化、促血栓形成的属性均会导致AIS不良预后的发生。其一,炎症几乎参与了AIS患者从发病至预后的整个过程,对患者功能结局也产生了不良影响。近来一项研究表明炎症细胞与前循环大血管闭塞性AIS患者EVT术后3个月的临床结局存在相关性,提示较高的中性粒细胞与淋巴细胞比率(NLR)是预后不良的独立危险因素[15]。本研究结果发现Lp(a)也可作为EVT患者不良预后的预测因子,由于Lp(a)容易受氧化修饰,进而会形成促进炎症发生的氧化磷脂(OxPLs),其可诱导炎症细胞因子和趋化因子的分泌和释放,通过激活单核细胞来促进炎症反应。Lp(a)颗粒含有大约80%的OxPLs成分,会在一定程度上增大动脉壁的炎症活性[16],故由此推测Lp(a)对EVT患者不良预后的影响与其促炎特性密不可分。其二,由动脉粥样硬化导致的卒中,行血管内治疗手术时较为复杂,颅内动脉粥样硬化会在一定程度上影响取栓设备到达责任病灶的通路,导丝和支架系统需克服动脉粥样硬化型血管的困难,导致手术时间延长、取栓次数增多,存在较高的风险。由于Lp(a)与LDL颗粒结构相似,但相比LDL,Lp(a)对内皮细胞和血管壁表面的蛋白聚糖和纤维蛋白有更大的亲和力,并且Lp(a)含有LDL和Apo(a)的所有致动脉粥样硬化成分,更容易引起泡沫细胞的产生,具有更强的促动脉粥样硬化的作用[17]。由此,我们推测Lp(a)的促动脉粥样硬化作用进一步促使了AIS取栓患者不良预后的发生。其三,由于Apo(a)与纤溶酶原结构具有高度一致性,可与其争夺内皮细胞上的纤溶酶原受体产生抗纤溶作用,从而促进血栓形成。Lp(a)还会通过促进组织因子的表达影响外源性凝血途径,组织因子是一种通过动脉粥样硬化斑块内的巨噬细胞和平滑肌细胞过表达的细胞表面糖蛋白,组织损伤导致的内皮剥落使其暴露于血流中,促使血栓形成和内膜纤维蛋白沉积[18]。据最近的一项研究报道,血栓形成有助于确定血管内治疗术后3个月前循环卒中患者预后不良的风险,特别是≥3d的血栓[19],该研究支持了我们所得出的结论,然而,还需要进一步大规模的研究来评估血栓性质和成分与EVT患者不良预后之间的机制。综上,该研究认为Lp(a)所具有的促炎、促动脉粥样硬化、促血栓形成的特性对于EVT患者不良预后产生了重要影响。同时还发现患者年龄较大、入院NIHSS评分较高也是EVT术后3个月时不良预后的危险因素,与既往研究一致[20],以上结论可为临床诊治提供一定的参考依据。
本研究发现Lp(a)与前循环大动脉闭塞急性缺血性卒中EVT患者临床结局具有相关性,并且对EVT术后3个月时的不良预后有一定的预测价值。本文作为探索性的研究,仍存在很多不足之处,首先样本量较小,可能会影响结果准确性,同时由于Lp(a)具有高度遗传性,在种族甚至个体间均存在差异,本文研究对象大多数来自内蒙古西部,受民族和地区的影响,结果可能缺乏代表性,未来需要多中心多民族的大样本联合研究进一步验证Lp(a)与EVT患者临床结局的关系。

