远隔缺血预处理分离液对人肾小管上皮细胞缺氧性损伤的保护作用*
戴文俊,裴汉军
(内蒙古科技大学包头医学院,内蒙古包头 014040)
急性肾损伤(acute kidney in jury,AKI)表现为短时间内肾功能迅速下降,通常以血肌酐绝对水平上升0.5 mg/dL,或超过基线值的1.5倍为标准,是临床上发病率和死亡率都很高的常见危重症,且随着病程的进展,可逐渐发展为慢性肾脏病[1-2],严重影响患者愈后。远隔缺血预处理(remote ischemic preconditioning,RIPC)是指通过多次规律性、短暂性地对远离靶器官的肢体远端进行缺血处理,由此来使靶器官更加耐受缺血再灌注等所带来的损伤,从而发挥多种器官保护作用[3]。因其操作方便、对患者伤害小而在临床中广泛应用。但是,有关RIPC防治AKI的机制目前尚未完全阐明。
目前认为,AKI发病机制复杂,涉及多种病理过程,如活性氧(reactive oxygen species,ROS)的释放、趋化分子和多种细胞因子参与的炎症反应等[4]。这些病理过程诱导肾小管上皮细胞等出现损伤、肿胀和功能障碍,进一步加重了细胞的缺血缺氧,最终出现细胞凋亡和死亡,导致AKI的发生。如今,AKI的发病率居高不下,心脏介入术后AKI发病率可高达20%,而在危重症病房中,其发生率更是高达50%,现AKI已成为影响人类健康的重大威胁。如何避免急性肾损伤的发生和减少其损伤程度,一直是众人研究的焦点。近年来有研究发现,AKI的大多数病理过程与线粒体功能障碍相关[2],因此线粒体自噬作为能够选择性清除受损的线粒体从而保护健康线粒体功能的特殊类型自噬[5],可能成为新的治疗思路。本研究通过体外细胞实验来探讨RIPC对AKI的保护作用及对自噬的调节作用。
1 材料与方法
1.1材料 (1)细胞:人肾小管上皮细胞(HK-2)(CL-0109)。(2)试剂:HK-2细胞专用培养基(CM-0109);0.25%胰蛋白酶-EDTA(美国BiologicalIndustries公司,2147381);BCA蛋白定量试剂盒(上海赛默飞世尔科技有限公司,23225);LC3A/B蛋白抗体(上海优宁维生物科技股份有限公司,12741S)、Beclin1蛋白抗体(美国Signalway Antibody公司,30900-1);Tizol(中国碧云天生物科技有限公司,R0016)。(3)仪器:电泳仪,美国BIO-RAD公司,PowerPac Basic 164-5050。
1.2实验方法
1.2.1细胞培养 将HK-2细胞置于HK-2专用培养基(含10% FBS、青霉素和链霉素)中,在恒温饱和湿度培养箱中培养,培养箱条件设置为37 ℃,5%CO2和95%空气。
1.2.2RIPC鼠血浆分离液的提取及保存 采用腹腔注射戊巴比妥钠(10 mg/kg)的方法给予大鼠麻醉,待麻醉成功后,使用充气袖带对大鼠后肢根部进行阻断血流。对充气袖带进行持续充气,至大鼠后肢的皮肤出现发绀,表示股动脉已经被阻断,阻断5 min后释放袖带压力,复灌注5 min后,再次重复以上动作,如此4个循环,1 h后经心脏取血,置入真空肝素化采血管中,使用4 ℃离心机1 000 g离心20 min提取血浆,分装入肝素化EP管中-80 ℃冻存,使用时使用4 ℃离心机4 500 g离心10 min,取上清液按1∶30培养基稀释。
1.2.3模型建立 采用物理性H/R模式建立细胞损伤模型。将长势良好的模型组细胞置于三气培养箱中培养15 h,培养箱条件设置为37 ℃,1%O2、94%N2、5%CO2,随后打开箱门,将培养箱条件设置为37 ℃,5%CO2和95%空气,关闭箱门复氧培养 6 h。
1.2.4实验分组 实验分为时间对照组、H/R组、RIPC处理组、自噬干预组。(1)时间对照组(TimeControl, TC):取对数生长期HK-2细胞,用HK-2专用培养基(含10% FBS、青霉素和链霉素),在恒温饱和湿度培养箱中培养21 h,培养箱条件设置为37 ℃,5%CO2和95%空气;(2)缺氧/复氧组 (Hypoxia/Reoxygenation, H/R): 取对数生长期HK-2细胞,使用HK-2专用培养基,在三气培养箱中恒温饱和湿度培养15 h,培养箱条件设置为37 ℃,1%O2、94%N2、5%CO2,随后打开箱门,将培养箱条件设置为37 ℃,5%CO2和95%空气,关闭箱门复氧培养6 h;(3)远隔缺血预处理组(remote ischemic preconditioning, RIPC):取对数生长期HK-2细胞,将RIPC分离液稀释后预处理HK-2细胞,2 h后余同H/R组;(4)自噬干预组(RIPC+3MA):取对数生长期HK-2细胞,在RIPC处理的基础上,加入3MA(工作浓度,10 mM)培养HK-2细胞,2 h后余同H/R组。
1.2.5用光学显微镜观察各组HK-2细胞 将造模成功的各组细胞置于倒置显微镜下,使用40倍镜头观察细胞,以了解各组HK-2细胞造模后的状态。
1.2.6Western blot法检测Beclin1、LC3Ⅱ/Ⅰ蛋白表达水平 取HK-2细胞,提取线粒体蛋白,应用BCA 法测蛋白浓度,采用Western blot检测HK-2细胞线粒体中自噬特异性蛋白Beclin1和 LC3Ⅱ/Ⅰ的表达水平。
1.2.7Real-time PCR分析各组细胞LC3、Beclin1的mRNA表达 取HK-2细胞,提取总RNA,逆转录生成cDNA,设计引物并由上海生物工程公司合成(见表1),以GAPDH为参照基因,采用Real-time PCR法分析各组细胞LC3、Beclin1的mRNA表达水平。

表1 引物成分表
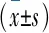
2 结果
2.1RIPC对HK-2细胞H/R损伤的保护作用 使用光学显微镜对4组细胞进行形态学观察。对照组HK-2细胞形态正常,呈“鹅卵石”样排列,细胞膜完整,细胞核清晰;相较于对照组细胞,H/R组HK-2细胞肿胀变性,边界不清,细胞核模糊,死亡细胞明显升高;相较于H/R组细胞,RIPC组HK-2细胞形态相对正常,细胞膜完整,细胞核清晰,死亡细胞较少;相较于RIPC组细胞,自噬干预组HK-2细胞肿胀变性明显,细胞核模糊,死亡细胞增多。实验结果表明,RIPC分离液对HK-2细胞H/R损伤具有保护作用,而3MA可以阻断这种保护作用。见图1。
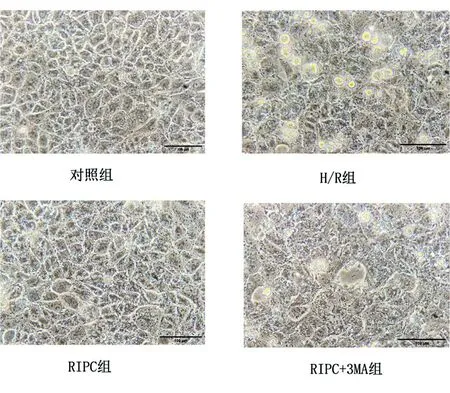
图1 RIPC对HK-2细胞H/R损伤的保护作用
2.2RIPC对HK-2细胞H/R损伤保护的作用机制
2.2.1Western blot法检测Beclin1、LC3Ⅱ/Ⅰ蛋白表达水平 为进一步分析RIPC分离液对HK-2细胞的保护作用机制,应用Western blot对HK-2细胞线粒体自噬特异性蛋白Beclin1及LC3Ⅱ/Ⅰ的表达进行检测,以GAPDH为内参。结果显示:RIPC组对比H/R组,RIPC组细胞线粒体中的LC3Ⅱ/Ⅰ及Beclin1表达量明显更高(P<0.01,P<0.001);RIPC+3MA组对比RIPC组,RIPC+3MA组细胞线粒体中的LC3Ⅱ/Ⅰ及Beclin1蛋白表达量明显降低(P<0.01,P<0.001)。表明RIRC分离液可通过上调HK-2细胞H/R损伤中的线粒体自噬,从而发挥保护作用。见图2。
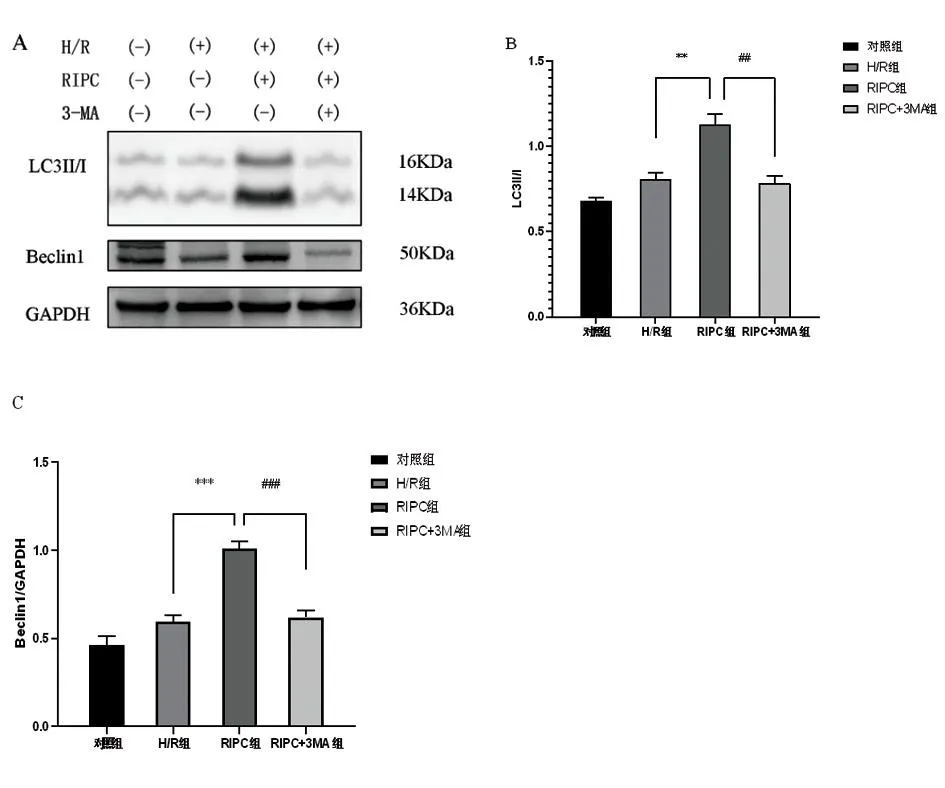
图2 RIPC对LC3Ⅱ/Ⅰ及Beclin1表达水平的影响
2.2.2Real-time PCR法检测Beclin1、LC3 mRNA表达水平 应用Real-time PCR技术对各组HK-2细胞LC3及Beclin1的mRNA表达进行检测。结果显示,RIPC组对比H/R组,RIPC组细胞中的LC3及Beclin1的mRNA表达量明显升高(P<0.05);RIPC+3MA组对比RIPC组,RIPC+3MA组细胞中的LC3及Beclin1的mRNA表达量明显降低(P<0.05)。见图3。
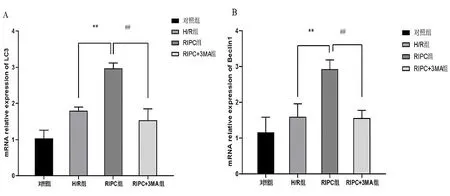
图3 RIPC分离液对LC3及Beclin1 mRNA表达水平的影响
3 讨论
肾脏是人体血供极其丰富的器官,其特点为高通血量和高耗氧量,对缺血/再灌注十分敏感。有研究显示,急性肾损伤发病率和死亡率都比较高的主要原因就是肾缺血/再灌注损伤[6]。远隔缺血预处理(RIPC)可通过对远离靶器官的肢体远端多次短暂性、规律性的缺血处理,使靶器官(如心脏、脑、肾脏、肺脏、肝脏等)对缺血/再灌注等损伤的耐受能力得到有效的增强,从而保护多种器官免受缺血/再灌注损伤[7-8]。Rossaint等[9]发现RIPC可增加患者尿中HMGB1(高迁移率族蛋白B1),从而降低心脏术后急性肾损伤的风险(P<0.01)。Guo等[10]对119例接受介入治疗的患者随机分组,发现RIPC组显著降低了造影剂给药后12 h的NGAL(P=0.024)和KIM-1(P=0.007)水平,表明RIPC治疗减少了造影剂肾病(CIN)的发生。
本实验使用人肾小管上皮细胞进行细胞水平的研究,旨在通过对HK-2细胞进行H/R损伤造模,来模拟人体内肾脏缺血/再灌注损伤,使用RIPC分离液预处理细胞,来模拟人体RIPC对肾脏的作用。根据前期预实验的实验结果,发现HK-2细胞的H/R损伤是一种动态损伤,以缺氧15 h复氧6 h损伤最为严重,所以模型选取缺氧15 h复氧6 h为检测时间点。造模成功后,镜下显示H/R组细胞相较于对照组细胞损伤严重,细胞肿胀变性、死亡较多;而在H/R前给予RIPC分离液预处理HK-2细胞,镜下可见细胞受损较轻微,细胞形态大致正常。说明RIPC分离液对HK-2细胞H/R损伤具有保护作用。
目前,对于RIPC肾保护的内在机制尚不明确。以往的研究已经证明线粒体损伤和功能障碍对AKI的发展和肾脏修复异常至关重要。Funk等人[11]通过研究发现,在AKI血清肌酐升高之前,肾小管细胞的线粒体功能便已经发生损伤。Brooks等人[12]使用消耗ATP的方法对体外培养的人肾小管细胞诱导损伤和使用缺血的方式诱导小鼠发生AKI,通过研究发现,在肾小管细胞发生凋亡之前,线粒体便已经出现损伤。另外,还有多项研究表明线粒体自噬对肾功能有保护作用[13-15]。由此可见线粒体自噬是有效预防和治疗AKI的策略。
为验证RIPC分离液通过上调线粒体自噬水平来减少HK-2细胞H/R后线粒体损伤,实验提取HK-2细胞中的线粒体蛋白,采用Western blot法检测线粒体蛋白中自噬特异性蛋白LC3和Beclin1表达水平,同时采用Real-timePCR技术检测LC3和Beclin1的mRNA表达水平,以此达到基因和蛋白表达的双重验证。LC3和Beclin1是检测自噬最常用的两种蛋白,LC3有两种形式, LC3Ⅰ和LC3Ⅱ,当自噬发生时, LCⅠ转化成为LC3Ⅱ,所以LC3Ⅱ/Ⅰ水平是检测自噬水平的主要标志。Western blot结果显示RIPC分离液预处理HK-2细胞,线粒体蛋白LC3Ⅱ/Ⅰ以及Beclin1表达水平均增强,Real-time PCR结果也支持这一趋势,提示RIPC可以上调线粒体自噬水平;为了进一步确定线粒体自噬在RIPC肾保护中的重要性,在RIPC预处理HK-2细胞时,同时给予自噬抑制剂3MA,重复以上实验,结果显示,HK-2细胞LC3Ⅱ/Ⅰ以及Beclin1表达水平均明显降低,Real-time PCR结果也表现出了同样的趋势,表明线粒体自噬水平下降。由此可以得出结论,RIPC分离液对HK-2细胞H/R后损伤的保护作用,是通过线粒体自噬来实现的,RIPC分离液可上调线粒体自噬,如果抑制线粒体自噬(3MA处理细胞)则可抑制RIPC的保护作用。
综上,线粒体自噬作为清除和修复损伤线粒体的机制,在急性肾损伤时被激活,发挥肾保护作用。因此,通过RIPC增加线粒体自噬功能是预防和治疗AKI的一个有希望的治疗策略。进一步研究线粒体自噬的内在调控机制,将会成为急性肾损伤治疗的新靶点和新希望。

