多发性骨髓瘤合并轻链型淀粉样变性患者临床分析
陈蕾妃 钱申贤
多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞病,好发于老年人,是浆细胞病中最常见的类型。而淀粉样变性是也是浆细胞病的一种,是临床上相对少见的一类疾病,其中以轻链型(light chain amyloidosis,AL)淀粉样变性最常见[1],占淀粉样变性的80%以上。目前,MM 合并AL 淀粉样变性的发病机制尚不清楚,约10%的MM 患者在诊断时会同时存在AL 淀粉样变性,约10%~15%的MM 患者可能会发展为AL 淀粉样变性[2]。涉及淀粉样蛋白的沉积与MM 患者预后关系的研究报道较少[3-6]。本研究分析MM 合并AL 淀粉样变性患者的临床特征、疗效及预后,现报道如下。
1 资料与方法
1.1 临床资料 选取2017 年1 月至2022 年1 月杭州市第一人民医院收治的MM 患者124 例,其中MM 合并AL 淀粉样变性患者31 例(MM 合并AL 组),单纯MM 患者93 例(MM 组)。患者均符合国际骨髓瘤工作组(IMWG)对MM 的诊断标准,且根据《中国多发性骨髓瘤诊治指南(2017 年修订)》中DS 分期标准、ISS国际分期标准对所有MM 患者进行分期[7]。其中MM合并AL 淀粉样变性患者经过1~3 个部位的组织活检,病理学检查结果符合淀粉样变性,且经免疫组化确定为轻链型[8]。两组患者均予以硼替佐米为主的化疗方案诱导治疗。本研究经医院医学伦理委员会批准。
1.2 方法 收集两组患者一般资料、实验室检查结果。一般资料包括患者初次入院就诊时的一般临床资料(性别、年龄)、游离轻链类型、分期。实验室检查结果包括治疗前血常规(WBC、PLT、Hb)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)、白蛋白、血肌酐、血钙、β2 微球蛋白、B 型利钠肽(BNP)、24 h 尿蛋白等。
1.3 观察指标(1)疗效:参照IMWG疗效评价标准[7],分为完全缓解(CR)、较好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)等。总有效率(ORR)为获得的最好疗效在PR 及以上患者所占比例。(2)预后:无进展生存期(PFS)指从开始治疗直至复发、进展或发生任何原因的死亡时间或直至随访结束。总生存期(OS)是指从确诊到死亡的时间或直至随访结束。
1.4 统计学方法 采用SPSS 25.0 统计软件。符合正态分布计量资料以()表示,组间比较用t检验。偏态分布计量资料以M(Q1,Q3)表示,两组比较采用Wilcoxon 秩和检验。计数资料以n(%)表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。采用Kaplan-Meier 法绘制生存曲线,两组患者生存曲线比较采用Log-rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 见表1。
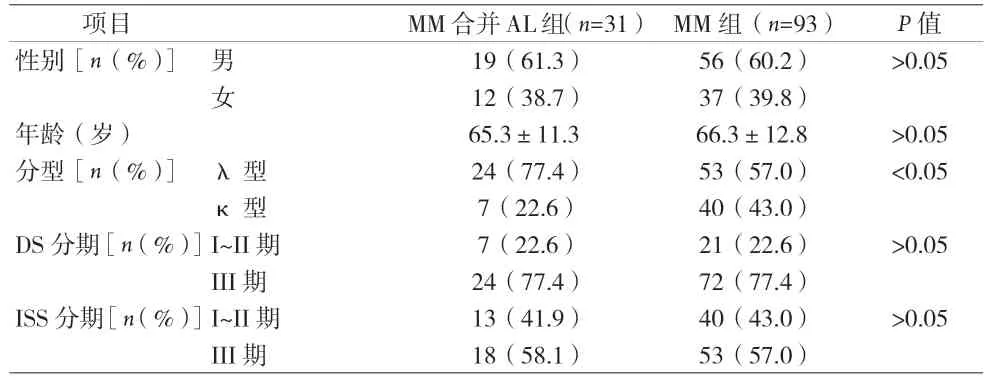
表1 两组患者一般资料比较
2.2 两组患者实验室检查结果比较 见表2。
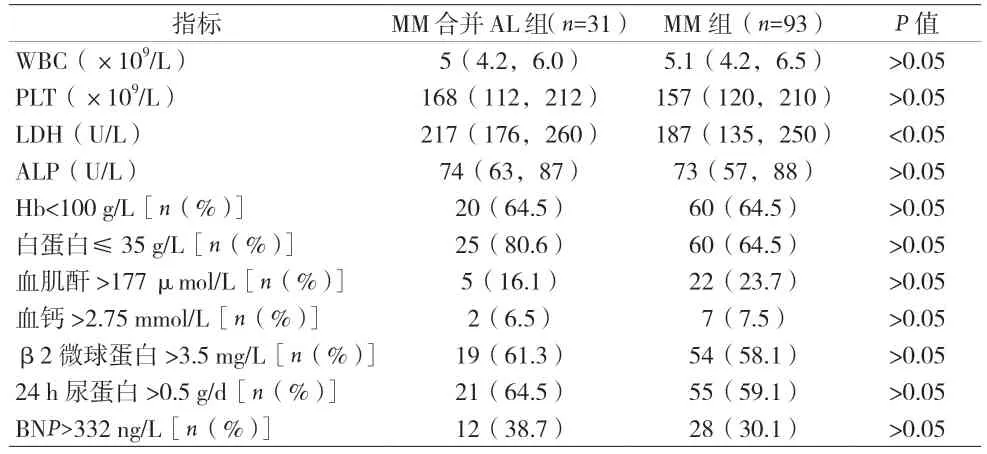
表2 两组患者实验室检查结果比较
2.3 两组患者疗效比较 在诱导治疗结束后124 例患者中,MM 合并AL 组3 例患者死亡,疗程未达到;MM组13 例患者死亡,疗程未达到。可评估疗效的患者共80 例,其中MM 合并AL 组28 例,MM 组80 例。MM合并AL 组ORR 为71.4%,MM 组患者ORR 为85.0%。两组患者ORR 比较差异无统计学意义(P<0.05)。MM合并AL 组CR 患者比例、获得VGPR 及以上患者比例均低于MM 组,差异有统计学意义(P>0.05)。见表3。
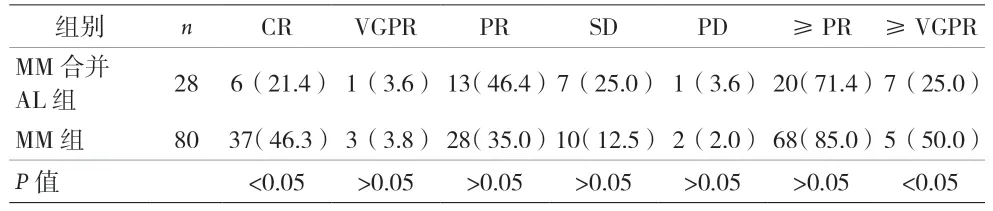
表3 两组患者疗效比较[n(%)]
2.4 两组患者预后比较 124 例患者全部随访至2022年1 月31 日,无失访病例;总人群中位随访时间为21(10,38)个月,其中MM 合并AL 组随访15(3,24)个月,MM 组随访21(11,48)个月。两组患者生存曲线见图1。MM 合并AL 组中位PFS 与中位OS 分别为23个月和31 个月,MM 组分别为31 个月和56 个月。两组患者PFS 差异无统计学意义(P>0.05),MM 合并AL组患者OS 短于MM 组(P<0.05)。MM 合并AL 组ISS III 期患者18 例,MM 组ISS III 期患者53 例。在随访时间内,MM 合并AL 组ISS III 期患者患者中位PFS 22个月,中位OS 39 个月;MM 组患者ISS III 期患者中位PFS 23 个月,中位OS 48 个月。两者生存曲线见图2。MM 合并AL 组ISS III 期患者与MM 组患者ISS III 期患者PFS、OS 比较差异均无统计学意义(P>0.05)。MM合并AL 组DS 分期III 期患者24 例,MM 组DS 分期III期患者72 例。在随访时间内,MM 合并AL 组DS 分期III 期患者中位PFS 22 个月,中位OS 31 个月;MM 组DS 分期III 期患者中位PFS 23 个月,中位OS 49 个月。两者生存曲线见图3。MM 合并AL 组DS III 期患者与MM 组患者DS III 期患者PFS、OS 比较差异均无统计学意义(P>0.05)。
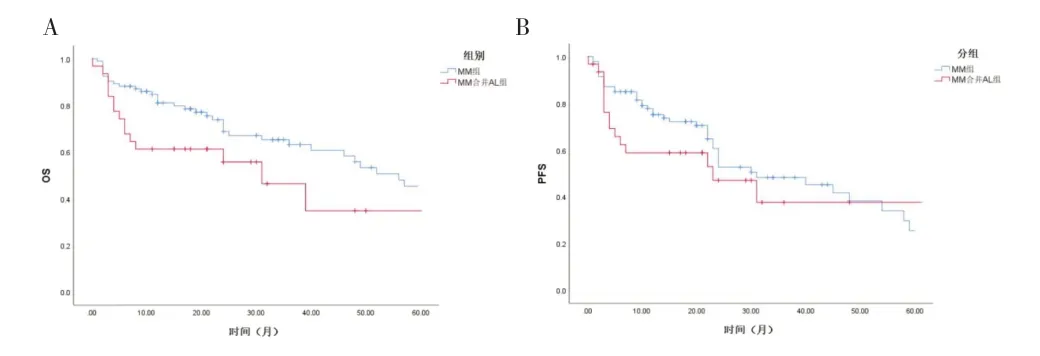
图1 MM合并AL组与MM组患者生存曲线比较
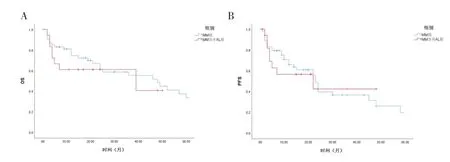
图2 两组ISS III期患者生存曲线比较
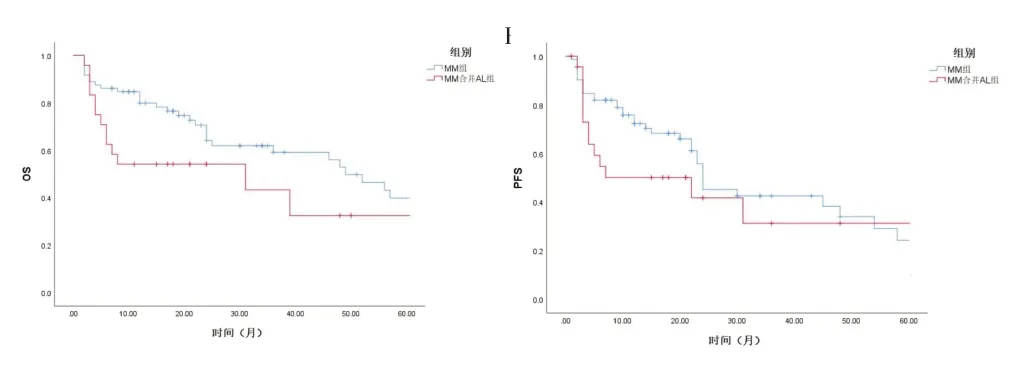
图3 两组DS分期III期患者生存曲线比较
2.5 MM 合并AL 组心脏淀粉样变与无心脏淀粉样变患者预后比较 根据超声心动图室间隔厚度>12 mm(无其他病因)且心脏超声检查证实存在淀粉样变性,或BNP 升高>332 ng/L(无肾功能不全或心房颤动情况),MM 合并AL 组心脏淀粉样变15 例,无心脏淀粉样变16例。两者生存曲线见图4。在随访时间内,MM 合并AL组中心脏淀粉样变患者中位OS 为7 个月,无心脏淀粉样变患者中位OS 为21 个月,两组患者OS 比较差异有统计学意义(P<0.05),而PFS 无统计学意义(P>0.05)。

图4 MM合并AL组心脏淀粉样变与无心脏淀粉样变患者生存曲线比较
3 讨论
在MM 患者的临床病理检查中,有15%的患者在骨髓和骨髓活检中发现淀粉样蛋白沉积,12%~15%的患者在其疾病过程中出现明显的临床淀粉样变,30%的患者在皮下脂肪垫抽吸、骨髓活检和其他重要器官(如心脏、肝脏和肾脏)活检中发现亚临床淀粉样沉积[5-6]。
有研究指出,在原发性系统性淀粉样变性患者中,λ 轻链受累患者约占80%,明显多于κ 轻链受累患者[9]。在本研究中MM 合并AL 组中λ 轻链受累患者比例较MM 组患者高,即淀粉样蛋白的沉积与患者轻链类型存在相关性。国内一项回顾性研究指出MM 合并AL淀粉样变性患者λ 轻链受累多于κ 轻链受累患者[10]。PETRUZZIELLO 等[6]临床研究结果显示,有无淀粉样变性与患者在诊断时的轻链类型无相关性。在不同轻链受累对患者的预后影响方面,VAN RHEE 等[11]一项纳入169 例复发难治性MM 患者的回顾性研究指出λ 轻链型患者的PFS 和OS 较κ 型短,这可能与λ 轻链型患者中遗传细胞学异常更多有关。
本资料结果显示,两组患者除LDH 外,在WBC、PLT、ALP、Hb、白蛋白、血肌酐、血钙、β2 微球蛋白、24 h 尿蛋白、BNP 水平等比较差异均无统计学意义。淀粉样蛋白的沉积并未让MM 患者的临床表现更差。有文献指出MM 合并淀粉样变的患者与MM 患者相比可表现出免疫球蛋白IgG含量降低及LDH和LDH1活性增高[12],这或许可以成为辅助鉴别的指标。而另一篇临床回顾性研究报道指出合并有淀粉样蛋白沉积的患者可有更多的蛋白尿,更加严重的贫血,更高的血钙、ALP 和LDH 水平,血清白蛋白含量也会更低[5]。目前对MM合并AL淀粉样变性的治疗,主要是基于MM的治疗方案[13-14]。有研究表明,硼替佐米作为单药或与地塞米松联合应用,均可在初发或复发的AL 患者中产生较高的应答率[15-16]。MIKHAEL 等[17]一项研究表明,使用硼替佐米、环磷酰胺和地塞米松的联合化疗方案治疗AL 淀粉样变性的患者,其治疗有效率可>90%,其中60%达到VGPR 及以上。但由于AL 淀粉样变性患者的器官功能受损,化疗应以低剂量开始,并进行严密的监测,以减少化疗药物的毒性作用。在本研究中,所有患者均予以硼替佐米为主的化疗方案诱导治疗,两组患者ORR 差异无统计学意义,但获得VGPR 及以上以及获得CR 的患者MM 合并AL 组较MM 组少,这可能与合并AL 淀粉样变性患者早期器官功能受累,导致治疗反应变差有关,但本文中评估疗效时将死亡患者排除在外,存在高估MM 组疗效的可能。
SIRAGUSA 等[3]指出AL 淀粉样变性可能与MM 的病死率和发病率有关,且其早期发现可能会改变MM 患者的治疗。ABRAHAM 等[4]同样证明,AL 淀粉样变性与MM 并存的患者预后较差,中位生存期为1.1 年,而无AL 淀粉样变性患者为2.9 年。一项对201 例新发MM患者进行刚果红染色的脐周脂肪垫活检的研究发现,68例患者患有AL,且MM 合并淀粉样变性是一种预后较差的疾病,表现为存在B 症状,LDH 和血钙较高,化疗反应较差,是一种独立的高危预后因素,且该研究建议所有MM 患者进行脐周脂肪垫组织的常规活检,因为亚临床淀粉样变性的存在也会导致不良预后[5]。但另一项回顾性临床研究显示,对166 例患者中位随访32个月后并未发现有无淀粉样蛋白沉积对患者生存存在差异[6]。本研究发现MM 合并AL 组患者在OS 较MM组患者短,MM 合并AL 组中心脏累及的患者预后更差,这可能与合并AL 淀粉样变性的患者体内轻链沉积导致脏器功能障碍有关。
虽然淀粉样变性在MM 中发病率不高,但轻链沉积可使这部分患者出现脏器功能障碍,高LDH 水平等,从而导致较差的治疗反应以及更短的生存时间,但一些实验室检查结果,如轻链类型、BNP、24 h 尿蛋白、心脏超声、脂肪垫活检、骨髓活检刚果红染色等,可帮助临床医师早期识别这类疾病,并在治疗过程中对化疗药物的剂量有更准确的把控,从而减轻甚至逆转相关器官的损害,改善MM 合并AL 患者的预后。

