溶胶⁃凝胶法合成钛酸锌锂负极材料
王立福,卢汇嘉,许航,包鹏伟,万一行,荀瑞,张重学,王利娟
溶胶⁃凝胶法合成钛酸锌锂负极材料
王立福,卢汇嘉,许航,包鹏伟,万一行,荀瑞,张重学,王利娟
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
以溶胶⁃凝胶法制备锂离子电池Li2ZnTi3O8(LZTO)负极材料,考察退火温度和退火时间对LZTO电化学性能的影响,得到了最佳工艺条件:退火温度为700 ℃,退火时间为3 h。在最佳工艺条件下制备的LZTO中添加络合剂柠檬酸进行了改性。结果表明,当金属离子与柠檬酸的物质的量比为2.00∶1.50时,制备的样品LZTO⁃2/1.50颗粒小、分散均匀,表现出良好的电化学性能;当电流密度为0.5 A/g时,恒流充放电300次后放电比容量为203.6 mA·h/g。
钛酸锌锂; 溶胶⁃凝胶法; 柠檬酸; 电化学性能; 负极材料
众所周知,锂离子电池作为可再充电电池在当今社会中扮演着不可缺少的角色。为了满足社会的需要,新的电极材料不断被研究或者研发出来。近年来,针对传统石墨碳负极材料的安全问题[1⁃3],钛酸锂(Li4Ti5O12)负极的低容量和高制作成本问题[4⁃6]以及硅、锡基等负极材料的体积膨胀问题[7⁃8],研究者开发出一种新型负极材料——尖晶石型的钛酸锌锂(Li2ZnTi3O8,LZTO)。LZTO是一种结构稳定、理论比容量高、脱嵌锂电位较高和循环寿命长的负极材料[9⁃10],相比商业化的Li4Ti5O12负极材料具有更优异的电化学性能和更低的制备成本[10]。研究表明,溶胶⁃凝胶法是制备电极材料的一种良好方法[11⁃13]。T.LIU等[14]采用熔融盐法、溶胶⁃凝胶法和固相法三种方法制备出LZTO负极材料。结果表明,溶胶⁃凝胶法制备的材料晶型更完善、粒径更均匀且堆积孔更多,表现出更优异的电化学性能。Z.F.LI等[15]采用溶胶⁃凝胶法制备Li2MoO4改性的LZTO,其具有良好的循环性能,在电流密度为1.0 A/g的条件下循环500圈后仍能保持151.0 mA·h/g的放电比容量。H.Q.TANG等[16]通过碳和金属Cu包覆的方法改善了LZTO的导电性。结果表明,LZTO的电化学性能显著提升,在电流密度为1.0、2.0、3.0 A/g下的条件下循环1 000圈后分别保持124.4、90.8、79.1 (mA·h)/g的放电比容量。本文以钛酸四丁酯、二水合醋酸锂和二水合乙酸锌为反应原料,柠檬酸为络合剂,通过溶胶⁃凝胶法制备LZTO,并考察了退火温度、退火时间和柠檬酸的物质的量对LZTO电化学性能的影响,以期为LZTO的工业化生产提供参考。
1 实验部分
1.1 实验试剂及仪器
试剂:钛酸四丁酯(C16H36O4Ti)、柠檬酸(C6H8O7·H2O)、冰醋酸(C2H4O2)、二水合醋酸锂(C2H3O2Li·2H2O),分析纯,上海阿拉丁生化科技股份有限公司;无水乙醇(C2H6O)、二水合乙酸锌(C4H6O4Zn·2H2O),分析纯,天津市恒兴化学试剂制造有限公司;乙炔黑、聚偏氟乙烯(PVDF)、N⁃甲基吡咯烷酮(NMP),分析纯,国药集团化学试剂有限公司;电解液,电池级,昆仑新能源材料股份有限公司。
仪器:D8 Advance X⁃射线多晶粉末衍射仪,德国布鲁克公司;SU8010场发射电子扫描显微镜,日本日立公司;CT⁃4008高性能电池检测系统,深圳市新威尔电子有限公司;CHI660E辰华电化学工作站,上海华辰仪器有限公司。
1.2 实验步骤
活性材料的制备:称取3.0 g C16H36O4Ti于烧杯中,在磁力搅拌的条件下滴入100 mL溶剂(无水乙醇/冰醋酸=9∶1),搅拌30 min使C16H36O4Ti完全溶解;称取0.6 g C2H3O2Li·2H2O粉末于上述钛酸四丁酯溶液中,待粉末溶解后继续搅拌30 min;加入0.65 g C4H6O4Zn·2H2O粉末,搅拌3 h使原料混合均匀。将混合溶液在65 ℃的水浴中搅拌至生成淡黄色的凝胶,然后在80 ℃的温度下干燥并研磨,得到粉末状前驱体。最后,在马弗炉中分别以650、700、750 ℃的温度退火3 h,以及在700 ℃的温度下分别退火1、5 h。
预先称取三份质量不同的柠檬酸溶于装有乙醇的烧杯中。重复上述制备过程,待三种金属源添加完毕后,将柠檬酸的醇溶液缓慢地滴加在上述溶液中,其余操作不变。然后,将三份前驱体在700 ℃的温度下退火3 h,最终得到金属离子/柠檬酸分别为2.00∶1.25、2.00∶1.50和2.00∶1.75的LZTO负极材料,并依次命名为LZTO⁃2/1.25、LZTO⁃2/1.50和LZTO⁃2/1.75。
极片的制备:将活性物质LZTO、乙炔黑和聚偏氟乙烯(PVDF)按照质量比为85∶10∶5溶解在N⁃甲基吡咯烷酮(NMP)溶剂中,并使其混合成浆料。然后,用涂布机将浆料涂覆在铜箔上,在120 ℃的真空干燥箱中干燥,干燥后切片并称重。
电池组装:将极片转移至无水无氧高纯氩气的手套箱中进行电池组装,使用CR2016型纽扣电池壳为外包装,金属锂为对电极,浓度为1 mol/L的LiPF6溶液(溶剂用碳酸乙烯酯(EC)和碳酸二乙酯(DMC)按照体积为1∶1混合)为电解液。
电化学测试:充放电和循环伏安(CV)测试范围为0.02~3.00 V。在频率为10 mHz~100 kHz、交流电压振幅为5 mV的条件下,测试电化学阻抗(EIS)。
近三年来的变化显示,同方知网销售模式中一直是网站包库占最大比重,其次是镜像网站,流量计费因针对的是个人及小微型企业占比较小。
2 结果与讨论
2.1 退火温度的考察
对不同退火温度下制备的LZTO负极材料进行了充放电循环测试,结果见图1。
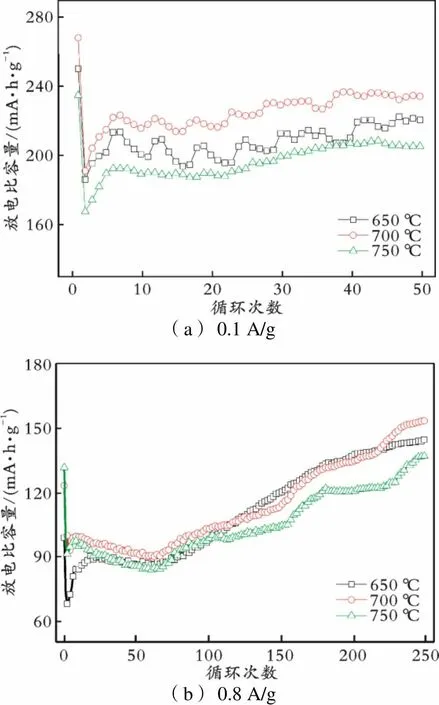
(a) 0.1 A/g (b) 0.8 A/g
从图1(a)可以看出,当电流密度为0.1 A/g时,在650、700、750 ℃温度下退火的三个样品初始放电比容量分别为249.4、267.2、234.0 mA·h/g,循环50圈后分别为219.7、233.4、204.6 mA·h/g。在700 ℃的温度下退火制备的样品始终保持最高的放电比容量,说明700 ℃退火的样品具有更好的电化学性能。因此,最适宜的退火温度为700 ℃。这是因为:如果温度过低,导致晶体结晶不完整,而缺陷过多不利于Li+的脱嵌;过高的温度不仅会使材料颗粒尺寸过大,而且材料颗粒易团聚,这些都不利于Li+的脱嵌[17]。为进一步确定上述结论,将电流密度增加至0.8 A/g,对三个样品进行了充放电测试(见图1(b))。从图1(b)可以看出,三条曲线的变化规律与图1(a)一致,700 ℃退火制备的样品具有更高的放电比容量和更好的循环稳定性,且恒流充放电250次后放电比容量可达152.9 mA·h/g。
图2为700 ℃退火样品在0.5 A/g下的循环性能及库伦效率。从图2可以看出,该电极材料的首次充/放电比容量分别为90.3、172.6 mA·h/g,库伦效率仅为52.3%。这是因为:在首次循环过程中,电极与电解液之间发生副反应,消耗了部分Li+,而这部分Li+产生的容量是不可逆的。随着电化学反应的进行,库伦效率逐渐提高至100.0%。
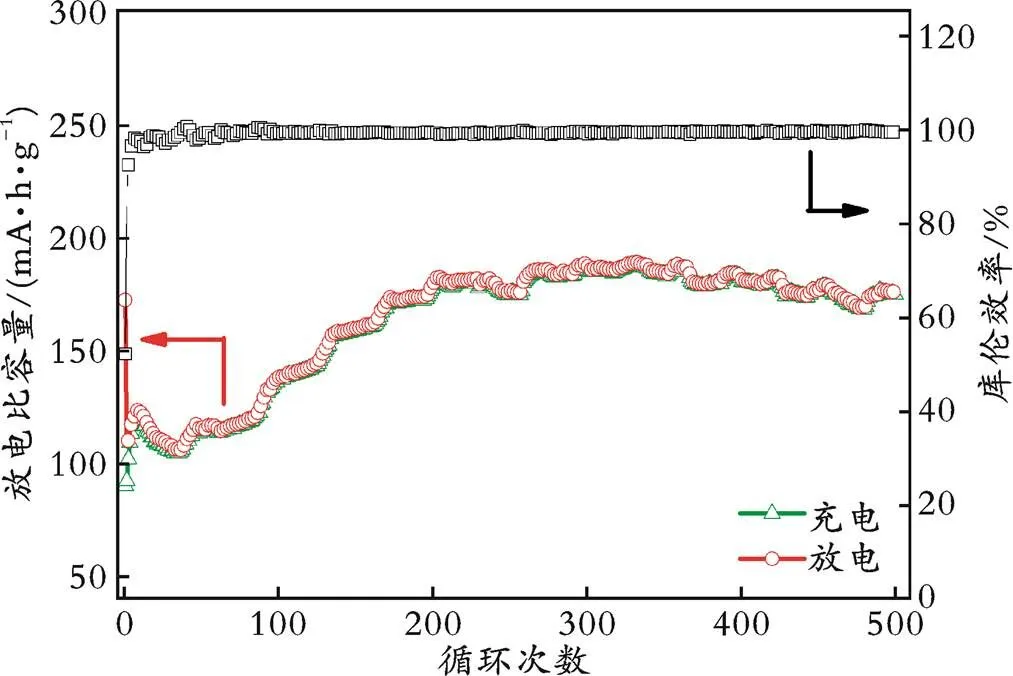
图2 700 ℃退火样品在0.5 A/g下的循环性能及库伦效率
在扫描速度为0.5 mV/s的条件下,对三个退火温度下制备的样品在电势为0.02~3.00 V的范围内进行了CV测试,结果见图3。从图3可以看出,三个样品的CV曲线形状相似,说明三个退火温度下制备的材料发生的电化学反应是相同的,均在0.5 V左右存在一个还原峰。根据W.J.H.BORGHOLS等[18]和H.GE等[19]的报道,这是由于Ti4+的多次还原所致。从图3还可以看出,所有曲线在1.10~1.70 V都存在一对代表Ti4+/Ti3+电对的氧化还原峰,700 ℃退火样品的两峰位置更加靠近,相应的峰位电势差更小,即代表该材料在充放电过程中极化更小,电化学反应可逆性更高,性能更加优异,这一结果与充放电测试结果一致。
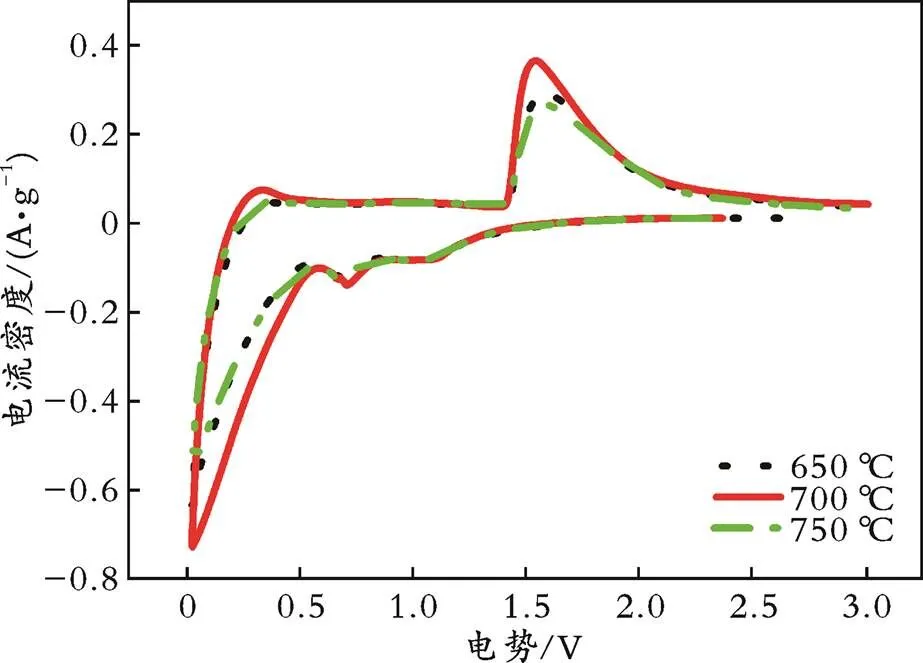
图3 不同退火温度下制备样品的首次CV曲线
2.2 退火时间的考察
在电流密度为0.1 A/g的条件下,对700 ℃下退火1、3、5 h的三个样品进行了充放电循环测试,结果见图4。

图4 不同退火时间下制备的LZTO样品的循环性能
从图4可以看出,退火时间为1、3、5 h的三个样品的放电比容量分别为248.7、267.2、229.4 mA·h/g,循环100圈后放电比容量分别为190.0、211.7、166.4 mA·h/g,相比第二次循环(放电比容量分别为185.6、190.2、167.4 mA·h/g),其容量保持率分别为102.4%、111.3%、99.4%。由此可知,退火时间为3 h的样品具有最优的放电比容量和最稳定的循环性能。因此,最佳的退火时间为3 h。这是因为:若退火时间过长,则材料颗粒过度生长,颗粒变大,导致Li+脱嵌路径变长,不利于大电流充放电;若退火时间过短,则材料结晶不完整,晶体结构不利于Li+的脱嵌[20]。
考察了退火温度为700 ℃、不同退火时间下制备LZTO样品的倍率性能,结果见图5。从图5可以看出,退火时间为1 h的样品在电流密度为0.1、0.2、0.5、0.8、1.0、0.1 A/g时的放电比容量分别为176.1、172.2、146.7、145.2、141.5、206.9 mA·h/g;退火时间为3 h的样品在电流密度为0.1、0.2、0.5、0.8、1.0、0.1 A/g时的放电比容量分别为194.9、183.7、156.3、146.9、142.3、213.6 mA·h/g;退火时间为5 h的样品在电流密度为0.1、0.2、0.5、0.8、1.0、0.1 A/g时的放电比容量分别为174.8、163.1、134.1、127.2、120.1、198.0 mA·h/g。由此可知,退火时间为3 h的样品在不同电流密度下均表现出最高的放电比容量,证明退火3 h制备的钛酸锌锂负极材料具有更好的倍率性能,这与循环性能测试结果一致。
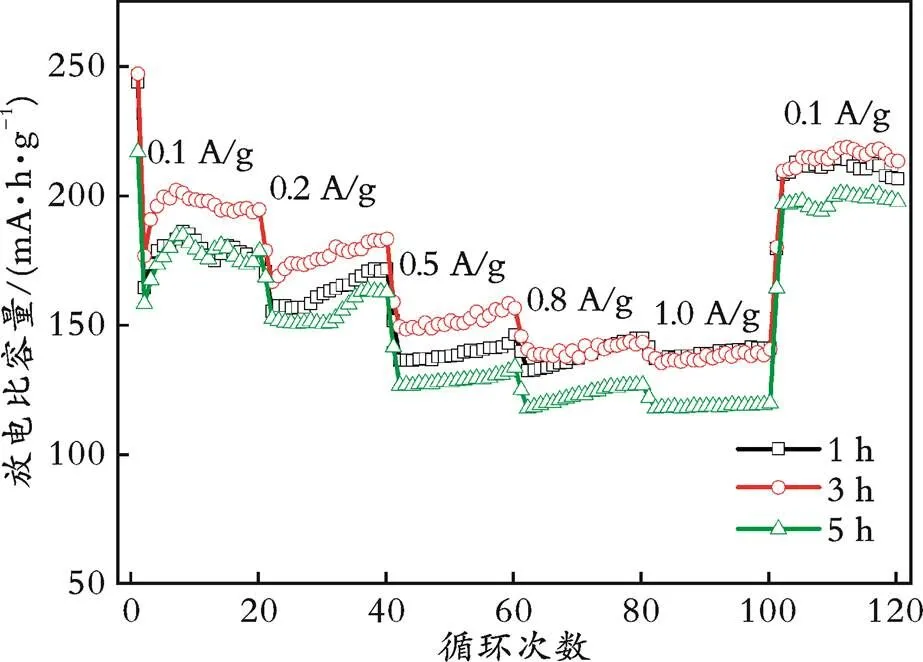
图5 不同退火时间下制备的LZTO样品的倍率性能
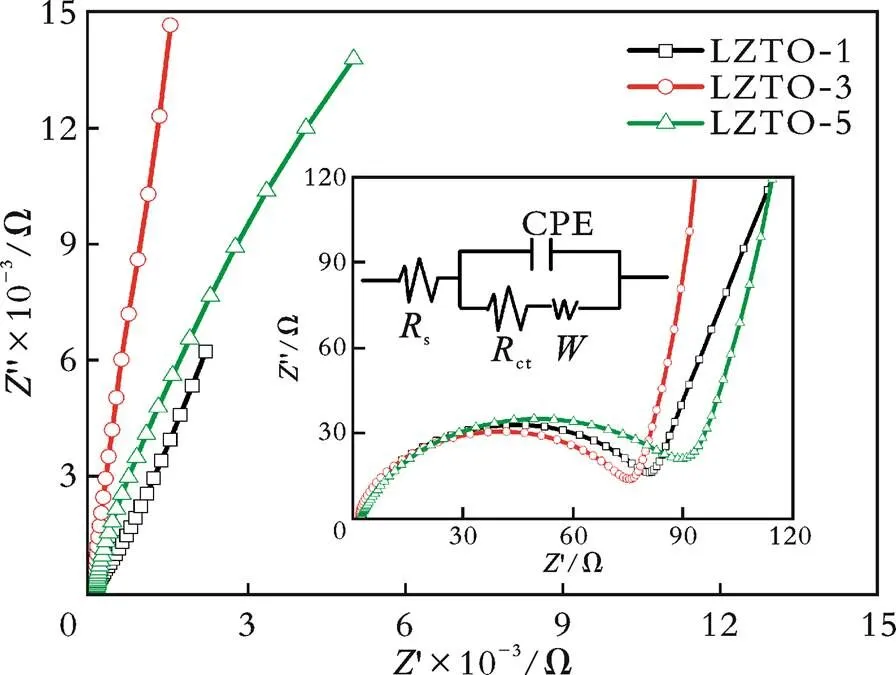
图6 不同退火时间制备的LZTO在循环前的交流阻抗图谱
在扫描速度为0.5 mV/s的条件下,对退火3 h的样品在电势为0.02~3.00 V的范围内进行了CV测试,结果见图7。从图7可以看出,在1.0~1.7 V出现的一对氧化还原峰,此峰可归因于Ti4+与Ti3+之间发生的氧化还原反应[24];1.0 V左右处的还原峰不是很明显,可能与电极极化较大有关;第一圈的CV曲线与随后5圈的CV曲线重叠性较差,这可能与首次充放电过程中发生的副反应有关。
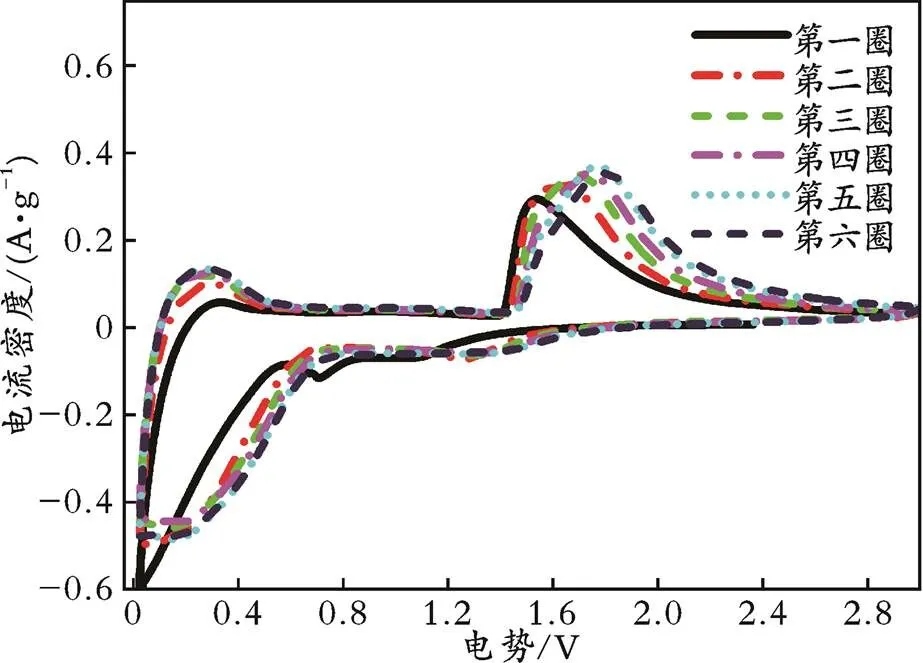
图7 700 ℃退火3 h的LZTO的CV曲线
2.3 柠檬酸物质的量的考察
为进一步提高LZTO负极材料的电化学性能,以柠檬酸为络合剂对LZTO进行了改性。将金属离子与柠檬酸以物质的量比为2.00∶1.25、2.00∶1.50和2.00∶1.75进行投料,分别记为LZTO⁃2/1.25、LZTO⁃2/1.50和LZTO⁃2/1.75,并在电流密度为0.1、0.5 A/g的条件下进行了电化学性能测试,结果见图8。从图8(a)可以看出,LZTO⁃2/1.25、LZTO⁃2/1.50、LZTO⁃2/1.75第一圈的放电比容量分别为235.7、249.4、206.1 mA·h/g,循环100圈后分别降低至207.8、233.6、196.8 mA·h/g,相比第二次循环(放电比容量分别为203.9、214.7、183.7 mA·h/g),其容量保持率分别为101.9%、108.8%、93.3%。由此可见,LZTO⁃2/1.50不仅具有更高的放电比容量,还具有更优异的容量保持率。
从图8(b)可以看出,恒流充放电300次后,LZTO⁃2/1.25、LZTO⁃2/1.50、LZTO⁃2/1.75的放电比容量分别为167.1、203.6、136.4 mA·h/g,相比第二次循环(放电比容量分别为174.7、200.0、146.2 mA·h/g),其容量保持率分别为95.6%、101.8%和93.3%,即LZTO⁃2/1.50负极具有最优异的循环稳定性,与图8(a)的结果一致。综上所述,在不同的电流密度下,LZTO⁃2/1.50负极始终保持着较高的放电比容量和稳定的循环性能。这可能是因为适量的柠檬酸使样品的颗粒分散得更加均匀,同时为Li+的迁移提供了更多的通道。因此,对比已报道的同种或者同类材料,LZTO⁃2/1.50具有较优的循环性能(见表1)。
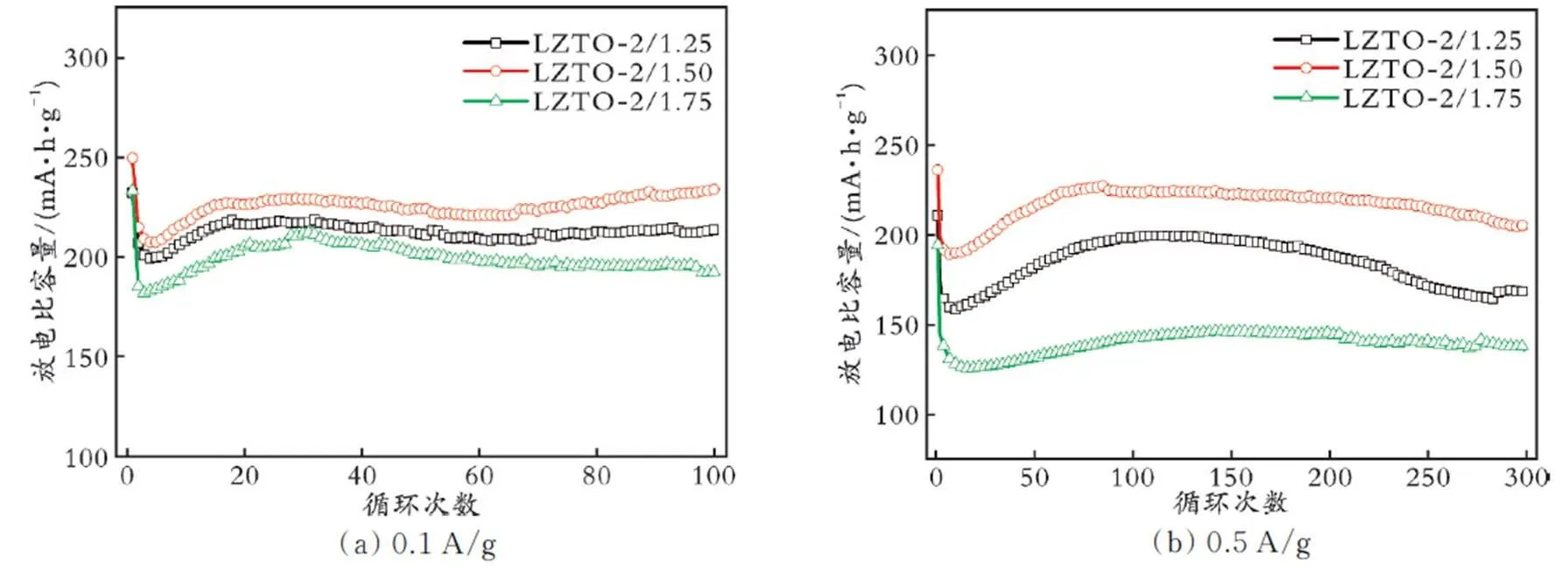
图8 用不同物质的量的柠檬酸改性的LZTO样品的循环性能曲线
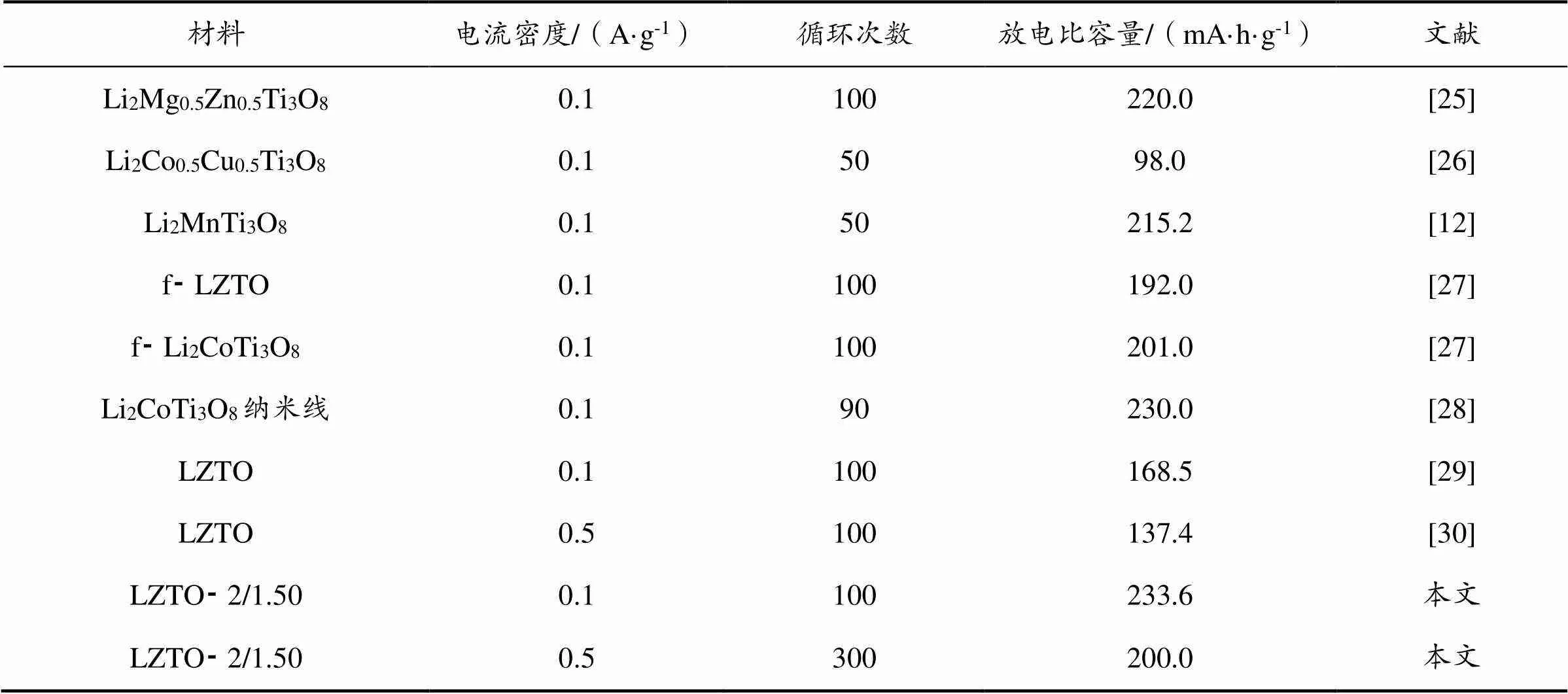
表1 LZTO以及与LZTO材料结构类似负极的循环性能
绘制了采用不同物质的量柠檬酸改性的LZTO⁃2/1.25、LZTO⁃2/1.50和LZTO⁃2/1.75电极材料在循环前的交流阻抗谱图及等效电路图,结果见图9。
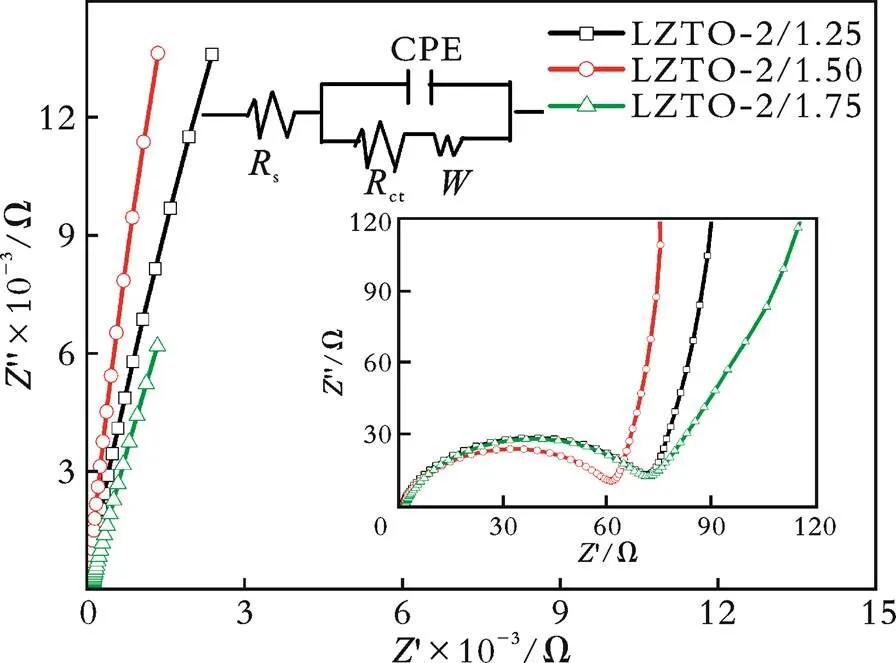
图9 用不同物质的量的柠檬酸改性的LZTO样品循环前的交流阻抗图谱
从图9可以看出,LZTO⁃2/1.50电极阻抗谱图的半圆直径最小,对应的电荷迁移的电阻最小,有利于材料的电化学性能。
在扫描速度为0.5 mV/s的条件下,对用不同物质的量的柠檬酸改性的LZTO样品在电势为0.02~3.00 V的范围内进行了CV测试,结果见图10。从图10可以看出,三条曲线形状相似,在电势为1.0~1.7 V处均有一对氧化还原峰,这说明用不同物质的量的柠檬酸改性的LZTO负极材料的电化学反应过程相同;在电势为0.5 V附近均存在一个还原峰,这对应于LZTO中Ti4+的多次还原[31⁃32]。
表2为用不同物质的量的柠檬酸改性的LZTO样品的氧化还原峰电势及电势差。由表2可知,LZTO⁃2/1.25、LZTO⁃2/1.50和LZTO⁃2/1.75的氧化还原峰电势差分别为0.50、0.48、0.55 V,其中LZTO⁃2/1.50样品的氧化还原峰电势差最小,说明其极化程度最小,可逆性最好,而且该材料氧化还原峰表现出更强的电流密度和更大的峰面积,即具有更快的动力学过程以及更高的充放电比容量。
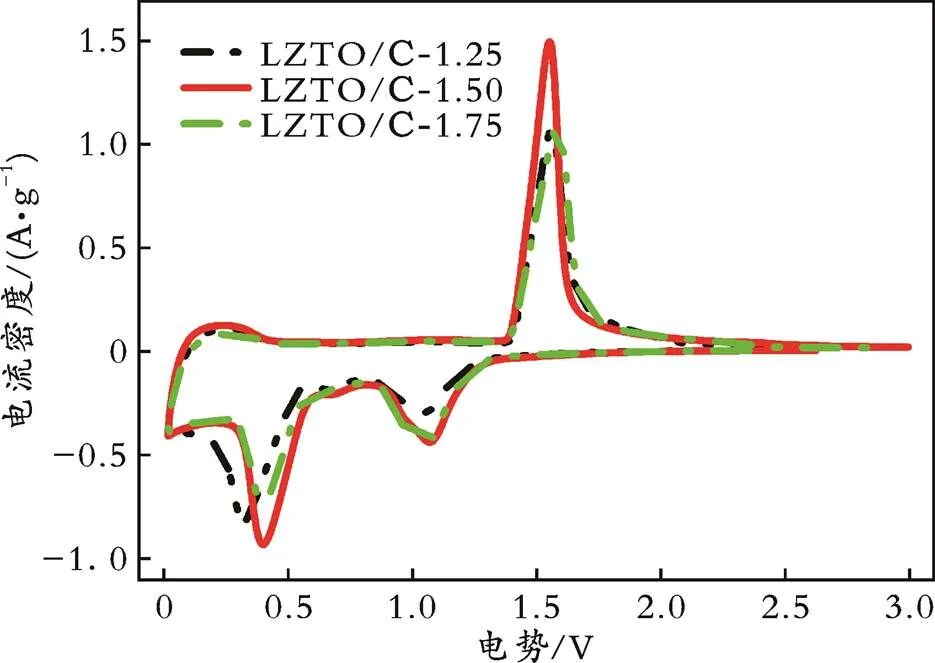
图10 用不同物质的量的柠檬酸改性的LZTO样品首圈循环伏安曲线
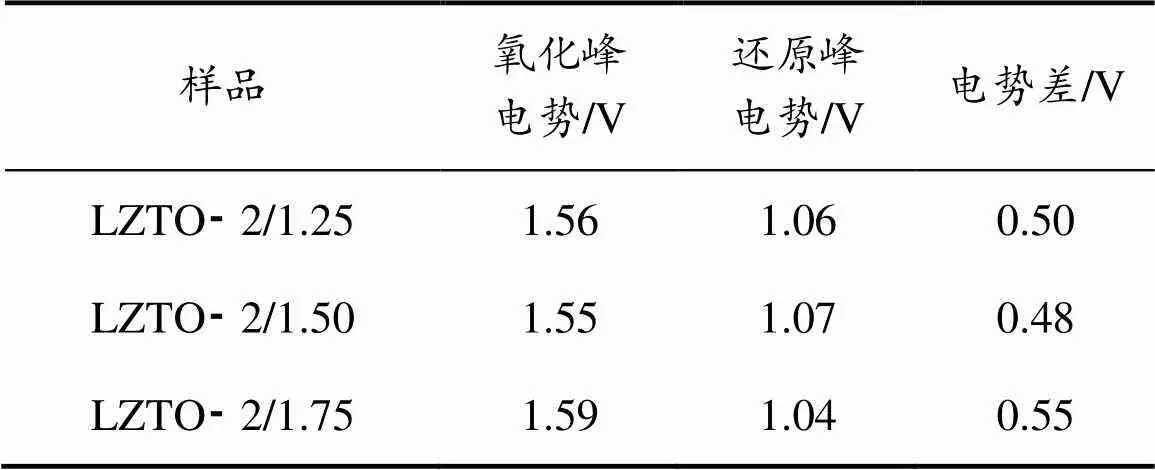
表2 用不同物质的量的柠檬酸改性的LZTO样品的氧化还原峰电势及电势差
2.4 原始样品和改性LZTO的比较
图11为原始样品(P⁃LZTO)和改性样品的X⁃射线衍射图。
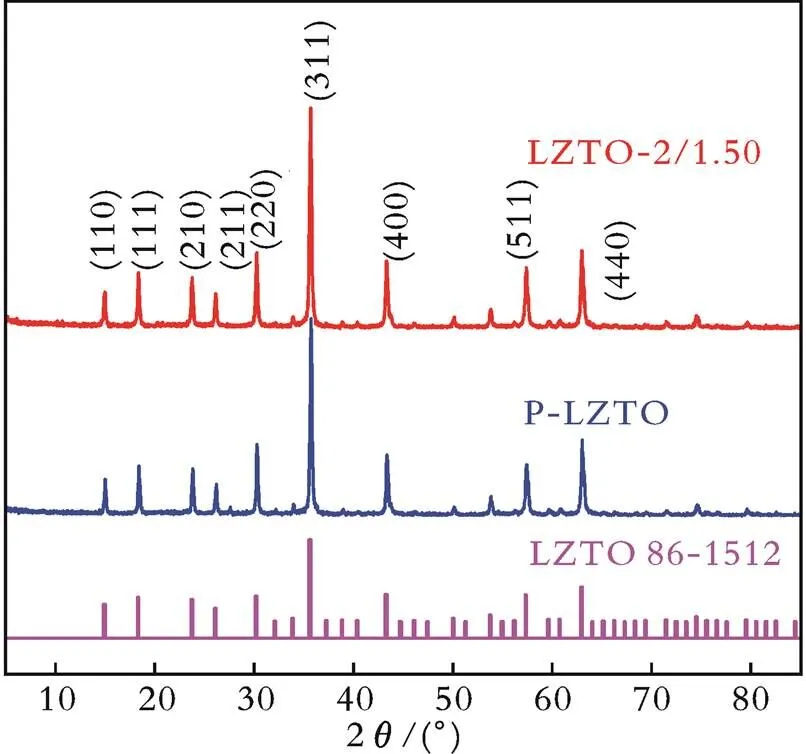
图11 原始样品(P⁃LZTO)和改性样品的X⁃射线衍射图
从图11可以看出,两条谱线分别在2为15.0°、18.4°、23.8°、26.1°、30.3°、35.6°、43.3°、57.2°和62.8°处存在9个较明显的峰,分别归属于尖晶石LZTO的(110)、(111)、(210)、(211)、(220)、(311)、(440)、(511)和(440)晶面,这与H.YANG等[33]的结果一致;曲线中未出现杂质峰,说明溶胶⁃凝胶法制备的产物纯度较高;LZTO⁃2/1.50样品的衍射峰较为尖锐,表明材料的结晶度高。
为了探究LZTO⁃2/1.50材料具有更优异的电化学性能的原因,对比了LZTO⁃2/1.50与P⁃LZTO在不同的倍率下的SEM图,结果见图12。

图12 在不同放大倍率下P⁃LZTO和LZTO⁃2/1.50样品的SEM图
从图12可以看出,两个样品都由纳米尺寸的颗粒聚集而成。
由于颗粒大小是影响材料电化学性能的一个重要原因,因此利用Nano Measure软件分别对P⁃LZTO和LZTO⁃2/1.50样品的粒径大小进行了测量,结果见图13。
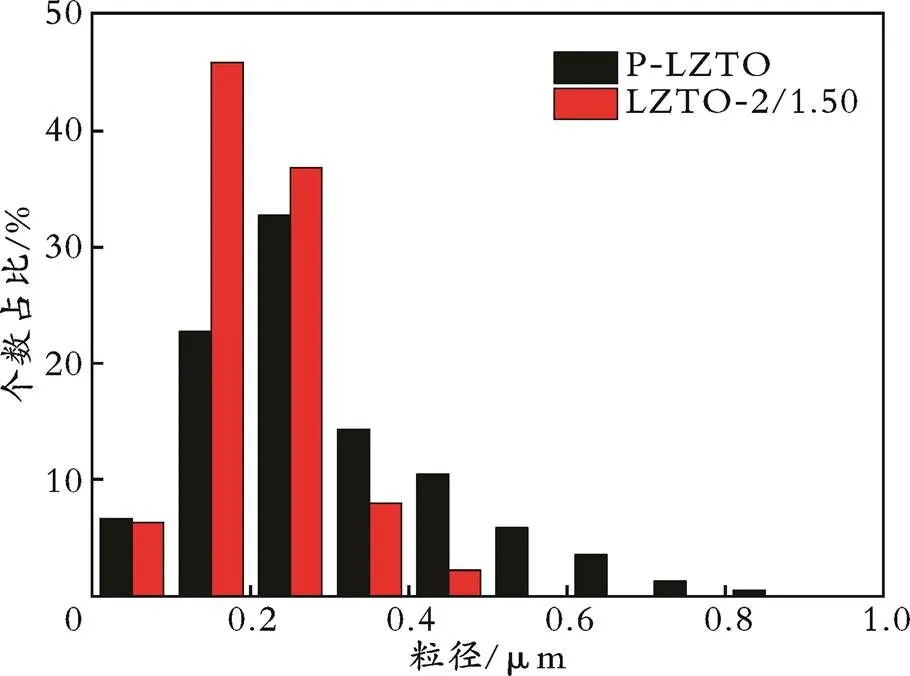
图13 P⁃LZTO和LZTO⁃2/1.50样品的粒径分布
从图13可以看出,P⁃LZTO样品的粒径主要分布在0.3 μm左右,而且粒径分布不均匀;LZTO⁃2/1.50样品的粒径主要分布在0.2 μm左右,粒径尺寸更小,具有更大的比表面积。综上所述,相比P⁃LZTO样品,LZTO⁃2/1.50样品的形貌更有利于材料电化学性能的提高。
3 结 论
1)柠檬酸以金属离子/柠檬酸=2.00∶1.50的投料比加入,并在700 ℃的温度下退火3 h制备的钛酸锌锂负极材料,其放电比容量与未添加柠檬酸的LZTO相比得到了明显提高,这源于加入柠檬酸后材料的颗粒尺寸减小,比表面积增加,脱嵌锂活性位增加,进而提高材料的比容量。
2)通过柠檬酸改性,LZTO负极材料的比容量得到了提升,但是其倍率性能还有待提升,所以在接下来的工作中可以进一步采用碳包覆以提高材料的倍率性能。
3)LZTO负极材料在有些电流密度下的循环出现了比容量持续攀升的现象,具体原因还需要进一步探索。
[1] TANG H Q, ZHU J T, TANG Z Y, et al. Al⁃doped Li2ZnTi3O8as an effective anode material for lithium⁃ion batteries with good rate capabilities[J]. Journal of Electroanalytical Chemistry, 2014, 731: 60⁃66.
[2] CHEN C, AI C C, LIU X Y, et al. Advanced electrochemical properties of Ce⁃modified Li2ZnTi3O8anode material for lithium⁃ion batteries[J]. Electrochimica Acta, 2017, 227: 285⁃293.
[3] 冯莲晶,王利娟.Sn4P3⁃G@C负极在锂离子电池中的应用[J].石油化工高等学校学报,2023,36(1):66⁃73.
FENG L J, WANG L J. Applications of Sn4P3‐G@C Anodes in Li‐ion Batteries[J].Journal of Petrochemical Universities,2023,36(1):66⁃73.
[4] QIE F C, TANG Z Y. Cu⁃doped Li2ZnTi3O8anode material with improved electrochemical performance for lithium⁃ion batteries[J]. Materials Express, 2014, 4(3): 221⁃227.
[5] LI Y Y, DU C Q, LIU J, et al. Synthesis and characterization of Li2Zn0.6Cu0.4Ti3O8anode material via a sol⁃gel method[J]. Electrochimica Acta, 2015, 167: 201⁃206.
[6] REN Y R, LU P, HUANG X B, et al. Enhanced electrochemical properties of Li2ZnTi3O8/C nanocomposite synthesized with phenolic resin as carbon source[J]. Journal of Solid State Electrochemistry, 2017, 21(1): 125⁃131.
[7] 严雪,李佳. 核壳结构的锂离子电池硅锗负极材料电化学性能的理论研究[J]. 当代化工, 2018, 47(9): 1764⁃1766.
YAN X, LI J. Computational study on electrochemical performance of Si⁃Ge core⁃shell structure as lithium battery anode[J]. Contemporary Chemical Industry, 2018, 47(9): 1764⁃1766.
[8] 刘浪浪,问娟娟. 锂离子电池新型负极材料的研究进展[J]. 当代化工, 2014, 43(12): 2690⁃2692.
LIU L L, WEN J J. Research progress in anode materials for lithium ion batteries[J]. Contemporary Chemical Industry, 2014, 43(12): 2690⁃2692.
[9] YILDIZ S, ŞAHAN H. In situ synthesis of reduced graphite oxide⁃Li2ZnTi3O8composite as a high rate anode material for lithium⁃ion batteries[J]. Journal of the Electrochemical Society, 2019, 166(10): A2002⁃A2012.
[10] TANG H Q, CHEN C, LIU T, et al. Chitosan and chitosan oligosaccharide: Advanced carbon sources are used for preparation of N⁃doped carbon⁃coated Li2ZnTi3O8anode material[J]. Journal of Electroanalytical Chemistry, 2020, 858: 113789⁃113797.
[11] XU Y X, HONG Z S, XIA L C, et al. One step sol⁃gel synthesis of Li2ZnTi3O8/C nanocomposite with enhanced lithium⁃ion storage properties[J]. Electrochimica Acta, 2013, 88: 74⁃78.
[12] CHEN W, LIANG H F, SHAO L Y, et al. Observation of the structural changes of sol⁃gel formed Li2MnTi3O8during electrochemical reaction by in⁃situ and ex⁃situ studies[J]. Electrochimica Acta, 2015, 152: 187⁃194.
[13] YAO L L, NING Z Y, GUO S T, et al. On the sol⁃gel synthesis mechanism of nanostructured Li3.95La0.05Ti4.95Ag0.05O12with enhanced electrochemical performance for lithium ion battery[J]. Ceramics International, 2017, 43(3): 3393⁃3400.
[14] LIU T, TANG H Q, ZAN L X, et al. Comparative study of Li2ZnTi3O8anode material with good high rate capacities prepared by solid state, molten salt and sol⁃gel methods[J]. Journal of Electroanalytical Chemistry, 2016, 771: 10⁃16.
[15] LI Z F, LI H, CUI Y H, et al. Li2MoO4modified Li2ZnTi3O8as a high property anode material for lithium ion battery[J]. Journal of Alloys and Compounds, 2017, 692: 131⁃139.
[16] TANG H Q, ZHOU Y K, ZAN L X, et al. Long cycle life of carbon coated lithium zinc titanate using copper as conductive additive for lithium ion batteries[J]. Electrochimica Acta, 2016, 191: 887⁃894.
[17] 张毅. 高倍率锂离子电池Li4Ti5O12材料的制备与改性研究[D]. 哈尔滨:哈尔滨工业大学, 2011.
[18] BORGHOLS W J H, WAGEMAKE M, LAFONT U, et al. Size Effects in the Li4+xTi5O12spinel[J]. Journal of the American Chemical Society, 2009. 131(49): 17786⁃17792.
[19] GE H, LI N, LI D Y, et al. Electrochemical characteristics of spinel Li4Ti5O12discharged to 0.01 V[J]. Electrochemistry Communications, 2008, 10(5): 719⁃722.
[20] 杨建文,钟晖,钟海云,等. Li4Ti5O12的合成及其影响因素[J]. 中南大学学报(自然科学版), 2005, 36(1): 1672⁃7207.
YANG J W, ZHONG H, ZHONG H Y, et al. Synthesis and influential factors of Li4Ti5O12[J]. Journal of Central South University(Science and Technology), 2005, 36(1): 1672⁃7207.
[21] WANG L J, MENG Z H, WANG H W, et al. Effects of TiO2starting materials on the synthesis of Li2ZnTi3O8for lithium ion battery anode[J]. Ceramics International, 2016, 42(15): 16872⁃16881.
[22] LIU T, TANG H Q, LIU J Y, et al. Improved electrochemical performance of Li2ZnTi3O8using carbon materials as loose and porous agent[J]. Electrochimica Acta, 2018, 259: 28⁃35.
[23] TANG H Q, ZAN L X, TANG Z Y. Predominant electronic conductivity of Li2ZnTi3O8anode material prepared in nitrogen for rechargeable lithium⁃ion batteries[J]. Journal of Electroanalytical Chemistry, 2018, 823: 269⁃277.
[24] MENG Z H, WANG S, WANG L J, et al. Synthesis of high performance N⁃doped carbon coated Li2ZnTi3O8via a NTA⁃assisted solid⁃state route[J]. Dalton Transations, 2018, 47(8): 2711⁃2718.
[25] HONG Z S,LAN T B, ZHENG Y Z, et al. Spinel Li2MTi3O8(M=Mg, Mg0.5Zn0.5) nanowires with enhanced electrochemical lithium storage[J]. Functional Materials Letters, 2011, 4(1): 65⁃69.
[26] CHEN W, DU R H, REN W J, et al. Solid state synthesis of Li2Co0.5Cu0.5Ti3O8and Li2CoTi3O8and their comparative lithium storage properties[J]. Ceramics International, 2014, 40(8): 13757⁃13761.
[27] LI X, XIAO Q, LIU B, et al. One⁃step solution⁃combustion synthesis of complex spinel titanate flake particles with enhanced lithium⁃storage properties[J]. Journal of Power Sources, 2015, 273: 128⁃135.
[28] HONG Z S, ZHENG X Z, DING X K, et al. Complex spinel titanate nanowires for a high rate lithium⁃ion battery[J]. Energy & Environmental Science, 2011, 4(5): 1886⁃1891.
[29] YANG H, ZHU H L, QI Y X, et al. Optimizing the cycling life and high⁃rate performance of Li2ZnTi3O8by forming thin uniform carbon coating derived from citric acid[J]. Journal of Materials Science, 2020, 55(32): 15538⁃15550.
[30] QIU L Y, LAI X Q, WANG F F, et al. Promoting the Li storage performances of Li2ZnTi3O8@Na2WO4composite anode for Li⁃ion battery[J]. Ceramics International, 2021, 47(14): 19455⁃19463.
[31] TANG H Q, TANG Z Y. Effect of different carbon sources on electrochemical properties of Li2ZnTi3O8/C anode material in lithium⁃ion batteries[J]. Journal of Alloys and Compounds, 2014, 613: 267⁃274.
[32] TANG H Q, ZAN L X, MAO W F, et al. Improved rate performance of amorphous carbon coated lithium zinc titanate anode material with alginic acid as carbon precursor and particle size controller[J]. Journal of Electroanalytical Chemistry, 2015, 751: 57⁃64.
[33] YANG H, PARK J, KIM C S, et al. Uniform surface modification of Li2ZnTi3O8by liquated Na2MoO4to boost electrochemical performance[J]. ACS Applied Materials & Interfaces, 2017, 9(50): 43603⁃43613.
Synthesis of Lithium Zinc Titanate Anodes by a Sol⁃Gel Method
WANG Lifu, LU Huijia, XU Hang, BAO Pengwei, WAN Yihang, XUN Rui, ZHANG Zhongxue, WANG Lijuan
(School of Petrochemical Engineering, Liaoning Petrochemical University, Fushun Liaoning 113001, China)
Li2ZnTi3O8(LZTO) anodes of lithium⁃ion batteries have been prepared by a sol⁃gel method. The effects of the calcination temperature and time on the electrochemical performance have been studied for LZTO in detailed. The optimum calcination temperature and time are 700 ℃ and 3 h, respectively. On the basis of the optimum preparation process, citric acid as the chelating agent has been introduced into the synthesis to modify LZTO. When the molar ratio of metal ions to citric acid is 2.00∶1.50, the obtained product is denoted as LZTO⁃2/1.50, which has small particle size, good dispersion, and then shows good electrochemical performance. The discharge specific capacity is 203.6 mA·h/g after 300 cycles at the current density of 0.5 A /g for LZTO⁃2/1.50.
Lithium zinc titanate; Sol⁃gel method; Citric acid; Electrochemical performance; Anode material
TQ15
A
10.12422/j.issn.1672⁃6952.2024.01.004
2023⁃04⁃21
2023⁃05⁃27
辽宁省“兴辽英才计划”项目(XLYC1907025);辽宁石油化工大学第五层次人才基金项目((2018XJJ)⁃012);辽宁省教育厅面上项目(LJKZ0408);辽宁省大学生创新创业训练计划项目(2021101480017)。
王立福(2000⁃),男,本科生,材料化学专业,从事锂离子电池研究;E⁃mail:1478595623@qq.com。
王利娟(1983⁃),女,博士,教授,从事锂(钠)离子电池材料方面的研究;E⁃mail:lijuanw123@163.com。
王立福,卢汇嘉,许航,等.溶胶⁃凝胶法合成钛酸锌锂负极材料[J].辽宁石油化工大学学报,2024,44(1):21-28.
WANG Lifu,LU Huijia,XU Hang,et al.Synthesis of Lithium Zinc Titanate Anodes by a Sol⁃Gel Method[J].Journal of Liaoning Petrochemical University,2024,44(1):21-28.
(编辑 宋官龙)

