凝固酶阴性葡萄球菌在发酵食品中的应用
叶圣雨,吴佳佳*,屈 炯,戴志远
(1 浙江工商大学海洋食品研究院 杭州310012 2 湖州海关 浙江湖州 313000)
葡萄球菌(Staphylococcus)是一类革兰氏阳性球菌,因其在显微镜下呈现出堆积的葡萄状而得名。葡萄球菌在自然界分布广泛,是人类和温血动物体表或体表黏液正常菌群中的一部分,同时也栖息于土壤、水、空气,甚至一些食品中[1-3]。根据产生凝固酶能力的不同,葡萄球菌属成员可被分为凝固酶阳性葡萄球菌(Coagulase positive staphylococci,CPS)和凝固酶阴性葡萄球菌(Coagulase negative staphylococci,CNS)两大类。一般而言,凝固酶阳性葡萄球菌(CPS)多具有致病性或产毒性,甚至两者兼具,能引起人和动物的多种感染性炎症[4],其肠毒素是引起食物中毒的重要原因。临床常见的金黄色葡萄球菌(S.aureus)、中间型葡萄球菌(S.intermedius)均为CPS 中的代表[5]。而凝固酶阴性葡萄球菌(CNS)除表皮葡萄球菌(S.epidermidis)、溶血葡萄球菌(S.haemolyticus)和腐生葡萄球菌(S.saprophyticus)等少数与临床感染有关的条件致病菌外,绝大多数CNS 不具备致病风险。
CNS 在自然界中分布广泛,多栖息于人和动物的皮肤、口腔及肠道以及动物来源的食物、环境中。分离自鲜肉、鲜奶、鱼体的CNS,如肉葡萄球菌(S.carnosus)、木糖葡萄球菌(S.xylosus)、马胃葡萄球菌(S.equorum)、腐生葡萄球菌等,通常是参与发酵香肠、奶酪、咸鱼、酱油等食品生产的优势菌。研究证明,CNS 作为优势生产菌群可以赋予发酵食品(肉制品、乳制品及水产品)良好的风味、色泽及质地[6],是发酵食品中的有益微生物菌群。在实际生产中,CNS 常和乳酸菌一同被应用于肉制品、乳制品的生产。CNS 中的肉球葡萄球菌因遗传背景研究较为深入,从上世纪50 年代开始,便作为商业化发酵剂应用于工业化发酵香肠中[7]。木糖葡萄球菌则是发酵肉制品和发酵乳酪中应用较为广泛的商业化食品发酵剂[8]。2016 年,我国将木糖葡萄球菌、肉葡萄球菌和小牛葡萄球菌(S.vitulinus)3 种CNS 菌株正式纳入 《可食用菌种名单》。此外,其它CNS 也被作为小众产品的发酵剂在特定的区域范围使用。例如,肉葡萄球菌和模仿葡萄球菌(S.simulus)用作意大利香肠的工业生产发酵剂[9];马胃葡萄球菌被应用于干酪发酵生产中[10];而木糖葡萄球菌可用于“酸鱼”的发酵[11]。
大量研究阐述了CNS 具有良好的生产性能,生产实践也证明,添加CNS 不仅能提高发酵乳肉制品的质量和安全性,还能有效缩短生产周期,商品化CNS 发酵剂的开发与应用对于提高发酵食品的品质和安全性具有重要意义。然而,由于食源性CNS 与CPS 中的金黄色葡萄球菌、中间葡萄球菌等致病菌具有邻近的亲缘关系、相似的遗传背景,加之一些食源性的CNS 能够在临床检出,学者们对CNS 在食品生产中应用的安全性仍存质疑。本文总结近年来食品中CNS 的相关研究,基于CNS 代谢特性详细阐述其对发酵食品品质形成的影响,以及CNS 用作发酵剂时需关注的安全问题,为科学筛选CNS 发酵剂提供更多的理论依据。
1 CNS 对发酵食品品质的影响
作为自然发酵肉制品、乳酪、腌鱼等食物生境中的优势菌群,CNS 携带的多种酶活性以及代谢产物使其在提升发酵产品风味,改善肉制品色泽,减少发酵过程中生物胺积累,抑制其它有害菌生长等诸多方面发挥着重要作用。同时,CNS 对发酵生产环境具有较强的适应力,因此具备作为发酵食品工业化生产发酵剂的潜质。
1.1 CNS 促进发酵产品风味的形成
风味是评价发酵食品品质的一个重要指标。在发酵香肠、乳酪、发酵鱼制品等发酵食品的生产中,除了化学反应和内源酶的作用外,微生物代谢在产品风味形成中发挥重要作用。如表1 所示,CNS 具备较好的脂肪酶、蛋白酶、酯酶等丰富的酶活性,在发酵过程中,CNS 依靠其代谢产酶,将发酵产品原材料中的脂肪、蛋白质等大分子逐级降解为脂肪酸、多肽、氨基酸、酮、醛、酸等小分子,促进发酵风味的形成。此外,CNS 也能够对碳水化合物进行缓慢代谢,生成有机酸和挥发性风味物质,如乙醛、乙偶姻、双乙酰等[6]。

表1 CNS 产酶及其对发酵食品风味物质的影响Table 1 CNS Enzymes and its effect on flavor compounds in fermented food
在实际生产过程中,虽然内源酶对脂肪的降解发挥主要作用,但CNS 对脂肪降解和风味物质积累的作用仍不容忽视。绝大多数CNS 都有良好的脂肪酶活性,可以促进肌肉和脂肪组织中脂质的水解。研究表明,接种木糖葡萄球菌进行发酵的哈尔滨干香肠,其游离脂肪酸含量增加了6~9倍[12]。Zeng 等[11]发现,接种木糖葡萄球菌生产的低盐发酵鱼,产品中油酸、亚油酸和亚麻酸等不饱和脂肪酸的含量显著增加,同时有大量棕榈酸积累。游离脂肪酸是脂质氧化的主要产物,也是进一步形成芳香化合物的关键[13]。CNS 能通过不完全的β-氧化对游离脂肪酸进行降解,促进与产品独特风味相关的小分子物质积累。通常,脂肪酸首先被氧化成烯脂酰辅酶A(enoyl-CoA),再被水合成羟脂酰辅酶A(hydroxyacyl-CoA),随后脱氢生成酮脂酰辅酶A(ketoacyl-CoA),酮脂酰辅酶A 进一步被硫解为β-酮酸、短链游离脂肪酸和乙酰辅酶A[6]。CNS 能够对β-酮酸进行脱羧生成甲基酮类化合物[14],如2-戊酮、2-己酮和2-庚酮等[15]。甲基酮类化合物具有果味和脂肪气味且阈值较低,对发酵肉制品的典型风味形成起积极作用。同时,甲基酮也可以进一步还原为仲醇,进而通过CNS 的酯酶活性,与酸发生酯化反应生成乙酯类芳香化合物[16]。干发酵香肠生产中的木糖葡萄球菌和肉葡萄球菌利用其β-脂肪氧化活性对脂肪酸进行降解,产生大量与风味相关的支链和直链甲基酮内酯[17]。接种木糖葡萄球菌、肉葡萄球菌后,意大利Salami 香肠中游离脂肪酸含量、不饱和脂肪酸降解形成的醛、酮、醇等小分子化合物含量显著上升[18]。
CNS 对蛋白质的降解,尤其是对氨基酸的代谢有重要作用,影响产品中多肽、氨基酸、氨基酸降解物等风味物质的组成,促进了发酵食品特征风味的形成[19]。CNS 对肌肉中大分子蛋白质的降解能力存在较大菌种间差异,尤其表现在不同菌株对肌原纤维蛋白和肌浆蛋白水解能力的差异上。Casaburi 等[9]研究发现意大利发酵香肠中分离所获的肉葡萄球菌和模仿葡萄球菌能较好地水解肌浆蛋白,而中国传统低盐发酵“酸鱼”中分离的木糖葡萄球菌则对草鱼的肌原纤维蛋白和肌浆蛋白均有水解活性[11]。CNS 对蛋白质降解的贡献主要体现在水解肽链和氨基酸转化两个方面:CNS能产生肽酶降解肽链,从而大量积累游离氨基酸[20];同时,CNS 代谢中,缬氨酸、亮氨酸和异亮氨酸3 种支链氨基酸发生反式胺化和脱羧反应,生成支链醛、羧酸和醇等挥发性风味成分[16]。图1 是亮氨酸经CNS 代谢产生发酵香肠特有风味物质3-甲基丁醛和3-甲基丁酸的过程[17]。肉葡萄球菌和木糖葡萄球菌均有较强的支链氨基酸转化能力,然而由于两者的代谢差异,生产中添加不同菌株,其最终积累的风味物质差异较大。希腊salami生产中,添加木糖葡萄球菌促进了3-甲基-1-丁醇、双乙酰、2-丁酮、乙偶姻、苯甲醛、苯乙酮和甲基支链酮等多种风味物质的积累[21]。肉葡萄球菌则对支链氨基酸表现出更强的转化能力,能将其转化为甲基支链醛(如3-甲基丁醛、2-甲基丁醛和2-甲基丙醛)或相应的酸[14]。
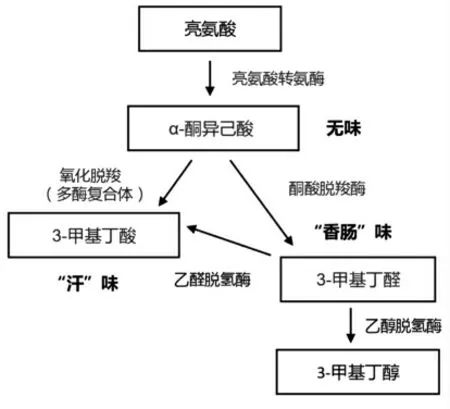
图1 亮氨酸转化为芳香化合物的假设途径[17]Fig.1 Hypothetical pathway for the conversion of leucine into aroma compounds[17]
CNS 借助酯合成酶促进酯类物质在发酵食品生产中积累,进而影响产品风味,其催化生成的乙酯类化合物(丁酸乙酯和3-甲基丁酸乙酯)是发酵肉制品的典型风味物质[22]。木糖葡萄球菌135产生的乙酯可以赋予产品水果味并掩盖腐酸气味,从而消减发酵制品中的鱼腥味、铁锈腥味、酸败味等不良气味[23];而接种了木糖葡萄球菌的酸鱼也可以产生酯类物质,传递令人愉快的香气[24]。此外,脂肪酶和蛋白酶作用生成的脂肪酸和氨基酸在氧化酶的作用下,也可以进一步生成酯,例如:干发酵香肠生产中的木糖葡萄球菌和肉葡萄球菌具有脂肪酶氧化活性,促使脂肪酸进一步氧化生成具有风味的支链和直链甲基酮内酯;软骨葡萄球菌(S.chondrosus)在氧化酶作用下,可将亮氨酸转化为2-乙基或3-甲基丁酸酯[17]。在合成酯的同时,CNS 中的酯降解酶也可以促使酯类发生水解作用,形成酸类与醇类,从而对发酵产品风味起到调节作用。肉葡萄球菌的酯降解酶活性可以促进分解甘氨酸乙酯,且这个活性可以贯穿于细胞的整个生长周期[25]。
1.2 CNS 改善发酵肉制品的色泽
色泽是反映肉制品品质的一个重要指标,在传统肉类加工中,借助添加硝酸盐/亚硝酸盐形成加工肉制品特有的色泽。硝酸盐/亚硝酸盐在肉制品中被还原生成一氧化氮(NO),NO 与肉品中的肌红蛋白(Mb)发生配位反应,生成具有腌肉制品特征红色的亚硝基肌红蛋白(NO-Mb)。研究发现在发酵肉制品生产过程中,添加肉葡萄球菌或马胃葡萄球菌等CNS,能够更好地促进发色,改善产品色泽。Huang 等[28]研究发现在不添加硝酸盐的干香肠中,添加3 种不同的CNS 可以使干香肠产生诱人的色泽。CNS 促进肉制品发色的机制主要有两种(图2):一是通过产生硝酸盐/亚硝酸盐还原酶,促使硝酸盐和亚硝酸盐还原生成NO,进而生成NO-Mb;二是在O2和NADPH+存在下,CNS 通过一氧化氮合酶(NOS)催化L-精氨酸生成NO 和L-瓜氨酸[29],NO 与肌红蛋白结合形成NO-Mb,促成了发酵肉制品色泽的形成[13]。
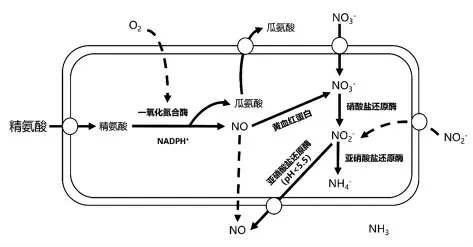
图2 CNS 中NO 合成途径[6]Fig.2 NO synthesis pathway in CNS[6]
研究表明,不同种的CNS 产硝酸盐还原酶能力存在较大差异。肉葡萄球菌、木糖葡萄球菌这两种常用作肉制品发酵剂的CNS 具有突出的硝酸盐还原能力,马胃葡萄球菌、迟缓葡萄球菌(S.lentus)、模仿葡萄球菌、松鼠葡萄球菌(S.sciuri)、腐生葡萄球菌常具有较强的硝酸盐还原酶活性,而沃氏葡萄球菌(S.warneri)的硝酸盐还原酶活性较低或不存在[30]。Vermassen 等[31]在腌肉模型试验中,发现木糖葡萄球菌能够在24 h 降解80%以上的硝酸盐。Bosse 等[32]在腌制火腿中接种肉葡萄球菌LTH 7036(高硝酸盐还原酶活性)和肉葡萄球菌LTH 3838(低硝酸还原酶活性)两种发酵剂,对比发现CNS 的硝酸盐还原酶活性是肉制品色泽形成的关键。
一氧化氮合酶基因(nos)广泛分布于食源性CNS 中[33]。Ras 等[34]对肉制品中分离获得的、隶属于肉葡萄球菌、马胃葡萄球菌、表皮葡萄球菌、沃氏葡萄球菌和木糖葡萄球菌5 个种的113 株CNS进行基因检测,发现所有的分离菌株均携带nos基因,然而其NO 的产量很低,亚硝基肌红蛋白仅占红色素类物质的8%~16%。黄攀发现,在发酵香肠体系中,通过添加蔗糖可以诱导小牛葡萄球菌中nos 基因的表达,可促使NO 产量升高,促进NO-Mb 形成,提升产品色泽[35]。然而,许多研究表明,实际生产中单纯使用CNS 进行发色,其发色效果与添加亚硝酸盐相比仍有较大差距[36]。
此外,发酵肉制品生产中,添加硝酸盐和亚硝酸盐不仅能够促进发色,还能有效抑制肉毒梭菌等致病菌的滋生,因此在研究硝酸盐和亚硝酸盐替代发色品的过程中,其抑菌作用亦不能被忽视。
1.3 CNS 对产品中生物胺含量的影响
生物胺是生物有机体中常见的化合物,天然存在于许多食物中,如水果、蔬菜、肉类、鱼类、巧克力和牛奶等。它们在生物有机体中负责许多基本功能[37],然而人体过量摄入这些胺类物质可能会对健康造成影响,引起头疼、心悸、呕吐等毒性反应[38]。在发酵食品生产中,一些微生物产生的氨基酸脱羧酶作用于组氨酸、酪氨酸、精氨酸等氨基酸后,会形成组胺、酪胺、腐胺等生物胺的积累。因此,产生物胺的能力也是评价发酵食品生产菌株安全性的一个重要标准[39]。
筛选不产生物胺的生产菌株,能够从源头上把控产品中生物胺的含量。在发酵菌株筛选过程中,研究人员通过宏基因组和宏转录组学的研究手段,对传统酱油ganjang 发酵过程中分离的微生物产生生物胺的脱羧酶序列[40]及其代谢物中的生物胺进行分析,从而筛选出一些低产或不产生物胺的发酵菌株,从而有效避免该类有害物质的积累。Kanjan 等[41]对模拟葡萄球菌PMRS35 进行基因检测,发现其不携带产生组胺、酪胺、腐胺等生物胺的相关的氨基酸脱羧酶基因。Landeta 等[42]通过对分离自西班牙干腌火腿加工过程中的56 种CNS 进行多种氨基酸脱羧酶基因检测,从中筛选出不产生物胺的CNS 作为发酵剂。
筛选能够对生物胺进一步降解的生产菌株,也可以一定程度上消除或减少产品中生物胺的含量。在食品生产中,部分CNS 菌株能够通过胺氧化酶活性催化降解生物胺生成醛类[43]。Martuscelli等[44]在木糖葡萄球菌中发现了可降解组胺和酪胺的氧化酶。Mah 等[45]在日本鳀鱼腌制时添加木糖葡萄球菌0538 作为发酵剂,能明显减少产品中的生物胺含量,组胺含量降低最为显著。而Zaman等[46]用从鱼露中分离得到的葡萄球菌FS19 也同样具有胺氧化酶活性,作为发酵剂进行酱油发酵后,产品中组胺、腐胺、尸胺和酪胺的含量明显降低。Mainar 等[29]以植物乳杆菌和木糖葡萄球菌作为微生物发酵剂进行酸鱼发酵也有效降低了酸鱼中腐胺和尸胺的含量,而加入啤酒酵母混合发酵剂则可以降低酸鱼中酪胺的含量。除了胺氧化酶的作用外,研究人员对鱼露中分离的尼泊尔葡萄球菌(S.nepalensis)5-5 进行降生物胺机制的研究发现,该菌株能够通过调节氨基酸代谢途径,阻断组氨酸脱羧过程,使转化为生物胺之外的其它代谢产物[47]。
1.4 CNS 对有害菌的抑制
研究人员发现发酵肉、鱼制品生产中接种CNS 能有效抑制金黄色葡萄球菌、李斯特菌(Listeria)、大肠杆菌(Escherichia coli)、肉毒梭菌(Clostridium botulinum)等食源性致病菌滋生[24,48]。CNS 主要通过产细菌素和抑制有害菌形成生物膜来实现抑菌。
细菌素因其安全性良好而被认为是抗生素和化学食品添加剂的首选替代品[49]。Sung 等[50]报道了人型葡萄球菌(S.hominis)MBBL 29 产生了一种与传统抗生素相似的具有独特分子结构和高抗菌活性的细菌素,对金黄色葡萄球菌有良好的拮抗作用。Kanjan 等[41]对Budu 鱼中分离的模拟葡萄球菌PMRS35 进行琼脂斑点法测定,从中发现了对蛋白酶具有抗性的细菌素,该细菌素对多种致病菌特别是金黄色葡萄球菌TISTR 具有较强的抗菌活性。由表2 可见,CNS 细菌素具有多个种类,抗菌谱包括多种革兰氏阴性和阳性的食源性致病菌。除了直接检出细菌素,一些研究通过测定CNS中产细菌素基因的存在,来评估CNS 分泌细菌素的能力。例如:Brito 等[51]在巴西健康奶牛群中分离的17 株CNS 中检测出了对李斯特菌和金黄色葡萄球菌Newbould 305 有抑制作用的a70/a53 细菌素基因。与传统的抗生素相比,细菌素通常对真核细胞无毒害作用,且能被消化酶作用失活,对肠道微生物影响较小,因此被视作安全的抗菌剂[52]。

表2 发酵食品中产细菌素的CNS 及其抑菌作用Table 2 Pathogen inhibition and bacteriocin production of CNS isolated from fermented food
有害菌的致病性与其生物膜形成能力呈正相关。CNS 则可以通过生产抑制肽及各种酶等抑制因子来抑制有害菌生物膜的形成。赖健昆[53]发现CNS 产生的RNAIII 抑制肽(RIP)能干扰群体感应系统,影响有害菌的黏附性及早期生物膜的形成。木糖葡萄球菌培养上清液中分离的RNAIII 抑制肽则可以抑制多种金黄色葡萄球菌菌株。Iwase等[54]发现表皮葡萄球菌中含有一种抑制金黄色葡萄球菌生物膜形成的因子——丝氨酸蛋白酶Esp23,该因子不仅可以抑制金黄色葡萄球菌生物膜的形成,还能破坏预先存在的金黄色葡萄球菌生物膜。
另外,研究发现有害菌生物膜形成可能受多种抑制机制共同作用。例如:Goetz 等[55]观察到具有弱生物膜表型的产色葡萄球菌(S.chromogens)和模仿葡萄球菌分离株能够抑制其它葡萄球菌分离株形成生物膜。其抑制作用不仅仅依赖于抑制因子的积累,弱生物膜表型菌株的存在也会使强生物膜表型葡萄球菌菌株(包括金黄色葡萄球菌)无法形成厚而坚固的生物膜层,从而对其起到抑菌作用。
1.5 适宜工业生产的特性
作为传统自然发酵香肠、发酵肉质品种的优势土著菌株,CNS 菌株具备良好的环境适应性,参与生产时能适应高盐、低pH 等不良环境并且保持自身活性。Kanjan 等[41]发现葡萄球菌菌株PMRS35 可以在高盐环境下保持良好的产酶性能,高效降解脂肪和蛋白质。而Casaburi 等[9]分离的模拟葡萄球菌在不同温度、pH 和NaCl 浓度下,都保持了良好的硝酸盐还原酶、蛋白水解、脂解、脱羧酶和抗氧化活性以及生长能力。CNS 良好的环境适应能力使其在发酵菌群中能够迅速成为优势菌,从而抑制有害菌的生长。例如:鲢鱼香肠生产中接种含有木糖葡萄球菌的混合发酵剂后,pH迅速下降,发酵剂中的菌株迅速增殖,从而抑制了一些肠道细菌、假单胞菌、酵母菌和霉菌的生长[61]。Xiao 等[13]发现木糖葡萄球菌接种到中式发酵香肠后,能够迅速成为发酵生境中的优势菌,进而抑制其它杂菌的生长。
2 CNS 应用于发酵食品生产存在的潜在风险
CNS 的非致病性是其应用于食品生产的前提,然而因其与CPS 中的金黄色葡萄球菌、中间葡萄球菌等致病菌具有相近的亲缘关系、相似的遗传背景,其作为发酵剂应用于工业化发酵食品的生产仍然令许多学者担忧。一些CNS 菌株在高浓度下存在的产毒素风险、生物胺积累和抗生素抗性基因污染等潜在安全隐患,这些潜在风险在发酵菌株筛选中都需要重点关注[39,62]。
2.1 产毒素基因的威胁
葡萄球菌产生的毒素通常是指肠毒素、中毒性休克综合征毒素和细胞毒素。涉及产毒素的葡萄球菌主要是以金黄色葡萄球菌为代表的CPS,而不是CNS。然而,一些研究发现用于食品发酵的某些CNS 也具备产肠毒素潜力[43]。研究人员从利比里亚火腿、绵羊奶、山羊奶和奶酪中均发现了少数产肠毒素的CNS[62]。Nunes 等[63]从巴西新鲜奶酪Minas Frescal 中分离出了能够生产具有超抗原活性且耐热肠毒素的CNS,包括木糖葡萄球菌、松鼠葡萄球菌(S.sciuri)和鱼发酵葡萄球菌(S.piscifermentans)。
基因水平研究表明,CNS 和CPS 同样具有编码肠毒素的基因。研究者从即食发酵肉制品分离的肉葡萄球菌、琥珀葡萄球菌等CNS 均携带金黄色葡萄球菌肠毒素基因[64]。Rall 等[65]从Minas 软干酪中分离出的CNS 菌株中,17 株来自腐生葡萄球菌、华氏葡萄球菌(S.Fahrenheit)、表皮葡萄球菌、木糖葡萄球菌、施莱弗氏葡萄球菌(S.schleifer)、头状葡萄球菌(S.capitis)的CNS 菌株均携带肠毒素基因,占总分离菌株数的26.2%,其中sea 肠毒素基因检出率最高,其次是sec 和seb。除肠毒素外,Rosenstein 等[66]发现肉葡萄球菌TM300 的多种基因表达产物与金黄色葡萄球菌的毒力因子蛋白具有相似性,其安全性需要被进一步关注。此外,毒素基因的水平转移也是威胁其生产安全因素之一。Tulinski 等[67]对10 个养猪场的肉食品原材料进行检测,发现金黄色葡萄球菌能够与表皮葡萄球菌共享携带mec 基因的葡萄球菌盒式染色体(Staphyloccoccal cassette chromosome mec,SCCmec)[68],通过重组和重排,SCCmec 可以在不同CNS 种间交换转移。因此,CNS 产毒素相关基因携带情况及其是否在发酵动物性食品生产中表达值得进一步研究。
2.2 生物胺积累的风险
存在氨基酸脱羧酶活性的CNS 用于发酵食品生产可能引起生物胺的积累[62]。Anderegg 等[69]发现瑞士发酵香肠中木糖葡萄球菌是主要的酪胺生产者。Poveda 等[70]从散装罐母羊奶样本中分离出的表皮葡萄球菌、模仿葡萄球菌等CNS 均可引起生物胺的积累,最容易积累的是腐胺,其次是2-苯乙胺和酪胺。Harada 等[71]发现Sakana 味噌发酵鱼酱中的表皮葡萄球菌是组胺积累的贡献者。
通常认为CNS 产生物胺与其携带编码氨基酸脱羧酶基因有关,该基因的表达促使发酵基质中的氨基酸脱羧从而生成生物胺。例如:刘蕾等[72]从发酵肉制品中共分离得到43 株产生物胺CNS菌株,其中产生物胺能力较强的7 株表皮葡萄球菌均携带赖氨酸脱羧酶基因(ldc)和组氨酸脱羧酶基因(hdc),部分菌株中检测到色氨酸脱羧酶基因(tdc)。Anderegg 等[69]发现瑞士发酵香肠中的木糖葡萄球菌可能携带酪氨酸脱羧酶基因。当CNS细胞处于稳定状态时,容易积累生物胺,且生成生物胺的基因也更可能发生水平转移[73]。然而,许多CNS 菌株在产生物胺特性上存在基因型和表型的不一致。Seitter 等[74]检测的32 株CNS 中均携带编码氨基酸脱羧酶的基因,除肉葡萄球菌外,其余菌种的表型与基因型均不一致,许多CNS 可以产生2-苯乙胺和色胺,然而菌株中无法找到相应的基因。Heo 等[5]发现一些CNS 分离株在基因检测时未发现产生物胺相关编码基因,然而在实验室培养过程中却能产生尸胺、腐胺和酪胺[75]。
此外,CNS 产生物胺的能力还与发酵环境有关。Harada 等[71]发现有机酸对表皮葡萄球菌在鱼酱中的组胺积累有抑制作用;Sang 等[76]研究虾酱中生物胺含量的变化时发现,CNS 产生物胺能力受发酵环境中盐含量的影响,适度增加盐度可降低生物胺含量;Van der Veken 等[77]发现,延长肉制品发酵时间能够促使腐生葡萄球菌等CNS 积累更高浓度的生物胺,其中,尸胺含量在发酵结束7 d 后停止增加,而腐胺则会持续上升。这些现象表明,生产中通过控制发酵条件能够在一定程度上减少CNS 对生物胺的积累。
2.3 抗生素抗性基因污染风险
几十年来,细菌的抗生素耐药性研究主要集中在一些重要的临床菌种上,然而,近年来的研究发现抗生素耐药性细菌广泛存在于土壤、水、食物和胃肠道等各种生态系统[78],其带来的直接公共卫生问题是抗生素治疗效率的降低,同时,抗生素抗性基因(Antibiotic Resistant Genes,ARGs)已成为一种新型环境污染物,其污染分布广泛且危害持久。食品发酵生产中,是否携带ARGs 已经成为评估发酵菌株安全性的重要指标。CNS 同属的金黄色葡萄球菌多重耐药问题已成为公认的医学棘手问题,而细菌携带的ARGs 可能通过水平转移传播给其它共生或致病细菌[79]。发酵食品中的CNS 也屡有抗生素耐药性检出的报道。例如,Kastner 等[80]发现用作发酵剂的木糖葡萄球菌分离株均携带四环素耐药相关的tet(K)基因。Fijałkowski 等[64]从意大利腊肠中分离出的肉葡萄球菌和木糖葡萄球菌中,有69%的菌株对甲氧西林及大环内酯、林可酰胺、链霉素B 类(MLSB)具有耐药性。
食物链是抗生素耐药基因在动物之间扩散的主要途径之一[81]。López 等[82]发现发酵香肠的生产链中,ARGs 可能通过食物链在农场中的土著微生物之间传播,最终可能进入香肠产品。这些耐药基因可能通过食物链进入人体,从而对人类健康造成威胁。Lozano 等[83]在从奶酪、腌制肉类、腊肠、熏鱼等即食食品中分离的58 株CNS 中均检测到了Tn916-Tn1545 接合转座子,携带这类接合转座子的菌株对头孢西丁、克林霉素、替加环素、利福平和红霉素均有耐药性。菌株安全性评估过程中,当CNS 中携带耐药基因的质粒数量较低时,传统的PCR 检测方法可能无法检出。此外,多种耐药基因可能会通过基因盒的形式同时存在于细菌中[84],因此,针对应用于食品生产的CNS,需要全面评估其抗生素耐药基因携带情况。
3 结语
与乳酸菌和酵母菌等成熟的商业化发酵剂菌种相比,CNS 在工业化发酵食品生产中的应用并不广泛,相应的商业化发酵剂较为有限。CNS 在动物性食品发酵方面,拥有改善风味、着色,降低生物胺,抑制有害菌等良好的生产特性,具备耐低pH 和高盐胁迫环境的特性,在动物性发酵食品工业化生产中有潜在的应用前景。目前,学者们对CNS 在发酵食品中的积极作用已广为认同。此外,对于CNS 的潜在风险也应理性看待,虽然目前没有强有力的研究表明其应用会给食品产业带来突出威胁,但人们对于CNS 应用过程中的产毒素、积累生物胺以及抗生素基因污染的风险仍然有所担忧。研究人员发现了部分CNS 在动物性食品中不容忽视的产毒素能力,并且已经通过基因来确定产毒素的机制[85],而CNS 产毒素基因的总体分布以及其产毒素能力尚待研究[67,86]。在产生物胺方面,CNS 菌株间在基因型和表型上均存在较大差异,且部分菌株基因型和表型的不一致仍需重视[26]。在抗生素抗性基因污染方面,虽然目前应用于食品生产的大部分菌株的抗性基因都未使食品本身产生安全问题,但对其存在的安全隐患和基因转移机制需要继续关注。
作为人为添加的外源性发酵剂,CNS 的安全性需要借助多种技术进行系统而全面的评估,随着组学测序技术成本的下降,在CNS 生产发酵菌株遴选中,可以结合基因组、转录组、代谢组多组学测序分析,系统而全面地评估CNS 菌株的生产优势和安全劣势[87-89]。此外,在商业化发酵剂的开发中,菌株遴选和发酵剂的复配也需要基于大量实践研究,菌株间代谢特性存在较大差异,一些菌株具有良好的蛋白酶或氨基酸转化酶活性,然而其对脂肪β-氧化能力可能差强人意,而具有较好的降生物胺能力的菌株可能对着色没有太大的帮助,通过发酵剂的复配可以扬长补短,同时发挥不同菌株的优势。此外,介于发酵基质本身的营养成分亦存在较大差异,针对不同发酵底物开发适宜的发酵剂,需要对发酵剂微生物组成、微生物代谢对食品基质的影响进行系统而全面的研究。

