基于链置换扩增的电化学适配体生物传感器检测食品中的赭曲霉毒素A
刘 伟,张蕴哲,杨 倩,范少华,田益玲,张 伟,4,5*
(1 河北农业大学食品科技学院 河北保定071000 2 河北大学公共卫生学院 河北保定071000 3 河北软件职业技术学院 河北保定071000 4 河北农业大学生命科学学院 河北保定071000 5 河北省人畜共患病原微生物分析与防控重点实验室 河北保定 071000)
赭曲霉毒素A(Ochratoxin A,OTA)主要是由曲霉属和青霉属产生的次级代谢产物,常见于咖啡、小麦粉、葡萄酒、乳制品和水果等日常食品和食品原材料中[1-3]。OTA 理化性质较稳定,不易清除,对人类的肾、肝和脑等重要器官具有强烈毒性[4-5]。国际癌症研究机构(International agency for research on cancer,IARC)于1993 年将OTA归类为可能的人类致癌物2B 组[6]。
传统检测OTA 的方法包括:高效液相色谱法(High performance liquid chromatography,HPLC)[7]、气相色谱与质谱联用(Gas chromatography-mass spectrometry,GC-MS)[8]和薄层色谱(Thin-layer chromatography,TLC)[9]等色谱方法。其中高效液相色谱法具有高灵敏度,是检测OTA 的主要方法之一。然而,其存在耗时长,设备昂贵,需要专业人员和大量试剂[10]等不足。传统的酶联免疫分析方法(Enzyme linked immunosorbent assay,ELISA)具有检测时间较短的优点,然而其存在检出限较高,所需抗原抗体合成价格昂贵,试剂需要冷藏保存,不适宜运输[11]等不足。而生物传感器作为一种成本低廉的快速检测手段,有望完善这些缺点[12]。
在OTA 特异性识别方面,传统方法将抗体作为分子识别工具[13],在食品分析中发挥至关重要的作用。这些基于蛋白质的抗体通常在动物体内产生,导致其相对复杂的生产过程和昂贵的价格[14]。相比之下核酸适配体的获取比传统抗体更方便[15],显示出许多优点,例如批次间变异低,免疫原性低,易用纳米材料或有机染料分子进行修饰等[16-17]。人们开始将核酸适配体作为识别分子来替代抗体的作用[18]。近些年,链置换扩增(Strand displacement amplification,SDA)技术成为研究热点,SDA 不需要精确控制温度,可以与各种信号分子结合,增加其使用范围[1]。同时电化学生物传感器技术是公认的应用范围广、成本低的生物传感器,其原理是通过生物识别元件与电化学换能器之间的结合,通过电分析技术进行最终的信号响应和测量[19-20]。电化学生物传感器除了表现出生物传感器本身固有的高特异性外,还结合了电分析技术的高灵敏度和低检出限的优点[21]。其样品制备简单,可以进行现场快速检测[22]。
目前,关于应用链置换扩增技术与电化学适配体传感器进行OTA 定量检测鲜见报道。本文利用OTA 适配体的高特异性和链置换扩增技术的宽线性检测范围,以及电化学生物传感器技术的信号输出反应灵敏等优点,将它们相结合,拟建立一种基于电化学适配体传感器的定量检测OTA的新方法。
1 材料与方法
1.1 材料与试剂
赭曲霉毒素A、赭曲霉毒素B(Ochratoxin B,OTB)、黄曲霉毒素B1(Aflatoxin B1,AFB1)、玉米赤霉烯酮(Zearalenone,ZEN)、伏马毒素B1(Fumonisin B1,FB1),普瑞邦生物工程有限公司提供。
Nb.BsrDI 切刻内切酶、Bst DNA 聚合酶,NEB(北京)有限公司;MgSO4,宝生物工程(大连)有限公司;氯金酸,源叶生物有限公司;铁氰化钾、亚铁氰化钾,天津市光复科技发展有限公司;巯基乙醇(MCH),上海麦克林生化科技有限公司;三-膦盐酸盐(TCEP),合肥博美生物科技有限公司;氧化铝抛光粉、玻碳电极(GCE)、铂丝电极、Ag/AgCl 参比电极,武汉科斯特仪器股份有限公司;过硫酸铵溶液(AP),北京雷根生物技术有限公司;甲醇(分析纯),国药集团化学试剂有限公司
1.2 仪器与设备
场发射扫描电镜(TESCAN MIRA LMS),泰思肯(中国)有限公司;CS350H 电化学工作站,武汉科思特仪器股份有限公司;凝胶成像仪(BINDA 2020D)北京君意东方电泳设备有限公司;Step One Plus 荧光定量PCR 仪,新加坡生命科技控股有限公司。
1.3 试验方法
1.3.1 试验原理 SDA 的电化学适配体生物传感器的检测原理见图1。首先利用OTA 适配体对OTA 进行特异性识别,形成反平行G-四链体结构[23],触发SDA 反应产生大量目标产物(图1a)。通过Au-S 键将发夹探针修饰在金电极表面,加入MCH 封闭电极表面活性位点,实现电化学探针的垂直定向,使二茂铁(Fc)靠近电极表面[24],此时电流峰值为I0。电极与SDA 产物DNA 反应后,探针颈部被打开,Fc 与电极表面距离发生改变,此时电流峰值为I(图1b)。通过计算得出产物DNA的反应生成浓度,即ΔI%=(I0-I)/I0。
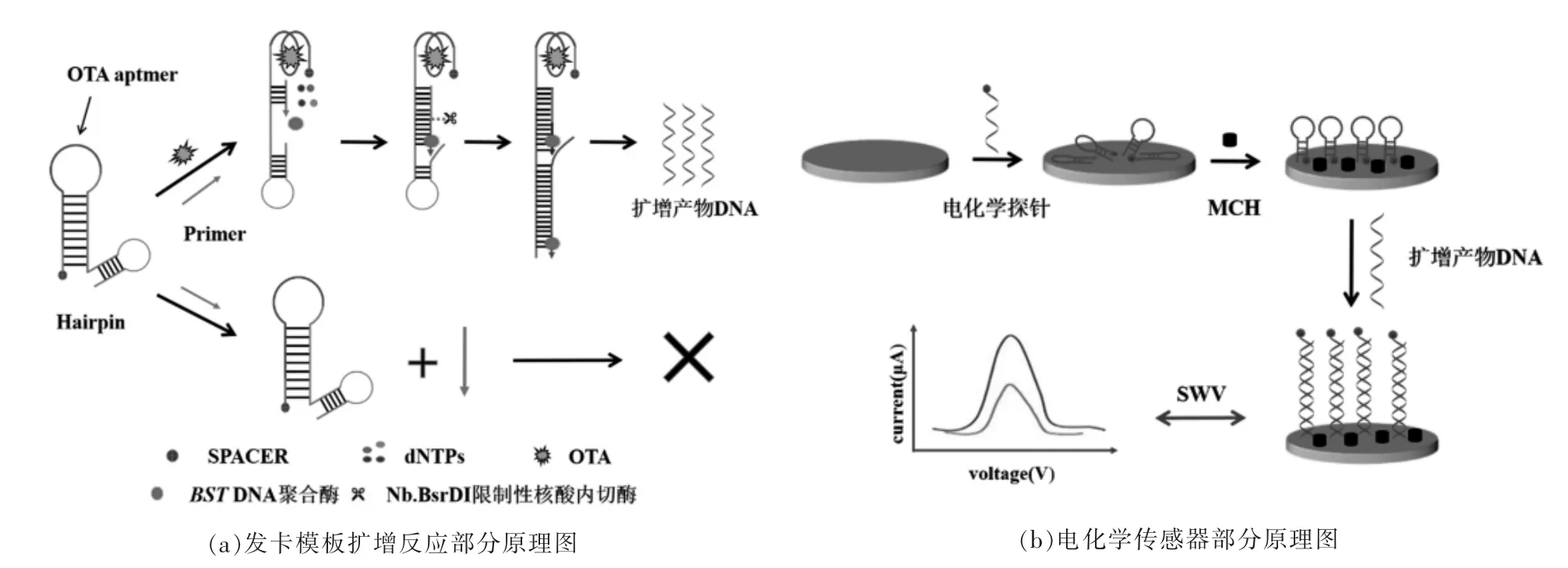
图1 本研究检测原理图Fig.1 Schematic diagram of the detection principle in this study
1.3.2 发卡、引物与电化学探针设计 通过NUPACK 设计发卡、引物与电化学探针,其核酸序列见表1。发卡模板由Wang 等[25]筛选出的OTA 适配体序列、Nb.BsrDI 内切酶识别序列以及电化学探针互补序列组成,发卡模板序列的3′端修饰spacer。由于Nb.BsrDI 内切酶的识别序列为5′-NNCATTGC-3′(N 代表任意G、A、T、C 碱基),因此本试验在发卡模板中设计的序列为该识别序列的反向互补序列5′-GCAATGNN-3′。
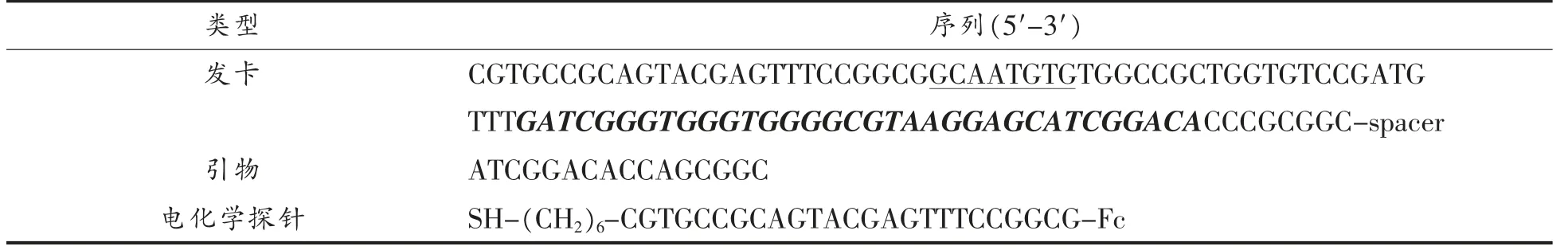
表1 试验所用核酸序列Table 1 The nucleic acid sequences used in this study
1.3.3 电化学适配体传感器的方法的建立
1)孵育过程 先将发卡模板在95 ℃条件下预变性5 min。将不同浓度的1.0 μL OTA 与1.0 μL 发卡(10 μmol/L)、1.0 μL 引物(10 μmol/L)、1.0 μL dNTPs(10 mmol/L)、2.0 μL Bst DNA 聚合酶缓冲液(10×)和2.0 μL Cutsmart 缓冲液(10×)混匀,加入蒸馏水(ddH2O),体系共16 μL,在37 ℃下避光孵育30 min。
2)扩增过程 在孵育后的体系中加入2.0 μL Bst DNA 聚合酶(8 U/μL)、2.0 μL Nb.BsrDI内切酶(10 U/μL),终体系为20 μL。振荡混匀后65 ℃条件下反应30 min。
3)电化学反应过程 将试验所用玻碳电极用粒径分别为1.0,0.3,0.05 μm 的Al2O3粉末抛光,再用乙醇和超纯水去除残留的Al2O3粉末。在1%AuNPs 溶液中采用恒电位极化,得到AuNPs 修饰的电极。
将电化学探针用10 mmol/L 的TCEP 稀释至100 μmol/L,于37 ℃避光还原1 h。再将电化学探针稀释至6 μmol/L,取10 μL 滴加在电极表面,37℃避光孵育4 h。将修饰好的电极浸入10 mmol/L Tris 缓冲液中浸泡30 min。浸入2 mmol/L MCH 中处理30 min 后通过方波伏安法(SWV)测量其初始电信号强度。
将测量初始信号后的电极于37 ℃浸泡在含有扩增产物的离心管中80 min,清洗晾干后,通过SWV 方法测量其电信号强度。
1.3.4 聚丙烯酰胺凝胶电泳验证 将DNA 扩增产物与DNA 上样缓冲液(体积比4∶1)混合后,每个样品加入新制备的20%聚丙烯酰胺凝胶(Poly acrylamide gel electrophoresis,PAGE)中[26-27]。在1×TBE 缓冲液(pH 8.0)中,电压120 V 条件下电泳60 min。最终将凝胶在染色液中染色60 min,使用凝胶成像仪成像。
1.3.5 方波伏安法检测验证 为验证本试验开发的电化学适配体传感器的可行性,分别设计阳性对照和空白对照试验。分别浸泡在测试液中通过SWV 方法测量电信号强度,以评估该传感器的可行性。
1.3.6 电化学表征 将未修饰的裸电极(玻碳电极)和修饰上AuNps 的金电极用SEM 方法观察。通过CV 和EIS 电化学表征方法表征。
1.3.7 电化学适配体传感器的灵敏度和检出限 各取1 μL 的不同浓度的OTA 进行电化学信号检测,得到的电流变化值ΔI(%)数据。以不同浓度的OTA 浓度和电流变化值ΔI(%)为横、纵坐标绘制曲线,得到线性回归方程,确定灵敏度与检测限。
1.3.8 电化学适配体传感器的特异性、重复性和稳定性 为了验证本试验的特异性,选取OTB、FB1、AFB1、ZEN 为对比毒素。在最适反应条件下,将1 ng/mL OTA 扩增体系与质量浓度均为1 ng/mL 的参考毒素(OTB、FB1、AFB1、ZEN)、混合组1(含OTA、OTB、FB1、AFB1、ZEN,质量浓度均为1 ng/mL)、混合组2(含OTB、FB1、AFB1、ZEN,质量浓度均为1 ng/mL)和空白对照共8 组进行特异性验证。
本试验同时用8 根电极在相同条件下对于同一质量浓度(1 ng/mL)的OTA 毒素进行检测,验证该方法的重复性。
此外,为研究本方法的稳定性,将数根修饰电化学探针的电极存放于4 ℃条件储存2 周来评估该传感器的稳定性,分别在第1,2,3,5,7,14 天取出与相同扩增产物反应后,进行SWV 方法测量,得到的信号值与初始信号值进行对比分析,以验证该方法的稳定性。
1.3.9 人工加标试验 在小麦粉原材料、咖啡和红酒等食品中进行人工污染检测。为了验证检测结果的准确性,同时使用本方法和商业ELISA 试剂盒方法的检测结果进行对比。
将小麦和咖啡固体样品用粉碎机粉碎后过20 目的筛。称取小麦粉样品5.0 g、咖啡粉样品2.5 g,分别加入25 mL 60%甲醇溶液,剧烈振荡5 min,4 000 r/min 离心10 min。取上清液,采用孔径0.22 μm 的针头式过滤器过滤,向滤液中加入不同浓度的OTA 标准品。取红酒样品1 mL,加入4 mL蒸馏水,再加入不同浓度的OTA 标准品。将处理完毕的样品同时用电化学适配体传感器和商业ELISA 试剂盒检测。
2 结果与分析
2.1 试验可行性验证
聚丙烯酰胺凝胶电泳(PAGE)结果如图2a 所示,在泳道1 中,没有OTA 存在的情况下,在70~80 bp 处产生明亮条带,表明发卡结构未打开,无法产生后续反应,在20 bp 处未发现目标长度条带。泳道2 中,存在OTA 的情况下,发卡结构打开,引物与发卡模板结合并进行扩增,在接近20 bp 处发现目标长度条带,表明反应正常发生。这些结果证实基于发卡结构的用于检测OTA 的SDA 扩增反应成功构建。
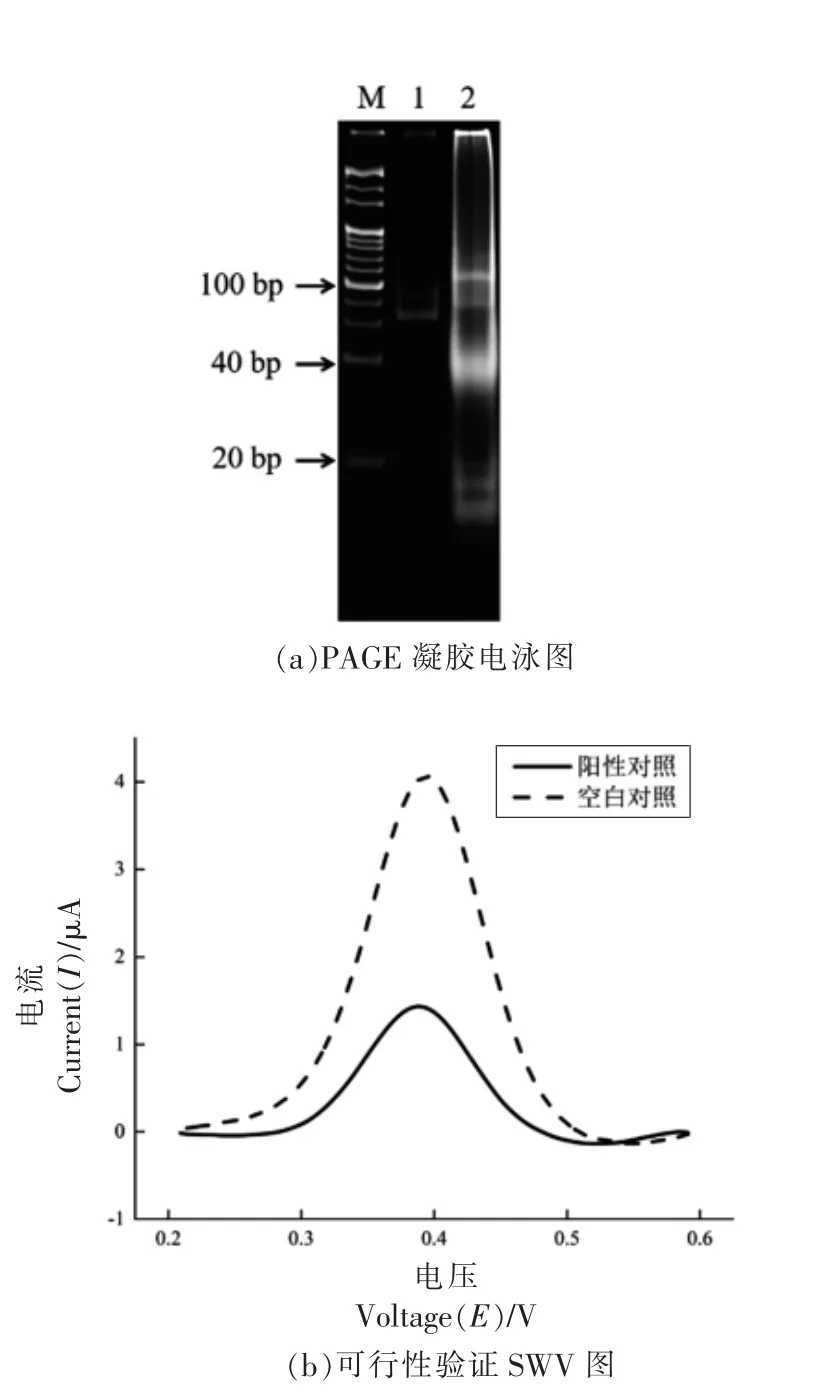
图2 可行性分析图Fig.2 Feasibility analysis diagram
SWV 分析结果如图2b 所示,当电化学探针修饰到电极表面时,可以在0.2~0.6 V 点位区间内观察到二茂铁(Fc)的电信号。当溶液中不存在OTA 时,Fc 信号电流值(曲线a)依旧可以保持较强的电信号。当溶液中存在OTA 时,电极上修饰的Fc 与电极表面的距离变大,使Fc 信号电流值(曲线b)变小。由可行性试验结果可知,所建立的电化学传感器可用于检测OTA。
2.2 修饰电极的表征
2.2.1 修饰电极的扫描电镜表征分析 用扫描电镜观察玻碳电极和镀金电极的表面,结果如图3a所示。改性前,在玻碳电极上未观察到杂质,为后续的AuNPs 修饰提供了良好的条件。在玻碳电极上电沉积金后,由图3b 可知,玻碳电极表面形成一层均匀的AuNPs,表明玻碳电极与AuNPs 成功结合,与文献[28]报道一致。

图3 电极表征扫描电镜图Fig.3 SEM of electrode characterization of electrode characterization
2.2.2 修饰电极的电化学表征 通过EIS 和CV对修饰电极进行电化学表征,结果如图4 所示。图4a 为CV 图,由于AuNPs 导电性较强,修饰AuNPs 电极的氧化-还原峰值(曲线a)较玻碳电极的氧化-还原峰值(曲线b)有明显的上升。固定电化学探针后,电极的氧化-还原峰值(曲线c)降低,表明电化学探针成功固定在电极表面[29]。将电极用MCH 浸泡,电极的氧化-还原峰值(曲线d)降低,表明MCH 成功封闭电极。最后,将电极浸泡在扩增反应液后,观察到氧化-还原峰值(曲线e)降低,表明电极表面的电化学探针与扩增反应所产生的单链产物发生DNA 互补杂交。
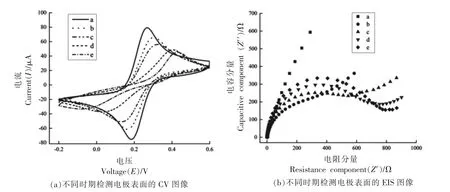
图4 电化学传感器的CV(a)和EIS(b)图Fig.4 CV(a)and EIS(b)diagrams of the electrochemical sensor
电化学阻抗谱通常用于研究不同物质对电极表面的修饰[30]。EIS 曲线中,半圆半径与法拉第反应电荷转移阻抗(Rct)相关[31]。图4b 为EIS 图,金电极几乎呈直线(曲线a),与裸电极的半径(曲线b)相比,有较快的电子转移率,电阻率更低,表明AuNPs 成功修饰。当电化学探针固定在电极上时,观察到曲线半径增大(曲线c),Rct 值增加,表明电化学探针成功修饰。随后,电极表面被MCH 钝化,曲线半径进一步增大(曲线d),Rct 值增加。将电极与扩增产物单链DNA 反应后,单链DNA 与分子开关的环区完全互补,曲线半径(曲线e)达到最大值,Rct 值增大,EIS 结果与CV 结果保持一致,表明本研究中传感器被成功构建。
2.3 电化学适配体传感器灵敏度和检出限
在最优条件下,通过SDA 扩增反应,将所制备的电化学生物传感器用于检测不同浓度的OTA。如图5a 所示,用该方法检测不同浓度OTA后所对应的不同电流信号I,随着OTA 浓度不断增大,SWV 检测的电流值不断减小。结果表明,随着SDA 扩增产物单链DNA 的不断增加,与其结合的电化学探针不断增加,电流值不断降低,呈良好的线性关系。
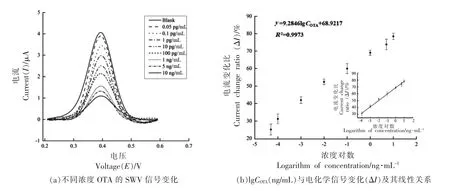
图5 基于链置换扩增的电化学生物传感器的检测性能Fig.5 The detection performance of an electrochemical biosensor based on strand displacement amplification
如图5b 所示,ΔI(%)随OTA 质量浓度(0.05 pg/mL~10 ng/mL)的增加而增加,电流峰值的变化量ΔI(%)与OTA 浓度的对数在0.1 pg/mL~10 ng/mL 范围内保持良好的线性关系,相关系数R2=0.997,线性回归方程为y=9.2846lgCOTA+68.9217。OTA 电化学适配体传感器方法的检测限为0.05 pg/mL,综上表明本研究的方法可用于定量检测OTA。
2.4 传感器特异性
电化学适配体生物传感器的特异性结果如图6 所示。图6a 为该试验特异性的PAGE 结果,胶图中显示的OTA 和混合组A 产生扩增反应,而OTB、AFB1、FB1、ZEN 和混合组B 的条带与空白对照结果相同,表明该电化学适配体传感器的特异性良好。图6b 为电流变化比(ΔI)的结果,OTB、AFB1、FB1、ZEN 和混合组B 的ΔI(%)几乎与空白对照的ΔI(%)相同,而OTA 与混合组A 的ΔI(%)基本处于较高水平。证实了电化学生物传感器的特异性良好,混合类样品对传感器的影响较低,在区分OTA 与其它毒素方面表现出高特异性。
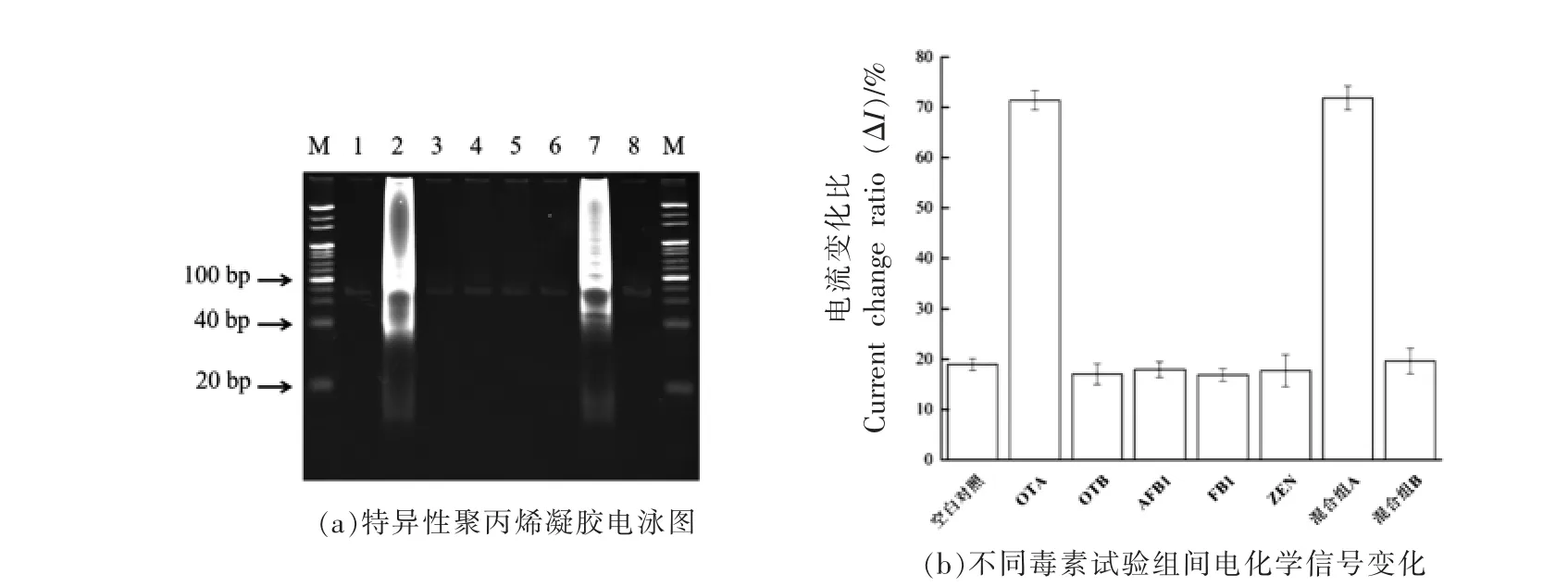
图6 基于链置换扩增的电化学适配体传感器的特异性检测Fig.6 Specificity detection of electrochemical biosensor based on strand displacement amplification
2.5 传感器重复性及稳定性
验证该电化学适配体传感器的重复性和稳定性结果如图7 所示。图7a 表示该方法的重复性结果,在相同试验操作下,本试验的ΔI(%)的RSD为2.63,表明本方法具有良好的重复性。图7b 表示该方法的稳定性,第14 天的ΔI(%)仍达到其初始值(91.51%),反应后的电极经14 d 保存,其结果准确率仍保持在90%以上,表明电化学适配体传感器具有高稳定性。

图7 基于链置换扩增的电化学适配体传感器的重复性和稳定性检测Fig.7 Repeatability detection of electrochemical aptamer sensor based on strand displacement amplification
2.6 方法的回收率
为了研究电化学适配体传感器检测实际样品的能力,用小麦粉、咖啡和红酒样品进行回收率测定。在不同处理后的食品样品中加入终质量浓度为5 ng/mL 和10 ng/mL 的OTA 标准品,进行电化学适配体传感器和ELISA 检测,结果见表2。电化学适配体传感器的加标回收率在96.60%~99.04%之间,RSD 低于5%,而商业ELISA 试剂盒的加标回收率在94.00%~98.50%之间。表明本试验开发的电化学适配体传感器具有实际检测食品中OTA的能力,相较于ELISA 方法具有更高的准确性。
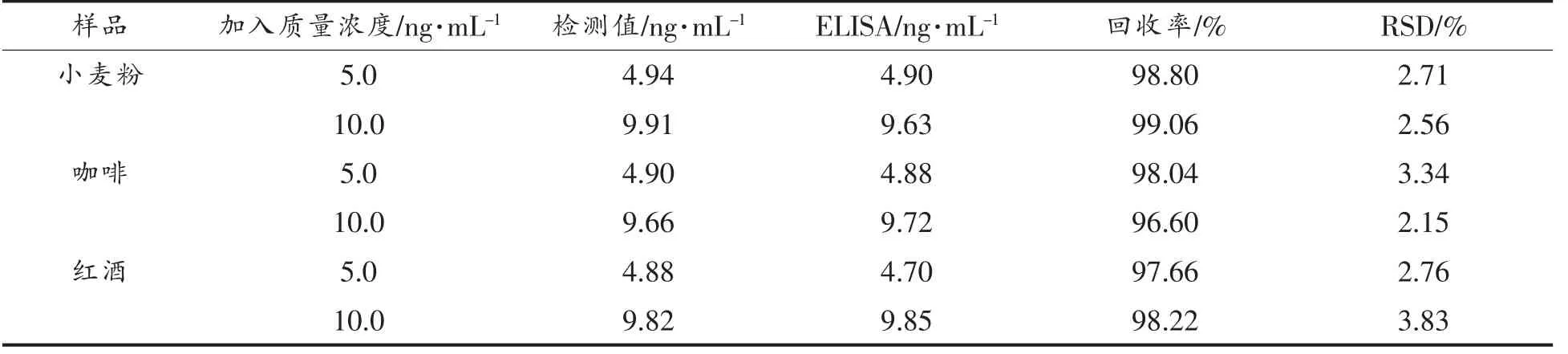
表2 人工加标食品样品中OTA 含量检测及与ELISA 方法比较Table 2 The content of OTA in artificially labeled food samples was detected and compared with ELISA
3 结论
1)构建了一种快速检测食品中OTA 的电化学生物传感器,通过电信号快速响应,准确灵敏。
2)开发的电化学适配体传感器,实现了0.1 pg/mL~10 ng/mL 的线性检测范围,检出限为0.05 pg/mL,低于国家标准(GB 5009.96-2016)。与其它检测OTA 的生物传感器方法[32-34]相比,本试验具有良好的线性检出范围及检出限。
3)特异性试验中,2 组含有OTA 的试验组呈阳性,6 组不含有OTA 的试验组呈阴性,表明该方法具有较强的特异性。本试验的重复性RSD 为2.63%,稳定性结果:在14 d 内信号保持率为91.55%。
4)人工加标回收率检测中,该电化学适配体传感器的检测回收率为96.60%~99.04%,ELISA的加标回收率为94.00%~98.50%,表明该方法具有现场快速、准确检测食品中OTA 毒素的能力,实用性较高。

