剪接因子3B亚单位1在乳腺癌组织中的表达及与患者临床病理特征关系
陈丽丽,施民新,薛丽娟
(南通市肿瘤医院 南通大学附属肿瘤医院,江苏 南通 226000)
乳腺癌作为女性中最普遍的恶性肿瘤类型,其患病率持续占据高位并呈现上升的趋势[1]。由于乳腺癌的发生与分子层面的调控异常密切相关,导致患者展现出多样化的临床病理特征,因此,深入解析乳腺癌的分子病理机制及其与临床表型之间的联系,已成为医学研究的关键课题[2-3]。在细胞生物学中,剪接体是由与蛋白质相互作用的小RNA构成的复合体,负责精确移除真核生物前体mRNA的内含子[4]。若RNA剪接过程发生异常,可能触发多种病理状态。随着基因组测序技术的进步,对癌症患者基因组的深入分析揭示了RNA剪接异常与多种肿瘤的发生、发展之间的潜在联系[5]。作为U2小分子核糖核蛋白复合体的关键组成部分,剪接因子3B(Splicing factor 3B,SF3B)在U2小分子核糖核蛋白的组装及分支点序列的稳定结合上发挥着至关重要的作用[6]。特别是剪接因子3B亚单位1(Splicing factor 3B subunit 1,SF3B1)其在剪接体与前体mRNA的锚定过程中起着核心作用,研究发现其是变异频率极高的基因之一,已报道的变异频率介于66.7%~79%之间[7]。本研究旨在深入探究SF3B1在乳腺癌患者肿瘤组织中的表达趋势,并探讨其表达与乳腺癌患者临床病理特征之间的潜在联系。
1 资料与方法
1.1 一般资料 本研究纳入了在2020年11月至2022年11月期间于本院进行手术治疗的88例乳腺癌病例作为研究样本。病例纳入标准:①初发、原发的乳腺癌患者,并且经过病理学检查结果确诊为乳腺浸润导管癌;②有手术指征,初次接受乳腺手术者;③术前未接受其他治疗如放疗、化疗、激素疗法及生物治疗等。排除标准:①有其他重大合并症;②病例数据资料缺失者。88例患者均为女性,年龄31~73岁,平均(53.17±4.05)岁;分化程度为高分化67例,中分化15例,低分化6例;淋巴结转移14例;未绝经45例,已绝经43例。
1.2 研究方法 将手术采集到的组织样本立即于-80 ℃冷冻保存,采用RIPA缓冲液对组织样本进行匀浆处理,提取总蛋白后,采用BCA蛋白测定法测定蛋白浓度。根据蛋白浓度,加载等量蛋白至SDS-PAGE凝胶中,使用恒电流模式进行电泳分离。将分离后的蛋白转移至PVDF膜上,使用冷TBS-T缓冲液进行湿式转膜。转膜完成后,在5%脱脂牛奶中封闭1 h。采用SF3B1特异性一抗(1∶1000稀释)于4 ℃孵育过夜。洗涤后,采用与一抗相对应的HRP标记的二抗孵育1 h,使用β-actin作为内参抗体,采用ECL化学发光底物显影。最后,使用Image J图像处理软件对SF3B1蛋白及内参蛋白的条带进行灰度分析,通过计算目标蛋白的灰度值与内参蛋白灰度值的比值来确定SF3B1蛋白的相对表达量。
1.3 观察指标 分析SF3B1在乳腺癌组织和癌旁组织中的表达,比较不同SF3B1表达情况患者临床病理因素:年龄、肿瘤大小、组织学分级、肿瘤部位、病理学分级、雌激素受体(ER)、孕激素受体(PR)、淋巴结转移、分化程度的差异。
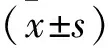
2 结 果
2.1 乳腺癌组织和癌旁组织SF3B1表达比较 乳腺癌组织SF3B1表达明显高于癌旁组织(P<0.05),见表1。
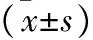
表1 乳腺癌组织和癌旁组织SF3B1表达比较
2.2 SF3B1表达对乳腺癌的诊断价值 ROC曲线分析结果显示,SF3B1诊断乳腺癌的AUC为0.713,最佳截断值为110.72,约登指数为0.314,敏感度为75.00%,特异度为56.43%,95%CI:0.656~0.765(P<0.001)(图1)。

图1 SF3B1表达诊断乳腺癌的ROC曲线
2.3 SF3B1表达与患者临床病理特征的关系 根据ROC分析得出SF3B1诊断乳腺癌的最佳截断值为110.72,以此为标准将≥110.72的纳入高表达组,<110.72的纳入低表达组,高表达组49例,低表达组39例。高表达组年龄明显高于低表达组,病理学分级显著高于低表达组,淋巴结转移为N0的比例明显低于低表达组,差异均有统计学意义(均P<0.05)。见表2。
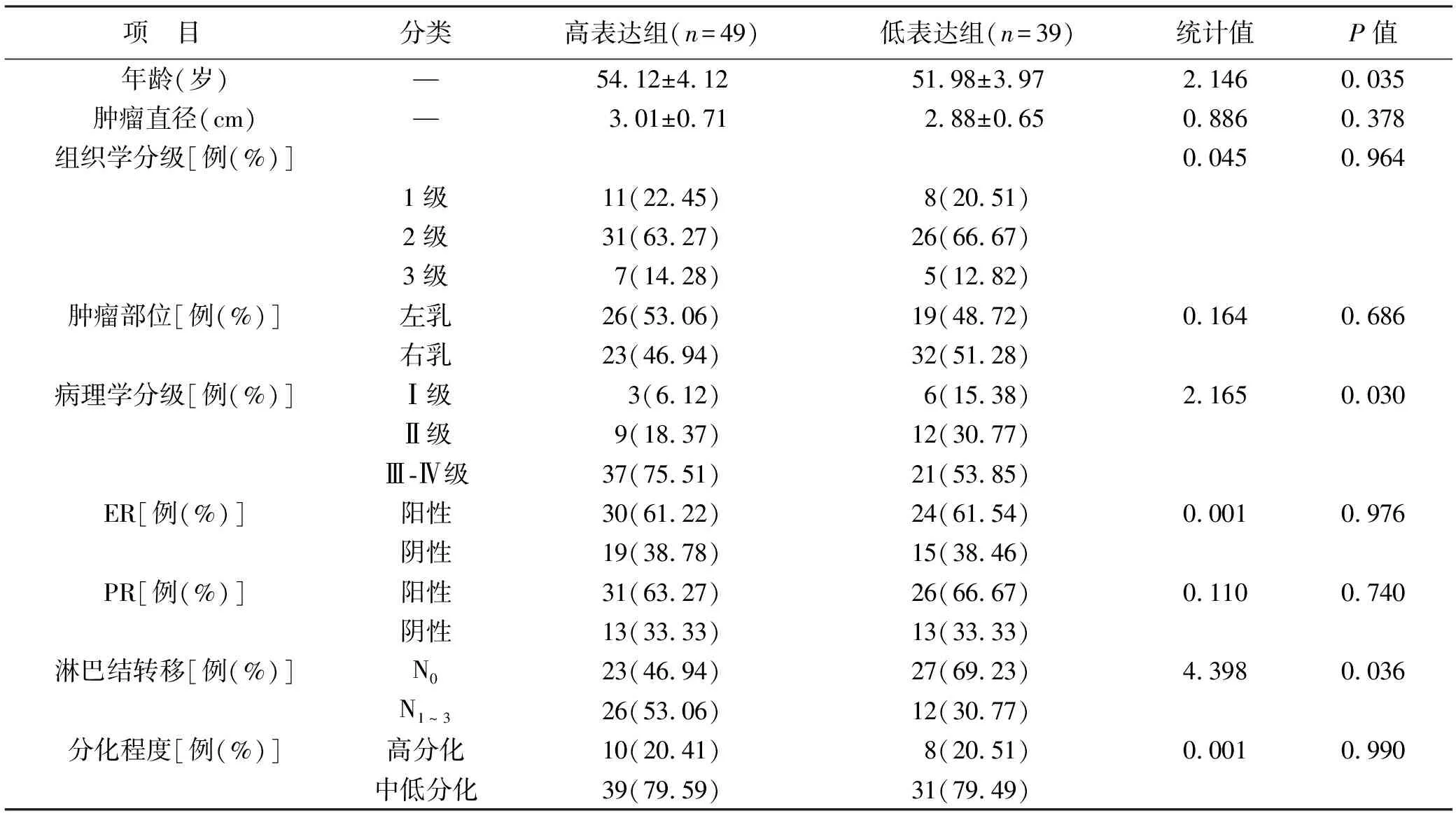
表2 SF3B1表达与患者临床病理特征的关系
3 讨 论
乳腺癌已成为我国女性中最为常见的恶性肿瘤类型,对女性健康构成了极大的威胁,位居女性肿瘤发病率和病死率的首位。尽管医疗技术持续发展与进步,乳腺癌的发生率和病死率依旧呈现持续增长的态势[8-9]。尽管手术、放疗、化疗和靶向治疗等多种治疗手段已在临床中广泛应用,但仍然有相当一部分的患者在治疗以后出现复发或转移,从而影响乳腺癌患者的长期生存率[10-11]。了解癌症的分子基础不仅有助于更好地理解其发病机制,还可为开发新的治疗策略提供方向,因此,深入探索乳腺癌的分子机制和潜在治疗靶点尤为重要。
SF3B1是核糖核蛋白复合体的关键组成部分,对RNA的前体剪切起到至关重要的作用,在细胞的基因表达过程中,RNA前体剪切是mRNA合成及后续蛋白质翻译过程中一个至关重要的调控步骤。研究[12-13]显示,有56%的乳腺癌中剪接体成分基因发生突变,在ER阳性亚型患者中SF3B1的突变较为显著,频率较高,可能参与乳腺癌的发生。在乳腺癌中,SF3B1的突变和异常表达可能导致RNA剪切的异常,从而产生异常的mRNA和蛋白质异构体,这些异常的蛋白质异构体的功能可能发生增强、减弱或完全改变,从而影响细胞的增殖、迁移和侵袭能力,比如某些由SF3B1突变引起的RNA剪切变体可能增强细胞的生存和增殖信号,或抑制细胞的凋亡信号,从而促进乳腺癌的发生和进展[14-15]。此外,SF3B1的突变和异常表达还可能影响乳腺癌细胞对激素等其他信号的响应,比如SF3B1的某些突变可能增强或减弱乳腺癌细胞对雌激素的响应,从而影响乳腺癌的生长和治疗反应。本研究对比了乳腺癌组织和癌旁组织中SF3B1的表达,结果显示乳腺癌组织中SF3B1表达明显较癌旁组织上调。原因可能是与SF3B1的作用机制有关,具体而言,RNA的剪切作用是保持蛋白质多样性的关键,如果剪切相关的因子发生突变,可能会导致多种不正常的剪切变体,从而破坏基因序列的稳定性,异常的RNA剪切和与之相关的基因变异,已被认为是与肿瘤发展相关的关键特征[16-17]。SF3B1基因位于染色体2q33.1,可组成剪接体催化核心的U2小分子核糖核蛋白体(U2 small nuclear ribonucleoprotein particle,U2-snRNP),SF3B1作为SF3B的亚单位,能够与RNA前提的5’及3’端分支点交联,参与mRNA内含子的剪切和成熟过程[18-19]。作为RNA剪切因子中突变频率最高的基因,突变发生在多种类型癌症中。SF3B1的变异主要集中在其C端的22个HEAT重复结构域内,在乳腺癌中,这种变异会导致氨基酸的单点替换,表现为杂合性的突变形式,其突变位点在22个重复HEAT结构域中集中在第5至第9,乳腺癌中SF3B1的复发性错义突变也表明mRNA剪接过程中剪接体的重要作用。有研究应用高通量测序技术评估慢性淋巴细胞性白血病患者癌症细胞,发现SF3B1突变引起的RNA选择性剪接大多集中在3’剪接位点,另外也有研究分析乳腺癌的生物信息学,得到了相同结论[20-21]。
本研究分析SF3B1表达对乳腺癌的诊断价值,ROC结果显示,SF3B1的AUC为0.713,诊断效能较好。并且本研究根据ROC得出的最佳截断值划分高低表达组,证实SF3B1的表达水平与患者年龄、病理学分级、淋巴结转移状态有关,提示SF3B1在乳腺癌初期可能扮演关键角色,并有可能成为乳腺癌治疗的预测标志物。SF3B1可通过激活RAS及MAPK等信号传导途径,以及介导细胞因子与其受体之间的相互作用,进而参与调控乳腺癌细胞的生物学特性,包括丝氨酸和苏氨酸的代谢过程,尤其是RAS信号途径的持续活化,促进正常细胞向肿瘤细胞的转变,并触发细胞的无限制增殖现象[22-23]。当MAPK信号途径被过度激活或表达增强时,细胞内会触发一系列的链式反应,这些反应会影响细胞核的转录调控元件,导致与细胞生长、扩增、迁移和死亡相关的基因的过量表达,同时使来自外界生长因子的信号作用增强,以此机制促进癌细胞生长增殖[24]。研究[25]显示,SF3B1的反复突变与乳腺癌不同剪接活性相关,并且年龄较大的患者突变风险更高,与年龄呈现明显相关性。然而与其他临床病理学因素没有显著相关性,这可能是由于样本量的限制,此外,由于肿瘤的内在异质性,SF3B1在各种肿瘤信号途径中可能有不同的功能。同时,肿瘤的体积和研究操作中的变异也可能导致数据的不一致性,从而影响研究结果。因此,关于SF3B1与肿瘤的临床病理特性和其深层次的分子机制仍需深入探讨。
综上所述,SF3B1在乳腺癌患者体内的表达水平显著提高,其在乳腺癌的早期诊断中显示出较高的应用价值。SF3B1的表达与患者的年龄、病理等级以及淋巴结转移状况等多个临床病理指标紧密相关,表明其可能在乳腺癌的发展、局部侵犯及远处转移等关键过程中扮演着重要角色,并有助于在临床上对乳腺癌进行诊断和评估病情。

