双重血浆分子吸附系统序贯血浆置换治疗HBV感染相关慢加急性肝衰竭疗效及对患者血清内毒素和炎症因子水平的影响
范潇月,刘建英,张 悦,洪 芹,陈琳琳
(德阳市人民医院,四川 德阳 618000)
乙型肝炎病毒感染相关慢加急性肝衰竭(HBV-associated acute-on-chronic liver fail-ure,HBV-ACLF)是在慢性肝病基础上发展而来的急性肝损伤,患者以高黄疸、严重凝血功能障碍为主要表现[1-2]。HBV-ACLF患者可伴有多器官衰竭,短期病死率高达60%~80%[3]。人工肝支持治疗是目前控制病情,延缓患者生命的有效手段,主要包括血浆置换(Plasma exchange,PE)、双重血浆分子吸附系统(Double plasma molecular adsorption system,DPMAS)等治疗模式[4-5]。PE治疗价格适中,疗效明确,但存在血浆供应不足和过敏的风险[6]。DPMAS治疗既可减轻血浆不足的压力,又可提高对胆红素的吸附能力,有效调节凝血功能[7]。近年来,DPMAS联合PE治疗逐渐获得临床医患的认可,该疗法可取长补短,充分发挥上述两种疗法的优势,但关于其对患者血清炎症因子、内毒素水平及存活率的影响,还需更多临床资料支持[8]。故本研究选取92例HBV-ACLF患者为研究对象,分析DPMAS序贯PE治疗的近期疗效,现报告如下。
1 对象与方法
1.1 研究对象 92例HBV-ACLF患者来自德阳市人民医院,收集时间为2019年3月至2021年7月。病例纳入标准:经临床血液生化等检查明确诊断,符合中华医学会感染学分会制定的《肝功能衰竭诊疗指南(2012年版)》[9]中急性肝衰竭的诊断标准:既往有慢性肝病基础,黄疸加重、乏力、血清总胆红素(TBIL)每日升高>17.1 μmol/L或高于正常值上限10倍,同时血浆凝血酶原活动度≤40%或者国际标准化比值≥1.5;年龄20~75岁的HBV感染者。排除标准:合并患有严重功能脏器障碍者;酒精性肝病或自身免疫性肝病者;患有甲、丙、丁、戊病毒性肝炎者;行肝脏移植或长期接受抗凝药物治疗者;恶性肿瘤者;无法配合研究者;哺乳及妊娠期妇女。根据非随机同期对照研究及患者自愿原则分为DPMAS序贯PE组(n=45例)和PE组(n=47例)。所有患者签署知情同意书。
1.2 治疗方法 92例患者入院后需要严格卧床休息,严格监测生命体征,同时给予营养支持、补充血浆、白蛋白及口服抗病毒药物等基础治疗,PE组另予以单纯PE治疗,DPMAS序贯PE组患者接受DPMAS序贯PE治疗。
1.2.1 PE组:采用伟力血液净化人工肝支持系统及相关血浆分离器(国械注准20163454896),使用PE模式连接管路,并用肝素钠氯化钠溶液进行预处理,接着给予患者塞米松5 mg静脉注射,20 ml葡萄糖酸钙(10%)混合葡萄糖氯化钙(5%)静脉滴注;以新鲜冰冻血浆作为置换液,置换2000~3000 ml新鲜血浆,流速设置为120~150 ml/min,分离速度设置为25~30 ml/min,置换1.5~2.0 h,治疗次数2~3次,间隔3~5 d,以硫酸鱼精蛋白(≤50 mg)进行肝素对抗,共治疗12周,治疗次数根据患者具体情况调整。
1.2.2 DPMAS序贯PE组:采用血液净化人工肝支持系统、血浆分离器(国械注准20163454896),树脂血液灌流器(国械注准20163451181)和血浆胆红素吸附器(国械注准20163450373)进行DPMAS序贯PE治疗;安装体外循环通路,给予患者塞米松5 mg静脉注射,20 ml葡萄糖酸钙(10%)混合葡萄糖氯化钙(5%)静脉滴注,术前以0.9%氯化钠溶液对柱体和管道行预冲洗,给予肝素钠抗凝,术中流速设置为100~150 ml/min,吸附时间不少于150 min,血浆处理量约5000 ml;DPMAS治疗结束后调整血浆泵流量,将动静脉端和吸附柱端夹闭,并设置为单独PE模式,补充800 ml新鲜血浆,血流速度设置为120~150 ml/min,分离速度设置为25~30 ml/min,置换0.5 h;治疗间隔3~5 d,先给予DPMAS治疗,再予以PE序贯治疗,以硫酸鱼精蛋白(≤50 mg)进行肝素对抗,共治疗12周,治疗次数根据患者具体情况调整。
1.3 观察指标
1.3.1 治疗4 周及12周存活率及好转率:统计两组治疗4周及12周时的好转率及存活率,治疗好转判定标准[10]:患者腹胀、乏力、腹水、黄疸等临床症状体征好转,TBIL水平在正常值5倍以下,国际标准化比值<1.6或凝血酶原活动度>40%。
1.3.2 血清炎症因子与内毒素水平:于治疗前、治疗4周及12周时收集患者空腹静脉血液样本,采用ELISA法检测两组患者血清C反应蛋白(CRP)和白细胞介素6(IL-6)水平;中性粒细胞及淋巴细胞水平采用全自动血液分析仪测定,并计算中性粒细胞/淋巴细胞比值(NLR);采用鲎试剂动态比浊定量法检测PE组及DPMAS序贯PE组血清内毒素(ET)水平。
1.3.3 终末期肝病(MELD)评分:比较两组治疗前及治疗4周及12周时的MELD评分[11]以预测患者的病死率:MELD总分<15分为无需进行肝移植,20~30分的病死率>30%,30~40分的病死率>50%,总分40分以上的病死率>70%,评分越高表示患者的预后越差。
1.3.4 并发症:统计两组治疗过程中并发症发生情况。
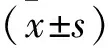
2 结 果
2.1 两组一般资料比较 两组性别、年龄等一般资料比较,无统计学差异(均P>0.05),见表1。

表1 两组一般资料比较
2.2 两组治疗4 周及12周存活率比较 DPMAS序贯PE组治疗4周及12周时的存活率与PE组比较无统计学差异(均P>0.05),见表2。
2.3 两组治疗4周及12 周好转率比较 两组治疗4 周好转率比较有统计学差异(P<0.05),治疗12 周好转率比较无统计学差异(P>0.05),见表3。

表3 两组治疗4 周及12 周好转率比较[例(%)]
2.4 两组血清炎症因子与内毒素水平比较 治疗4周及12周时,DPMAS序贯PE组血清CRP、IL-6、NLR及ET水平显著低于PE组(均P<0.05),见表4。
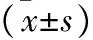
表4 两组血清炎症因子与内毒素水平比较
2.5 两组MELD评分比较 DPMAS序贯PE组治疗4周时的MELD评分显著低于PE组(P<0.05),两组治疗12周时的MELD评分比较无统计学差异(P>0.05),见表5。

表5 两组MELD评分比较(分)
2.6 两组并发症发生率比较 两组治疗过程中,并发症发生率比较无统计学差异(均P>0.05),见表6。

表6 两组并发症发生率比较[例(%)]
3 讨 论
内科支持治疗、人工肝治疗及肝移植是HBV-ACLF的主要干预手段[12-13],其中人工肝治疗形式多样、疗效确切,应用范围较广。在PE治疗中,血浆被分离并补充凝血因子来进行置换,同时能够清除内毒素及大分子免疫复合物,但在清除血浆水溶性毒素方面局限性明显,且对血浆的需求量较大,还易引发过敏、感染等不良反应[14]。DPMAS治疗可有效清除炎性介质、胆红素及大分子蛋白,还可降低滤过过程中对血浆有益物质的破坏[15],但单一治疗存在一定局限性[16]。本研究给予HBV-ACLF患者DPMAS序贯PE治疗,获得良好疗效。
HBV-ACLF的致病机制一方面与HBV感染引发的原发性病理免疫损伤有关,另一方面与内毒素引起的炎性反应有关[17]。患者由于肝细胞损伤使内静脉内毒素未经正常代谢而进入体循环,诱发内毒素血症,而过量的内毒素又可进一步损伤肝细胞,刺激炎症因子的分泌,并活化中性粒细胞,从而表现为血清CRP、IL-6、NLR水平升高[18]。本研究结果显示,DPMAS序贯PE组与PE组血清炎症因子及ET水平比较有统计学差异。说明DPMAS序贯PE治疗与单纯PE治疗在清除血清炎症因子方面效果更显著。与黎春宇等[19]报道基本相符。这是由于,DPMAS中的阴离子交换树脂吸附柱能够特异性结合胆红素,树脂血液灌流器依托其大孔结构和大比例表面积,增强对IL-6、CPR等炎症因子的吸附能力[20],同时序贯PE治疗可补充血浆中丢失的凝血因子等活性成分,弥补DPMAS治疗的不足,从而改善患者肝功能[21]。黄辉权[22]研究指出,给予急性重症肝衰竭伴多器官功能障碍综合征患者PE+DPMAS治疗,不仅对电解质水平影响较小,还可改善肝功能,下调CRP等水平,改善患者临床结局,这为本研究提供理论支持。另外,本研究发现,两组治疗期间并发症发生率比较无统计学差异,证明DPMAS序贯PE治疗,总体安全可靠[23]。
本研究还发现DPMAS序贯PE组患者的4周好转率高于PE组,MELD评分低于PE组,而两组治疗12周时的总体存活率及MELD评分比较无统计学差异,且两组治疗4周好转率及12周存活率差异主要集中在ACLF早期患者中。提示DPMAS序贯PE治疗可有效提高ACLF早期患者的治疗效果,但在改善整体生存率方面,还需进一步验证[24]。但这与沈扬林等[25]报道的DPMAS序贯PE治疗可提高HBV-ACLF患者90 d生存率有所不同,可能与不同研究中患者的病情严重程度不同有关。
综上所述,给予HBV-ACLF患者DPMAS序贯PE治疗可明显提高ACLF早期患者的4周治疗好转率,有效清除血清内毒素及CRP、IL-6等炎症因子。该疗法安全有效,与单纯PE治疗比较,不会增加电解质紊乱、感染等并发症发生率,但在提高中晚期患者12周生存率方面局限性明显。本研究存在明显不足,为单中心临床设计,样本量少,仅能使用较简单的统计分析方法进行分析,控制混杂因素的方法较欠缺,后续有待扩大样本量,控制混杂因素,以减小结果偏倚,且未对不同疾病阶段HBV-ACLF患者的血清炎症因子水平进行探究,期待后续补足。

