系统性红斑狼疮患者贝利尤单抗干预后外周血RDW、RAR、PNI变化及意义
刘保成,颜苏艳,刘东霞,麻贞贞,杨清锐
山东第一医科大学附属省立医院风湿免疫科,济南250021
系统性红斑狼疮(SLE)是一种以多系统、多器官损害为主要特征的自身免疫性疾病,好发于育龄期女性,异质性强,临床表现多样。SLE 的发病机制尚不完全清楚。研究认为,基因遗传、环境因素、激素、感染、药物、先天性免疫和适应性免疫失衡等多种机制共同参与了SLE 的发病过程[1-2]。在临床实践中,SLE 病情常呈反复发作与缓解交替,不同程度上对患者的生活质量产生负面影响。目前SLE的治疗药物主要包括糖皮质激素、免疫抑制剂等,虽能在一定程度上缓解靶器官损伤、降低病死率,但相对不良反应多、靶向性较差、治疗效果不佳[3]。异常活化的B 淋巴细胞几乎贯穿了SLE 疾病发展的全过程,针对B 淋巴细胞生物制剂的研究是当前重点[4]。贝利尤单抗是一种针对B细胞活化因子(BLyS)的重组人源化IgG1-λ 单克隆抗体,2019 年7 月在中国获批上市,成为国内首个批准上市用于治疗SLE 的生物制剂。目前,尚缺乏SLE 患者贝利尤单抗干预有效的评估指标。本研究旨在探讨SLE患者在贝利尤单抗治疗前后中性粒细胞/淋巴细胞(NLR)、血小板/淋巴细胞(PLR)、C反应蛋白/血清白蛋白(CAR)、红细胞分布宽度/血清白蛋白(RAR)、预后营养指数(PNI)变化,以评价其能否作为反映SLE疾病活动度的工具及贝利尤单抗干预SLE 临床疗效评估的新指标。
1 资料与方法
1.1 临床资料 选取2019 年9 月—2022 年8 月于山东第一医科大学附属省立医院风湿免疫科就诊且接受贝利尤单抗治疗的SLE患者42例,其中男5例、女37例,年龄(27.02 ± 10.52)岁,病程19(4.75,60)个月。诊断均符合2019 年欧洲抗风湿病联盟(EULAR)和美国风湿病学会(ACR)推荐的最新SLE分类标准,根据美国风湿病学会制定的SLE 疾病活动指数(SLEDAI)评分,重度21例、中度12例、轻度8例、病情稳定无活动1例。纳入标准:①年龄>18岁;②对大剂量激素无法耐受、传统治疗效果不佳、仍有肾损害、溶血性贫血等情况而接受贝利尤单抗治疗的患者;③在标准治疗基础上仍有高疾病活动性(抗ds-DNA 抗体阳性、低补体、SLEDAI-2K 评分≥8);④随访资料完整。排除标准:①伴发结核、慢性肝病、恶性肿瘤等疾病患者;②伴发其他自身免疫性疾病;③合并血液系统疾病;④处于特殊时期的患者:如哺乳期女性;⑤随访资料不完整或临床观察中患者失访。本研究经山东第一医科大学附属省立医院伦理委员会批准。患者及家属均知情同意并签署同意书。
1.2 治疗方法 41 例接受口服醋酸泼尼松治疗,其用量为重度活动期≥1 mg/(kg·d),轻中度活动期0.5 mg/(kg·d),稳定期<15 mg/d;1例接受来氟米特治疗,10 mg/次,2 次/d,口服。患者病情稳定后醋酸泼尼松缓慢减量。如果患者病情允许,口服醋酸泼尼松逐渐减量至5~7.5 mg/d 维持,免疫抑制剂以临床有效最低剂量长期维持。患者均给予贝利尤单抗干预,贝利尤单抗10 mg/kg,前3 次每2 周给药1次,随后每4 周给药1 次。对所有研究对象进行随访,其中有42 例患者完成了14 周(5 次)干预,39 例患者完成了18 周(6次)干预,33例患者完成了22周(7次)干预,27例患者完成了26周(8次)干预。
1.3 外周血相关指标检测 42 例患者入院后于第二天清晨采集外周静脉血3~5 mL,采用(美国贝格曼Coulter LH780 型)全血细胞自动分析仪检测中性粒细胞计数(N)、淋巴细胞计数、血小板计数、红细胞分布宽度(RDW);采用日本日立7600型全自动分析仪检测血清白蛋白(Alb);用散射比浊法检测血清C 反应蛋白(CRP);用放射免疫法检测抗dsDNA 抗体;ELISA 法检测血清补体C3、C4,试剂盒购自上海梵态生物科技有限公司,严格按照试剂说明书操作步骤完成。其中27 例患者完成26 周贝利尤单抗干预治疗后检测以上血液指标。计算27例患者贝利尤单抗干预前后RDW、NLR、PLR、CAR、RAR、PNI 差值,即ΔRDW、ΔNLR、ΔPLR、ΔCAR、ΔRAR、ΔPNI。
1.4 统计学方法 采用SPSS25.0 统计软件。K-S检验为正态分布的计量数据采用-x±s表示,比较采用t检验;不符合正态分布的计量数据采用[M(P25,P75)]表示,比较采用非参数检验;计数资料比较采用χ2检验。采用Spearman 相关法进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 贝利尤单抗干预前后SLE 患者血液学指标变化 经贝利尤单抗干预26周后,SLE患者抗dsDNA、SLEDAI-2K、RDW、RAR较干预前下降(P均<0.05),C3、C4、Alb、PNI 较干预前升高(P均<0.05),干预前后CRP、NLR、PLR、CAR无统计学差异(P均>0.05),见表1。
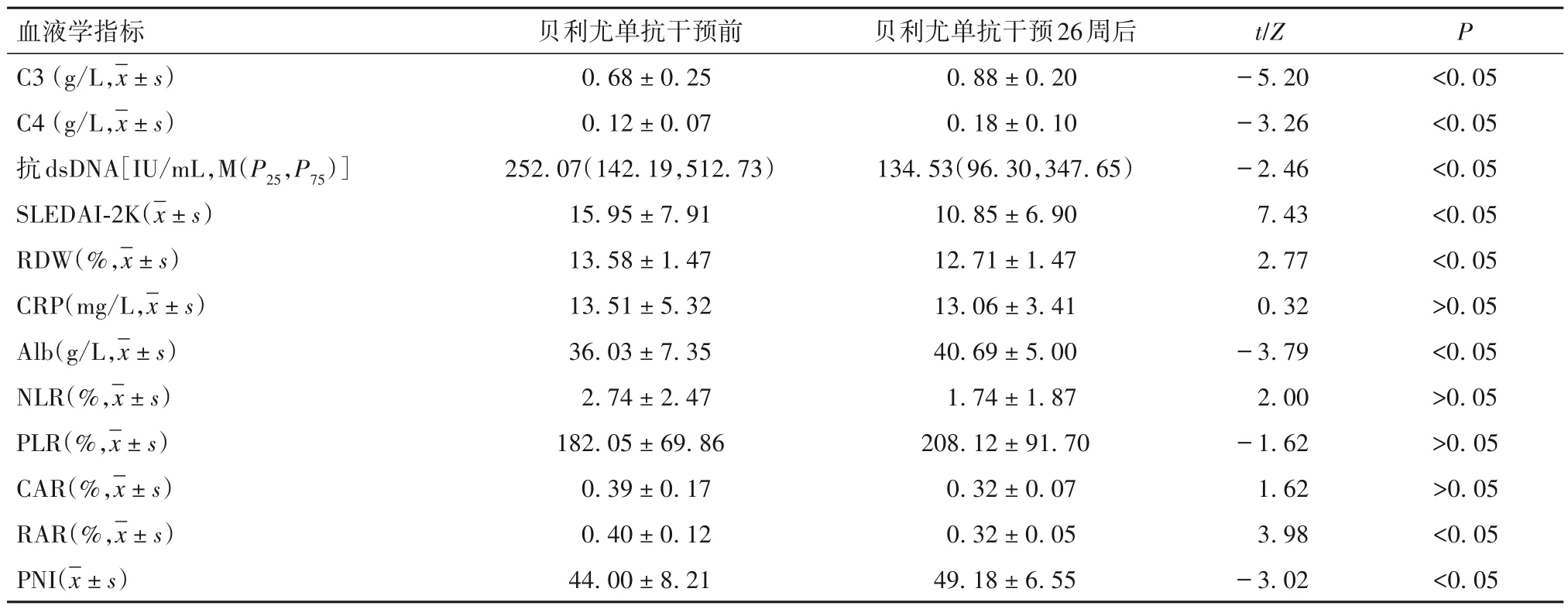
表1 贝利尤单抗干预前后患者血液指标变化(n=27)
2.2 贝利尤单抗干预前SLE 患者疾病活动度与血液指标的相关性 Spearman 相关分析结果显示,干预前SLE患者的RDW、RAR与SLEDAI-2K呈正相关(r分别为0.307、0.334,P均<0.05),Alb、PNI 与SLEDAI-2K 呈负相关(r分别为-0.313、-0.314,P均<0.05),而NLR、PLR、CAR 与SLEDAI-2K 之间无明显相关性(r分别为-0.005、0.013、0.08,P均>0.05)。
2.3 贝利尤单抗干预26 周后SLE 患者血液学指标变化及其与疾病活动度的相关性 贝利尤单抗治疗26 周后,SLE 患者的ΔRDW、ΔRAR 与ΔSLEDAI-2K呈正相关(r分别为0.394、0.490,P均<0.05),ΔPNI与ΔSLEDAI-2K 呈负相关(r=-0.446,P<0.05);而ΔAlb、ΔNLR、ΔPLR、ΔCAR 与ΔSLEDAI-2K 无相关性(r分别为-0.300、0.128、0.163、0.317,P均>0.05)。
3 讨论
SLE 发病机制复杂多样,自身抗体的产生和免疫复合物的沉积是其主要特征。 BLyS 亦称B 淋巴细胞刺激因子(BAFF),由髓系细胞产生,可与BAFF受体相结合并在调节B 淋巴细胞成熟、增殖及活性功能等方面发挥重要作用,是先天性和适应性免疫系统的重要纽带,在SLE 的发病过程中扮演重要角色。贝利尤单抗通过与可溶性BLyS 高亲和结合并抑制其活性,抑制B 淋巴细胞的活化与增殖,减少B淋巴细胞向浆细胞的分化,进而减少机体浆细胞数量及自身抗体的产生,减少免疫复合物的沉积,延缓靶器官损伤,改善SLE 病情。我们的研究评估了贝利尤单抗干预后SLE 患者外周血RDW、Alb、NLR、PLR、CAR、RAR、PNI变化及其与SLE 疾病活动指数的相关性和疗效评估的临床价值。
研究结果表明,与干预前相比,贝利尤单抗干预26 周后SLE 患者抗dsDNA、SLEDAI-2K、RDW、RAR明显降低,C3、C4、Alb、PNI则明显升高,且SLE 患者RDW、RAR 与SLEDAI-2K 呈正相关,Alb、PNI 与SLEDAI-2K 呈负相关,提示这些血液学标志物与SLE 疾病活动性有一定相关性。此外,我们发现接受贝利尤单抗干预26 周的SLE 患者,其ΔRDW、ΔRAR、ΔPNI 与ΔSLEDAI-2K 显著相关,提示ΔRDW、ΔRAR、ΔPNI可考虑作为评估贝利尤单抗干预SLE药物疗效的新指标。
外周血NLR、PLR、RAR、CAR、PNI 作为一种便捷、花费低的新型血液标志物,在感染、肿瘤、脑卒中、心肌梗死等疾病中评估全身炎症反应的效用已经得到了证实,并在风湿领域中取得广泛关注。研究发现,NLR 与SLE、原发性干燥综合征患者疾病活动性相关,并可反映银屑病患者的全身炎症水平。NLR、PLR 可作为监测SLE 患者疾病活动性的血液学指标[5],CAR 可作为大动脉炎疾病活动及病情缓解的标志物,RAR 可作为皮肌炎患者监测疾病活动度的工具[6]。PNI 是临床实践中识别活动性SLE 的潜在指标且为其病情活动的独立预测因子[7]。除了可用于反映机体炎症状态及疾病活动度,近年来也有研究证实ΔNLR 可用来评估RA 患者接受bDMARDs(包括英夫利昔单抗、托珠单抗、依那西普、阿达木单抗)治疗的临床疗效[8],ΔPLR 可用来评估RA 患者接受托珠单抗治疗的临床疗效[9]。我们的研究首次发现经过贝利尤单抗干预26 周后,SLE 患者ΔRAR、ΔRDW 与ΔSLEDAI-2K 呈正相关,ΔPNI与ΔSLEDAI-2K 呈负相关,提示ΔRDW、ΔRAR、ΔPNI可用来反映贝利尤单抗干预SLE的临床疗效。
SLE 患者多有血液系统受累,以贫血最为常见,其次是白细胞减少和血小板减少[10],这可能是与免疫介导的骨髓抑制有关。在SLE 患者中,B 淋巴细胞异常活化可引白细胞介素-1(IL-1)、IL-6、IL-17、肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)等细胞因子的产生,这些细胞因子与中性粒细胞、淋巴细胞和血小板活化消耗密切相关[11]。据报道,高达93%的SLE 患者可合并淋巴细胞减少,且淋巴细胞减少与SLE 患者的病情活动密切相关[12]。全身炎症反应水平是决定炎性相关疾病患者预后的关键因素,白细胞及其亚型已被用于评估患者机体炎症状态。NLR作为中性粒细胞与淋巴细胞的比率,反映了先天免疫和适应性免疫之间的平衡,慢性炎症似乎会影响NLR 与疾病活动之间的关系。本研究首次发现经贝利尤单抗干预26 周后SLE 患者NLR 较干预前降低,这可能与贝利尤单抗缓解SLE 患者炎症反应状态有关[13]。
机体营养状况与免疫功能关系密切,营养不良可导致免疫功能减退,严重的会发生感染甚至肿瘤。SLE 患者常合并消化系统的受累,导致患者食欲改变及营养不良风险增加[14]。研究发现,SLE 患者疾病活动期Alb 显著下降,并与疾病活动度有关[15]。PNI 是由血清Alb 和外周血淋巴细胞绝对值计算得来的数据,可反映SLE患者体内的营养状况。本研究中,在贝利尤单抗治疗26 周期间,SLE 患者Alb、PNI 水平逐渐上升,这可能与贝利尤单抗可改善SLE患者的肾小球滤过率、减少尿蛋白的丢失、减少体内多种自身抗体和免疫复合物的形成、改善患者的营养水平使白蛋白的合成增加,从而使白蛋白浓度升高有关[17]。贝利尤单抗改善患者淋巴细胞数,从而使其PNI上升[18]。本研究发现ΔPNI可作为贝利尤单抗干预SLE患者早期临床疗效评估的重要工具,使临床医生能客观、简单和持续地评估贝利尤单抗对SLE患者的治疗效果。
RDW 作为描述红细胞体积异质性程度的指标,对于反映全身炎症状态具有重要意义,可作为评估自身免疫性疾病病情活动度的有效工具[19]。研究发现,慢性病贫血和自身免疫性溶血性贫血是SLE 常见的两种贫血类型,两者均与RDW 升高密切相关[20],RDW 增加与红细胞变形能力减弱有关,可能导致微循环障碍,RDW 增加不仅是系统性炎症的表现,亦是导致SLE组织损伤的因素之一。同时,炎性因子可通过影响体内铁的生物利用度,使红细胞形态异常,导致RDW 水平升高;亦可通过抑制红细胞的成熟,破坏其变形能力,并允许较大的网织红细胞进入血液,导致RDW 水平增高[21]。RAR 是红细胞分布宽度与白蛋白的比率,相较RDW、Alb,RAR 对反映全身炎症及营养状态具有重要意义,能更全面地反映疾病发生发展的状态及活动性。RAR 可作为反映急性肾损伤患者预后的指标[22],其在SLE 患者中的临床价值尚未得到证实。本研究中,RAR 与SLEDAI-2K 呈正相关,RAR 与SLE 疾病活动性具有一定相关性,在贝利尤单抗治疗26 周期间,SLE 患者RDW、RAR 水平逐渐下降,这可能与贝利尤单抗缓解SLE患者炎症反应状态有关[13]。
综上所述,贝利尤单抗干预26 周后,SLE 患者RDW、RAR 较干预前降低,PNI 较干预前升高,ΔRDW、ΔRAR、ΔPNI有助于评估贝利尤单抗干预治疗SLE的效果。
———2 型糖尿病肥胖成人生活方式改变及活动度

