脑小血管病患者血清甲状腺激素水平与认知及情感障碍的相关性
李丽博,智珈鑫,苑振云,韩彩莉,高雁,刘斋
河北医科大学第一医院神经内科 河北省脑老化与认知神经科学实验室,石家庄050031
脑小血管病(CSVD)是指由各种原因影响颅内小动脉及其远端分支、微动脉、小静脉、微静脉及毛细血管而出现的一系列临床、影像及病理综合征。慢性CSVD患者常无明显临床表现,主要依靠影像学检查诊断,CSVD 起病隐匿,患者甚至临床医师容易忽略。随着CSVD负担的逐渐加重和病情进展,患者可出现认知障碍、情感障碍、运动障碍和二便障碍等症状。CSVD 引起的认知功能障碍占所有血管性痴呆的35%~67%[1],是老年患者认知功能下降和功能丧失的主要原因,是继阿尔茨海默病后导致痴呆症的第二大原因。情感障碍常表现为情绪低落、焦虑抑郁、意志薄弱及思维迟缓等。认知功能障碍及情感障碍会给患者、家庭甚至社会带来经济压力和沉重的负担。甲状腺激素不仅能提高人体基础代谢,在中枢神经系统的生长、发育、成熟及功能调节等方面均发挥重要作用,包括促进神经元的早期产生和生长发育、提高多数器官的细胞耗氧率,保证脑细胞的能量来源、促进蛋白质的合成,保证脑部血流供应以及维持神经系统的兴奋性等。近年多项研究发现,甲状腺激素在不同人群的认知功能障碍中有重要作用[2-5]。但目前关于血清甲状腺激素水平与CSVD 患者认知功能及情感的研究鲜有报道。本研究通过对甲状腺激素水平的测量及认知功能及情感的评估,探讨CSVD 患者血清甲状腺激素水平与认知功能及情感的相关性,为早期发现并延缓CSVD患者认知障碍及情感障碍的发生发展提供新的临床依据。
1 资料与方法
1.1 临床资料 选取2020 年10 月—2022 年10 月就诊于河北医科大学第一医院神经内科的CSVD 患者216 例,男86 例、女130 例,年龄55~80(65.51 ±7.68)岁。纳入标准:①年龄55~80 岁;②依据患者症状、体征及影像学检查,符合《中国脑小血管病诊治共识》中的诊断标准;③所有受试者及家属知情同意本研究并签署同意书。排除标准:①既往有感染性脑疾病、明显焦虑抑郁、脑部肿瘤、脑部外伤、帕金森病及综合征、阿尔茨海默病、CO中毒等其他引起认知功能改变的疾病者;②有原发性或继发性甲状腺疾病史,近期应用过相关药物治疗或应用其他影响甲状腺激素代谢的药物者;③合并有大血管病变、心源性栓塞、动静脉畸形、血管炎等所致的脑梗死者;④既往脑出血病史者(微出血除外);⑤合并多发性硬化、代谢性或中毒性脑病等导致的脑白质病变者;⑥合并脑、心、肝、肾、肺等重要脏器严重功能不全或障碍者;⑦因听力障碍、表达障碍等原因不能配合者。
1.2 血清甲状腺激素的检测 患者于入院当日或次日清晨空腹采集肘静脉血5 mL,采用全自动免疫分析仪及甲状腺激素检测试剂检测促甲状腺激素(TSH)、FT3、FT4、TT3、TT4。
1.3 认知与情感障碍评估 认知功能评估:对所有患者使用蒙特利尔认知评估量表(MoCA)评估受试者认知功能。总分30分,对于受教育年限在12年及以下的测评总分加1分以校正偏移,评分<26分为认知功能障碍,≥26 分为认知功能正常,得分越高说明认知功能越好。依据MoCA 总分将受试者分为认知障碍组及非认知障碍组。情感功能评估:采用汉密顿抑郁量表(HAMD24)及汉密尔顿焦虑量表(HAMA14)评估患者情感功能。HAMD24评分总分≤6分为无抑郁;7~16分为可能抑郁;17~23分为肯定抑郁;≥24分为重度抑郁。HAMA14评分≤6 分为无焦虑;7~13分为可能焦虑;14~20 分为肯定焦虑;21~28 分为明显焦虑;≥29 分为重度焦虑。依据HAMA14及HAMD24总分将HAMA14评分≥14 分和(或)HAMD24≥17 分的患者划分为情感障碍组,否则纳入非情感障碍组。认知功能与情感评估均在周围环境安静、无外界打扰的情况下由我院受过专业培训的医师于受试者入院3 d内完成。
1.4 统计学方法 采用SPSS24.0 统计软件。计量资料符合正态分布以±s表示,比较采用t检验;非正态分布数据采用M(P25,P75)表示,比较采用非参数检验中独立样本Mann-WhitneyU检验。计数资料比较采用χ2检验。通过单因素和多因素Logistic回归分析血清甲状腺激素与CSVD 患者认知障碍和情感障碍的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 认知障碍组与非认知障碍组一般资料比较 共纳入认知障碍组144 例(66.7%),非认知障碍组72例(33.3%)。认知障碍组年龄、受教育年限及糖化血红蛋白(HbAlc)、同型半胱氨酸(HCY)高于非认知障碍组(P均<0.05);认知障碍组高密度脂蛋白(HDL-C)水平低于非认知障碍组(P<0.05);两组性别、高血压史、糖尿病史、冠心病史和尿酸(UA)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、脂蛋白a[Lp(a)]水平比较差异无统计学意义(P均>0.05)。见表1。

表1 认知障碍组与非认知障碍组一般资料比较
2.2 认知障碍组与非认知障碍组血清甲状腺激素水平比较 认知障碍组TSH 水平高于非认知障碍组(P<0.05),FT3 水平低于非认知障碍组(P<0.05);两组FT4、TT3、TT4 水平比较差异无统计学意义(P均>0.05)。见表2。
表2 认知障碍组与非认知障碍组血清甲状腺激素水平比较(± s)
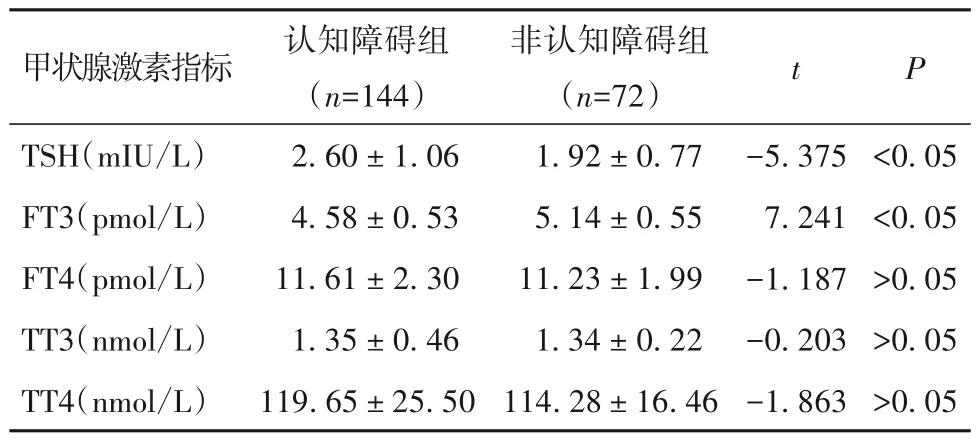
表2 认知障碍组与非认知障碍组血清甲状腺激素水平比较(± s)
?
2.3 血清甲状腺激素水平与CSVD 患者认知障碍的相关性 多因素回归分析结果显示,年龄(OR=1.052,95%CI:1.002~1.103,P<0.05)、HbA1c(OR=2.080,95%CI:1.051~4.117,P<0.05)、HCY(OR=1.082,95%CI:1.011~1.159,P<0.05)、TSH(OR=1.988,95%CI:1.268~3.119,P<0.05)为CSVD 患者认知障碍的危险因素;受教育年限>12 年(OR=0.236,95%CI:0.084~0.660,P<0.05)、HDL-C(OR=0.230,95%CI:0.078~0.672,P<0.05)、FT3(OR=0.203,95%CI:0.102~0.406,P<0.05)为CSVD 患者认知障碍的保护因素。见表3。
2.4 情感障碍与非情感障碍组一般资料比较 共纳入情感障碍组110 例(50.9%),非情感障碍组106例(49.1%)。情感障碍组女性比例、受教育年限<7年比例高于非情感障碍组(P均<0.05);情感障碍组男性比例、受教育年限>12年比例及UA 水平低于非情感障碍组(P均<0.05);两组年龄、高血压史、糖尿病史、冠心病史及HbA1c、TG、TC、HDL-C、LDL、Lp(a)、HCY 水平比较差异均无统计学意义(P均>0.05)。见表4。
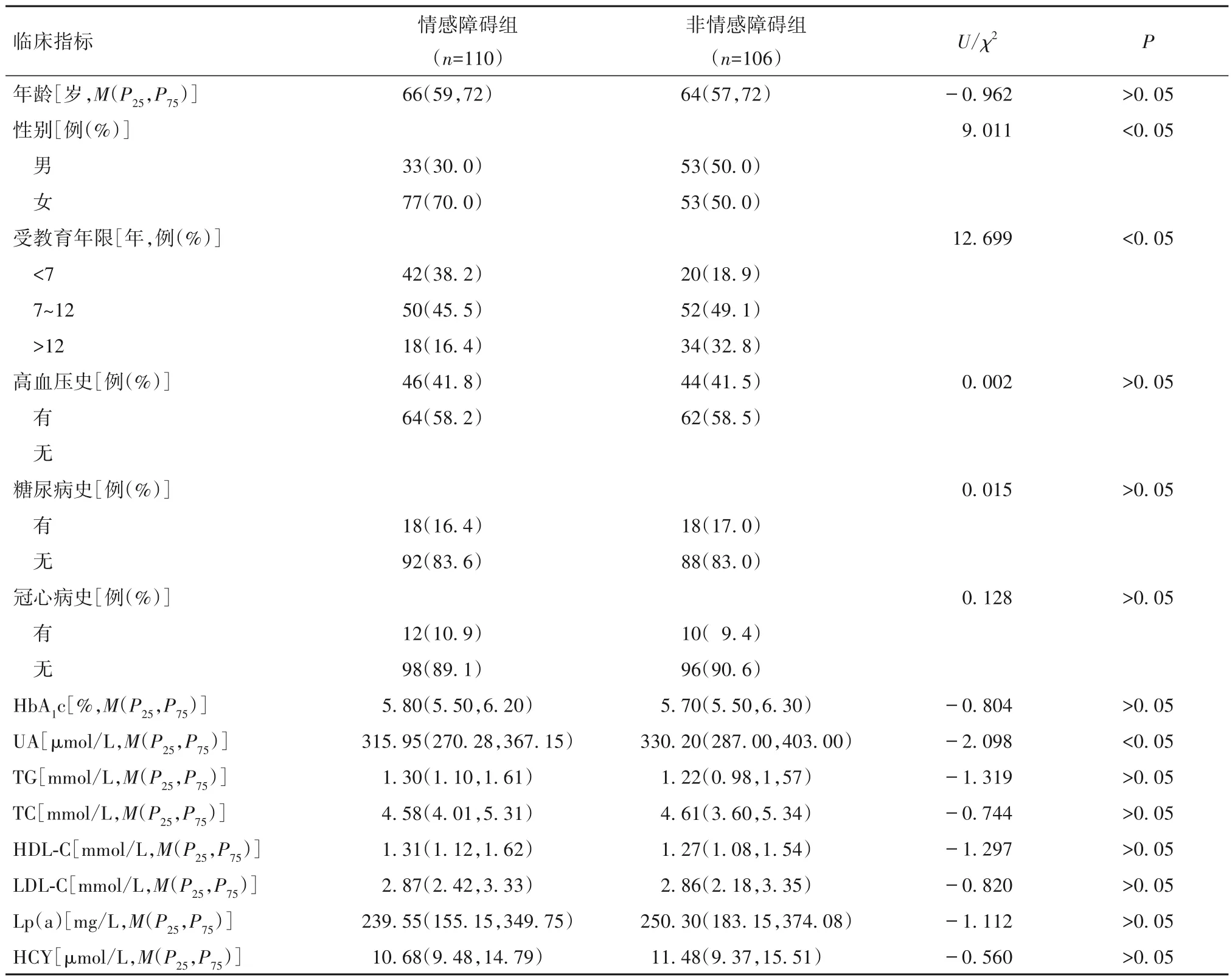
表4 情感障碍组与非情感障碍组一般资料比较
2.5 情感障碍与非情感障碍组血清甲状腺激素水平比较 情感障碍组FT3 水平低于非情感障碍组(P<0.05);情感障碍组FT4 水平高于非情感障碍组(P<0.05);两组TSH、TT3、TT4水平比较差异无统计学意义(P均>0.05)。见表5。
表5 情感障碍组与非情感障碍组血清甲状腺激素水平比较(± s)

表5 情感障碍组与非情感障碍组血清甲状腺激素水平比较(± s)
?
2.6 血清甲状腺激素与CSVD 患者情感障碍的相关性 多因素回归分析结果显示,FT4(OR=2.573,95%CI:1.786~3.707,P<0.05)为CSVD 患者情感障碍的危险因素;男性(OR=0.382,95%CI:0.175~0.830,P<0.05)、受教育年限7~12 年(OR=0.354,95%CI:0.135~0.927,P<0.05)、受教育年限>12 年(OR=0.275, 95%CI:0.092~0.824,P<0.05)、FT3(OR=0.181,95%CI:0.095~0.345,P<0.05)为CSVD患者情感障碍的保护因素。见表6。

表6 CSVD患者情感障碍影响因素的多因素Logistic回归分析
3 讨论
随着年龄的增加,老年人逐渐出现小血管硬化,管腔内径变小,管壁变厚,致使小血管狭窄甚至闭塞,脑血流量自动调节功能受损,低血流量或灌注压使脑组织缺血缺氧,从而促进了认知障碍的发生发展。随着HbA1c 水平的升高,老年人群中认知障碍的发生率亦增高[6]。高血糖所致微血管病变使局部神经元损伤,通过糖基化终末产物蓄积、氧化应激等途径对中枢神经系统产生直接毒性作用。HCY 可参与动脉粥样硬化过程,可通过氧化应激、氨基酸毒性等对神经元产生直接毒性作用,还可导致血管内皮功能受损,使血脑屏障通透性增加,造成脑白质损伤,进而导致认知功能下降[7]。本研究结果显示,年龄、HbA1c、HCY 水平为CSVD 患者认知障碍的危险因素,高文化程度、HDL-C 是CSVD 认知障碍的保护因素。后天增加认知储备可提高认知水平,认知储备可代偿CSVD 所致的处理速度下降、执行功能减退、记忆力下降及步态异常[8]。中年高HDL-C 水平与晚年轻度认知障碍和痴呆症呈负相关[9],较高的血清HDL-C 与更好的执行功能相关[10]。此与HDLC 的抗氧化、抗动脉硬化、抗炎、逆向转运胆固醇、促进内皮功能完善、抗血栓形成等作用密切相关。
甲状腺激素水平与认知障碍的关系在不同人群中被发现。在急性脑梗死人群和2 型糖尿病患者急性脑梗死后认知障碍患者中发现,TSH 可能是认知障碍的独立危险因素,而FT3 是其保护因素[3,11],这与本研究结果一致。卒中恢复期患者中发现血清T3、FT3 水平越低,认知功能损害越严重[12]。血清TSH 水平升高是姿势不稳-步态困难型帕金森病患者发生认知障碍的危险因素。在无痴呆的老年受试者中,低TSH 水平与认知恶化有关[13]。FT3 水平降低,细胞内的DNA、RNA 及蛋白质合成与代谢等能量代谢受到影响,使神经修复受损及神经元死亡;颅内血管血流量减少、流速变慢,影响脑组织的血液灌注,造成相应区域的脑组织代谢异常;还会使乙酰胆碱、神经递质和神经因子的含量受到影响,造成弥漫性神经功能受损,从而导致认知功能障碍。TSH 水平升高会增加氧化应激及神经元死亡,影响血管内血流量及血流灌注区的脑组织代谢等,从而导致认知功能障碍的发生发展[14]。
女性较男性易出现焦虑抑郁情绪,这可能与女性患者的个性及年龄因素等相关的神经内分泌功能失调有关。尿酸不仅是人体正常新陈代谢的产物,还是内源性天然抗氧化剂、自由基清除剂[15]。在帕金森患者中发现,血UA 水平与HAMA 评分及HAMD评分呈负相关[16]。然而本研究在矫正了混杂因素影响后,UA 与CSVD 患者情感障碍无关。高文化程度的CSVD 患者情感障碍发生率低,这可能与教育作为一种刺激、神经突触联系广泛、有更多的情感储备有关。
正常范围内的FT4水平与焦虑和抑郁的严重程度有关[17]。翟姗姗等[18]发现,血清T3水平与抑郁和焦虑程度呈负相关,FT4 水平与抑郁程度呈正相关。冠心病合并抑郁的患者血清FT3水平较无抑郁患者低,重度抑郁组患者FT3 水平下降更为显著[19]。甲状腺激素受体在大脑皮层、海马、杏仁核中都有高水平表达,而海马、杏仁核等与情绪及精神障碍密切相关。甲状腺激素对情绪调节作用的具体途径尚不完全清楚,可能与甲状腺和神经递质系统的相互作用有关,主要是去甲肾上腺素和血清素,这种影响去甲肾上腺素能和5-羟色胺能神经传递的作用,在抑郁发病机制中起关键作用,是目前抗抑郁药治疗的靶点。FT3 除对神经元的发育有重要作用外,还与星形胶质细胞、少突胶质细胞的分化以及小胶质细胞的发育密切相关。因此,甲状腺功能障碍可能损害神经胶质功能,从而干扰大脑,引起精神障碍[20]。血清FT3 水平较低,对缺血时神经保护作用及对神经产生的积极作用较小,导致卒中后抑郁的发生。有研究指出,甲状腺激素会对小脑内的神经元细胞产生影响,导致小脑与默认模式网络间的连接异常,从而引起焦虑障碍的发生[21]。对成人来说,T4 的作用主要在提高中枢神经系统兴奋性上,有研究推测在应对负性生活应激事件时,下丘脑-垂体-甲状腺轴易受到影响,主要表现为T4 水平明显升高,导致机体出现一系列的失眠、情绪问题等[22]。本研究多因素回归分析发现,FT3为CSVD患者情感障碍的保护因素,FT4为CSVD患者情感障碍的危险因素。
综上所述,年龄、HbA1c、HCY、TSH水平为CSVD患者认知障碍的危险因素,高文化程度、HDL-C、FT3水平是CSVD 患者认知障碍的保护因素。FT4 水平为CSVD 患者情感障碍的危险因素;男性、高文化程度、FT3 水平高为CSVD 患者情感障碍的保护因素。但本研究样本量相对较小,且均源于同一医院,可能会存在选择及数据偏倚;研究观察时间短,缺乏对甲状腺激素等数据的重复测量和随访数据;导致认知障碍和情感障碍的因素很多,研究中尚难完全排除。未来会进一步增加样本量、开展多中心研究,并且对患者进行长期随访,增加影响CSVD 患者情感障碍的其他因素,以获得更加全面、准确的临床数据。

