子宫内膜癌血清PDK1、Lin28B、HMGA2变化及意义
何建清,杨立芬,陈莹,宋伟
唐山市妇幼保健院妇产科,河北唐山063000
子宫内膜癌是女性生殖系统中较为常见的恶性肿瘤之一[1],目前该病诊断方式主要有超声、宫腔镜、诊断性刮宫等,但诊断效能均不理想[2-3]。肿瘤标志物是肿瘤细胞生长代谢释放的一种异常物质,其与肿瘤的发生、发展及疗效有一定关系,不同的标志物可用于不同肿瘤的诊断筛查。磷酸肌醇依赖性蛋白激酶1(PDK1)与肿瘤相关信号通路PI3K/Akt、Ras/MAPK、Myc 改变有关[4-5],是治疗肿瘤有潜力但未被充分探索的靶点之一。Lin28 是一种重编程因子和保守RNA 结合蛋白,其中Lin28B 是LIN28 在人类中唯一的同源物,与LIN28 具有相同的结构和部分功能,在许多实体瘤和血液系统恶性肿瘤中过表达[6-7]。高迁移率族蛋白2(HMGA2)可调控蛋白表达,促进肿瘤的发生、发展,对胚胎发生以及致癌过程有调节作用[8-9]。本研究通过检测子宫内膜癌及子宫内膜良性病变患者血清PDK1 水平及组织Lin28B、HMGA2 表达,以探讨三者对子宫内膜癌的诊断价值。
1 资料与方法
1.1 临床资料 选取2022 年1 月—2023 年5 月唐山市妇幼保健院收治子宫内膜癌患者120 例(观察组),年龄(48.38 ± 10.06)岁,病程(13.54 ± 4.67)个月,其中绝经63 例。患者均符合《国际妇产科联盟(FIGO)2018 癌症报告:子宫内膜癌诊治指南》的诊断标准[10],经病理检查确诊为子宫内膜癌,临床病理资料完整。同时排除以下患者:①伴有子宫转移癌;②伴有输卵管、盆腔及其他器官肿瘤;③入院时伴有急性炎症;④术前接受过放化疗或激素治疗。另选取同时期子宫内膜良性病变患者80例(包括子宫内膜息肉58 例,单纯性增生14 例,复杂性增生5例,不规则增殖3 例)为对照组,年龄(48.60 ±10.09)岁,病程(12.84 ± 4.61)个月,其中绝经43例。两组年龄、病程、绝经占比差异无统计学意义(P均>0.05)。本研究经医院伦理委员会批准通过,患者及其家属对研究内容知情同意。
1.2 血清PDK1 检测 收集两组患者空腹静脉血5 mL,静置30 min后以3 000 r/min离心10 min(离心半径为13.5 cm),分离出上清液。使用ELISA 试剂盒对血清PDK1 水平进行检测,严格按照试剂盒说明书操作。
1.3 子宫内膜组织Lin28B、HMGA2 表达检测 采用免疫组织化学法对手术或活检获得的子宫内膜癌组织及良性病变子宫内膜组织中的Lin28B、HMGA2进行检测。具体步骤:常规石蜡包埋切片标记,二甲苯对组织切片进行脱蜡,梯度乙醇水化,蒸馏水震荡冲洗,封闭后抗原修复。采用磷酸缓冲盐溶液(PBS)将兔抗Lin28B、HMGA2 一抗稀释到(1∶50)所需的浓度,切片封闭后滴加Lin28B、HMGA2 一抗过夜。次日,将切片放置在恒温箱中,孵育50 min后将组织切片取出,采用PBS 缓冲液洗涤3 次,每次5 min。随后将50 μL左右的羊抗兔二抗加入到组织切片上,经DAB 显色且苏木素复染后采用蒸馏水冲洗3 次,乙醇梯度水化晾干后采用中性树脂进行封片处理,采用显微镜镜检并进行图像采集分析。Lin28B、HMGA2 阳性判定:随机选取Lin28B、HMGA2 抗体处理切片各5 张,由病理科两位阅历丰富的医师高倍视野(×400)下对着色细胞数和染色程度进行统计,阳性为细胞质、细胞膜出现黄色或者棕黄颗粒。其中染色程度分为不着色(0 分)、淡黄色(1 分)、棕黄色(2 分)、棕褐色(3 分);着色细胞数分为:≤5%(0 分)、>5%~25%(1 分)、>25%~50%(2分)、>50%~75%(3 分)、>75%(4 分),两项分数相乘,以0~2为阴性,>2为阳性,阳性率=阳性例数/总例数×100%。
1.4 统计学方法 采用SPSS26.0 统计软件。计量资料符合正态分布以-x±s表示,组间比较采用t检验。计数资料以例数、百分比表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清PDK1 水平及子宫内膜组织Lin28B、HMGA2 表达 与对照组比较,观察组血清PDK1 水平及子宫内膜组织Lin28B、HMGA2 阳性表达率升高,差异有统计学意义(P均<0.05)。见表1。

表1 两组血清PDK1水平及子宫内膜组织Lin28B、HMGA2表达比较
2.2 不同临床病理特征子宫内膜癌患者血清PDK1 水平及内膜组织Lin28B、HMGA2 表达 不同病理分期、分化程度、肿瘤直径以及有无肌层浸润、淋巴结转移、脉管浸润子宫内膜癌患者血清PDK1水平及内膜组织Lin28B、HMGA2 阳性表达差异有统计学意义(P均<0.05)。见表2。
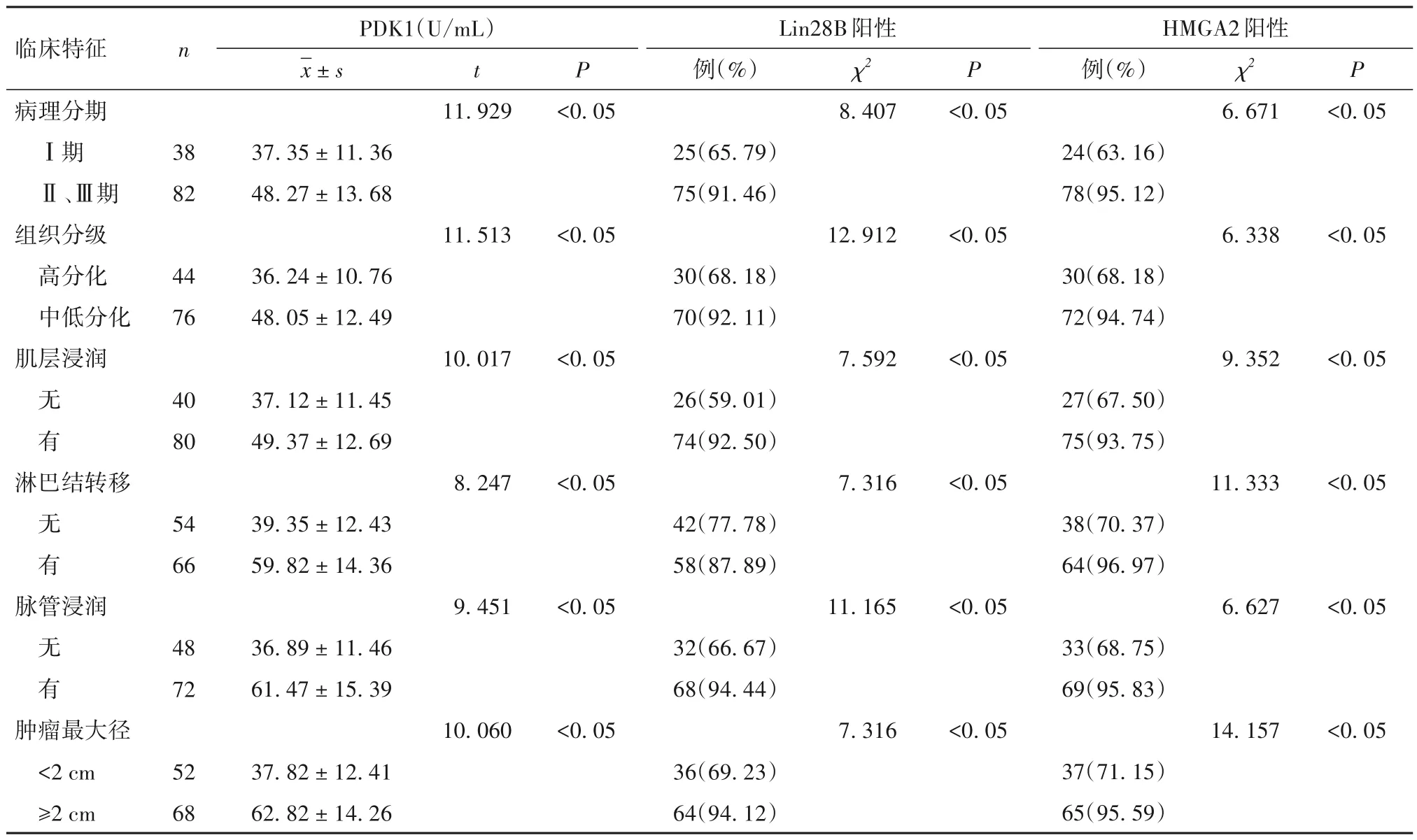
表2 不同临床病理特征子宫内膜癌患者血清PDK1水平及内膜组织Lin28B、HMGA2表达比较
2.3 血清PDK1 及内膜组织Lin28B、HMGA2 表达对子宫内膜癌的诊断价值 以血清PDK1≥47.88 U/mL、子宫内膜组织Lin28B、HMGA2 表达阳性为子宫内膜癌诊断标准,PDK1、Lin28B、HMGA2 单项检测对子宫内膜癌诊断价值均较高,且三项联合检测诊断子宫内膜癌的特异度、阳性预测值高于PDK1、Lin28B、HMGA2单项检测(P均<0.05)。见表3。

表3 PDK1、Lin28B、HMGA2单项及三项联合对子宫内膜癌的诊断价值(%)
3 讨论
近年来,随着医学理论的发展和临床诊治技术的不断进步,子宫内膜癌的早期诊断率明显提高,患者预后显著改善[11]。有研究表明子宫内膜癌早期治疗5 年生存率可达到93%以上,因此早期诊断子宫内膜癌并及时治疗尤其重要[12]。目前子宫内膜癌确切发病原因尚不完全清楚,但已发现多种肿瘤致病基因与子宫内膜癌发生、发展相关,可能是其潜在的肿瘤标志物。此类肿瘤标志物的检测方便、快捷、无创,对子宫内膜癌的早期诊断、筛查有重要意义。
研究显示,PDK1 与肿瘤中的相关信号通路如PI3K/Akt、Ras/MAPK、Myc 改变有关[13];此外,PDK1还对AGC 激酶的磷酸化有重要作用,包括p70 核糖体蛋白S6激酶、血清糖皮质激素调节激酶、p90核糖体蛋白S6 酶和蛋白激酶C 家族成员等[14]。这些蛋白及PDK1 下游效应物的异常激活与肿瘤病理表型有关,如不受控制的细胞复制、细胞凋亡逃逸、侵袭和扩散、转移、代谢重编程和异常血管生成等[15]。本研究中子宫内膜癌患者血清PDK1 水平与病理分期、组织分级、肌层浸润、淋巴结转移、脉管浸润、肿瘤直径有关,提示血清PDK1 水平的升高是导致子宫内膜癌发生的危险因素。以血清PDK1≥47.88 U/mL 为标准诊断子宫内膜癌的灵敏度、特异度较高,检测血清PDK1 水平可早期诊断疑似子宫内膜癌患者,及时干预,控制病情进展。
Lin28 是一种与KLF4、SOX2 和NANOG 协同使用的重编程因子,用于诱导成人成纤维细胞的多能性[16]。Lin28 及其唯一的同源物Lin28B 在人类晚期恶性肿瘤中过表达[17],如乳腺癌、结肠癌、卵巢癌、肺癌等多种常见的肿瘤组织均有Lin28、Lin28B 表达增加的报道[18]。然而,目前对Lin28B 在子宫内膜癌组织中的表达及其临床意义报道较少。本研究中,与子宫良性病变比较子宫内膜癌组织Lin28B 阳性表达率升高,且有淋巴结转移、脉管浸润、肿瘤直径≥2 cm、病理分期较晚、分化程度低、肌层浸润子宫内膜癌患者阳性表达率更高。Lin28B 通过引起相关因子启动子甲基化并对相应基因表达进行调节,进而改变子宫内膜癌生物学行为。Lin28B 阳性表达率高可能提示子宫内膜癌恶性进展及癌细胞转移。
HMGA2属一种非组蛋白染色质因子,在胚胎早期发育中高度表达;随着发育进行,其表达逐渐降低,在分化成熟细胞中几乎不表达[19]。既往研究提示,HMGA2 在卵巢癌组织中表达升高,已被视为一种癌基因,对卵巢癌的诊断有一定参考价值[20]。本研究中,子宫内膜癌组织中HMGA2 阳性表达率较子宫良性病变组织升高,并且肿瘤直径≥2 cm、分化程度低、病理分期较晚、有淋巴结转移及脉管浸润、肌层浸润患者HMGA2 表达更高。HMGA2 能够参与细胞周期控制,调节细胞分化、转录后调控、基因转录及综合性应激反应等生物学行为。HMGA2 是预测子宫内膜癌发生的高能预警指标。
本研究显示,子宫内膜癌患者血清PDK1 水平及子宫内膜组织Lin28B、HMGA2 阳性表达率均较子宫内膜良性病变升高,且升高程度与子宫内膜癌临床特点及生物学行为相关。以血清PDK1≥47.88 U/mL、子宫内膜组织Lin28B、HMGA2 表达阳性为标准,三项联合检测诊断宫内膜癌的特异度、阳性预测值较高,对子宫内膜癌的诊断有重要提示意义。

