乙醇催化氧化反应一体化实验的设计
胡秀美


摘要: 针对教材中乙醇催化氧化反应实验的不足,查阅相关的文献资料,借助Y形管、希夫试剂和铜丝,对该实验进行改进与优化。在Y形管中利用希夫试剂检验反应生成的乙醛,可避免学生直接嗅闻有毒气体。改进实验符合科学性、安全性、节约性等原则。实验操作简单且效果良好,有推广意义。
关键词: 无水乙醇; 催化氧化; 一体化实验; 希夫试剂; 实验改进
文章编号: 10056629(2024)01006503
中图分类号: G633.8
文献标识码: B
1 问题提出
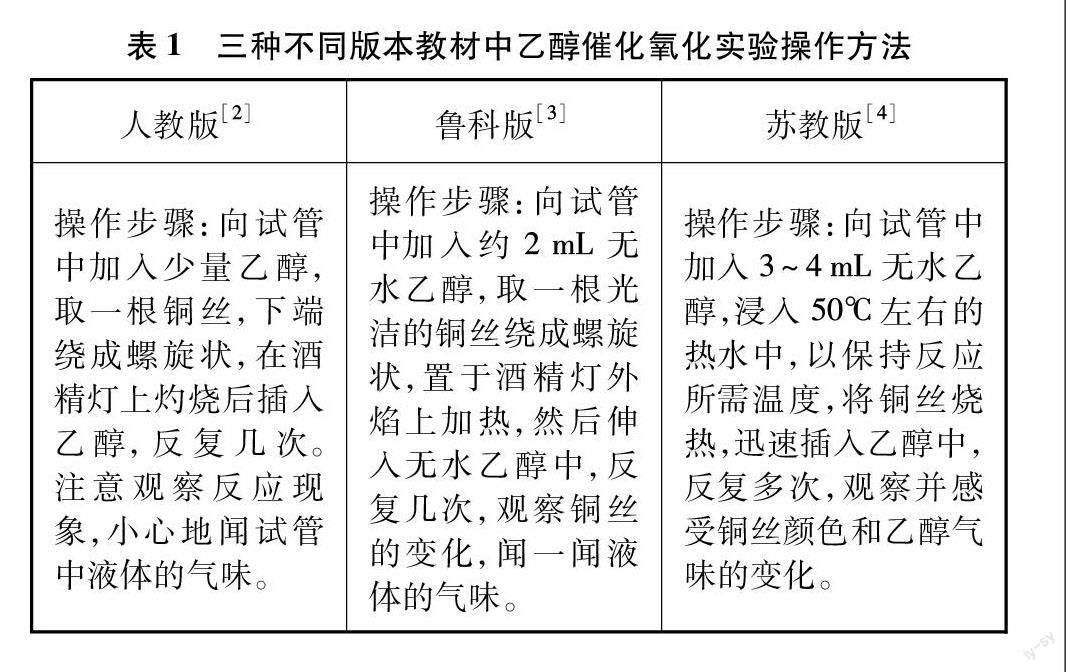
乙醇俗名酒精,是生活中常见的有机化合物,在中学化学教材中占有重要的地位。新课程标准明确要求,乙醇的性质实验是必修课程学生必做的9个实验之一[1]。在人教版、鲁科版、蘇教版三种不同版本的教材中,都用了相似的方法进行乙醇催化氧化实验,其实验操作方法如表1所示。
对比分析三种不同版本教材中该实验的优缺点,其优点为:
(1)用酒精灯直接加热铜丝,铜丝的温度较高,使反应非常剧烈,能快速看到黑色的氧化铜变为红色的铜。
(2)操作简单,铜丝插入到乙醇中,能与乙醇充分接触反应,铜丝的颜色变化明显。缺点为:
(1)反应生成的乙醛较少,乙醛易溶解在乙醇之中,难以闻到气体的刺激性气味。(2)乙醇易挥发,挥发出的乙醇对乙醛的气味有干扰。
(3)乙醛有毒,敞口装置没有对乙醛进行处理,不符合绿色化学理念。
(4)通过嗅闻气味的方法来判断是否有乙醛生成,即使闻到了刺激性气味,也难以说明产物为乙醛,该方法没有足够的说服力。潘虹等人撰文提出[5],热铜丝不仅能将乙醇氧化成乙醛,还可能将乙醇直接氧化成乙酸。因此通过闻气味的方法来证明产物是乙醛缺乏严密性。那么能否设计一种简单快速地检验乙醛的方法呢?
2 文献中乙醇催化氧化改进实验的案例简介
刘全兴在改进实验中[6],使用气唧在装置中鼓入空气,把生成的乙醛通过支管口导入新制的Cu(OH)2悬浊液中,使乙醛能更集中地反应。该方案可以对乙醇的催化氧化产物乙醛进行检验,但操作比较复杂,反应速度也比较慢,短时间内难以检验到有乙醛生成。朱心奇[7]在白色硬纸片上粘上Na2[Cu(OH)4]试纸,将硬纸片穿到铜丝上,一端弯成螺旋状的铜丝插入盛有乙醇的试管中,通过Na2[Cu(OH)4]试纸颜色的变化来检验乙醛,但由于反应过程中产生的乙醛量较少,生成乙醛到试管口时温度已比较低,实验中较难看到Na2[Cu(OH)4]试纸上有砖红色固体生成。伏劲松等[8]使用银氨溶液检验乙醛的生成,利用无水硫酸铜检验生成的水。但改进后的实验装置和操作均较复杂,且在试管中看到银镜产生需要的时间较长,不利于课堂演示或分组实验。
胡崇安等[9]用酸性KMnO4试纸检验乙醛,实验操作非常简单,也能看到KMnO4试纸颜色变浅,由于该实验是放热反应,实验过程中有大量的乙醇变为气体,热的乙醇蒸气也容易使高锰酸钾溶液褪色干扰乙醛的检验。王美志[10]利用乙醇不能使碱性K2MnO4溶液变色,乙醛能使碱性K2MnO4溶液变为绿色来检验乙醛。但由于实验过程中产生的乙醛量较少,且碱性K2MnO4溶液的氧化性较弱,与乙醛反应速度较慢,因此在实验过程中很难观察到溶液的变色。张雪艳[11]把铜丝放在酒精灯外焰上加热,变黑后移到酒精灯内焰灯芯处,利用酒精蒸气与灼热的氧化铜反应,通过闻气味检验乙醛,该装置设计巧妙,操作简单,铜丝颜色变化明显,但无法通过嗅闻气味来检验乙醛,因为灯芯上产生的乙醛向外逸出时已在外焰处燃烧,几乎闻不到刺激性的气味。陈锦等[12]利用希夫试剂检验生成的乙醛,应该比较灵敏,但该实验过程中乙醇挥发得较慢,因而铜丝由红色变为黑色的现象也比较慢。
3 改进思路
高温条件下氧化铜与无水乙醇发生反应,既可以加快反应速率,又能使反应现象更加明显。由于该反应过程中产生有毒的乙醛,本文反应需要在密闭的体系中进行。根据以上条件,确立对该实验的改进思路为:将铜丝在酒精灯上加热至红热状态,保证反应在较高的温度下进行。如图1所示,在Y形管的一端加入希夫试剂,为了防止乙醇变质对乙醛检验的干扰,在希夫试剂中加入几滴无水乙醇,若希夫试剂不变红色,则排除乙醇变质干扰乙醛的检验。在Y形管另一端加入无水乙醇,将弯成螺旋状铜丝的上端插入到橡胶塞中,将红热的弯成螺旋状的铜丝伸入到无水乙醇中,用橡胶塞塞住Y形管口,保证反应在密闭装置内完成。反应结束后,倾斜Y形管将反应后的无水乙醇倒入希夫试剂中,观察实验现象。改进后的一体化实验方案,使实验操作更加简单、现象更加明显,也排除了乙醇变质对乙醛检验的干扰。
4 实验部分
4.1 仪器及用品
酒精灯、Y形管(直径20mm)、铜丝(直径0.5mm)、无水乙醇(分析纯AR)、希夫(Schiff)试剂、橡胶塞
4.2 实验原理
(1) 加热时铜丝变为黑色:2Cu+O2△2CuO;
(2) 氧化铜由黑色变为红色:CuO+CH3CH2OH△
Cu+CH3CHO+H2O;
(3) 总反应为:2CH3CH2OH+O2催化剂△
2CH3CHO+2H2O;
(4) 乙醛的检验使用希夫试剂,希夫试剂又叫品红醛试剂,与醛反应显紫红色[13]。
4.3 实验步骤及现象
(1) 如图1所示,在Y形管的左端加入1mL希夫试剂,然后向其中加入2~3滴无水乙醇。
(2) 在Y形管右端加入1~2mL无水乙醇。
(3) 取一根光洁的铜丝一端绕成多圈螺旋状,将其末端插入橡胶塞中。
(4) 手拿橡胶塞,将螺旋状铜丝置于酒精灯外焰上加热至红热,将红热的铜丝伸入到Y形管的乙醇中,用橡胶塞塞住Y形管口。
(5) 当红热的铜丝在无水乙醇中反应结束后,倾斜Y形管,把右端的液体倒入Y形管的左端,观察实验现象。
上述步骤(1)在希夫试剂中加入2~3滴无水乙醇时,希夫试剂的颜色没有发生变化。将螺旋状铜丝置于酒精灯外焰上加热,铜丝由红色变为黑色后再变成红热状。将红热的铜丝伸入到Y形管的乙醇中,在铜丝的表面有大量的气泡产生,随着反应的进行,铜丝表面的气泡越来越多,铜丝的表面由黑色变为红色,在Y形管口处有白雾产生,Y形管左端的希夫试剂由无色变为浅红色。倾斜Y形管,把右端的液体倒入Y形管的左端,左侧溶液的红色逐渐加深。
4.4 实验结果
在希夫试剂中加入几滴无水乙醇,希夫试剂的颜色没有发生变化,则证明无水乙醇不能使希夫试剂变色,同时也证明无水乙醇中没有乙醛。将红热的铜丝伸入到Y形管右端的乙醇中,在铜丝的表面有大量的气泡产生,随着反应的进行,铜丝表面的气泡越来越多。铜丝表面由黑色变为红色,证明乙醇被氧化铜氧化。希夫试剂由无色变为浅红色,则证明在反应的过程中有乙醛产生,生成的乙醛使希夫试剂变红。开始时希夫试剂变为浅红色,当将右端的液体倒入左端,溶液红色加深,则说明生成的乙醛部分溶解在无水乙醇中。通过实验过程可以看到铜在乙醇的催化氧化中用作催化剂,乙醇被氧化为乙醛,大部分乙醛能溶解在无水乙醇中,逸出的只有少量的乙醛。
4.5 改进实验的优点
(1) 直接在酒精灯上加热铜丝,使铜丝快速升温。
(2) 利用希夫试剂检验乙醛,反应非常灵敏,即使只有少量的乙醛产生,希夫试剂也能变色。
(3) 先在希夫试剂中加入少量乙醇,能排除乙醇对乙醛检验的干扰。
(4) 确保能在密闭容器中反应。
(5) 倾斜Y形管使乙醛和希夫试剂混合,操作十分方便。
(6) 反应及产物检验一体化,既能观察到乙醇催化氧化的整个过程,同时又检验了乙醛的生成。
(7) 实验方便高效,完成一次实验大约只需1分钟左右,且实验现象非常明显。
5 结语
使用Y形管对乙醇催化氧化实验进行一体化改进,既观察到了铜丝颜色的变化,又证明反应生成了乙醛。该实验操作简单、现象明显,在课堂上进行演示实验和分组实验都非常方便。课后若将希夫试剂替换为银氨溶液或新制的氢氧化铜悬浊液,在Y形管的左端使产生光亮的银镜或砖红色沉淀。由于乙醇的催化氧化为放热反应,将反应后的溶液立即倒入到左端的银氨溶液中,不需加热就可以产生光亮的银镜。依托Y形管还可以开发出更多简洁、直观、可视性强的化学实验。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018.
[2]王晶, 郑长龙主编. 普通高中教科书·化学必修第二册[M]. 北京: 人民教育出版社,2019: 78.
[3]王磊, 陈光巨主编. 普通高中教科书·化学必修第二册[M]. 济南: 山东科学技术出版社, 2019: 104.
[4]王祖浩主编. 普通高中化学课程标准实验教科书·化学2(必修)[M]. 南京: 江苏教育出版社, 2014: 70.
[5]潘虹, 杜文敏, 朱华英, 刘怀乐. 乙醇氧化反应实验的再认识[J]. 化学教学, 2016,(5): 58~60.
[6]刘兴全, 王强. 乙醇催化氧化实验的改进方案[J]. 教育与装备研究, 2018,(11): 63~65.
[7]朱心奇. 乙醇氧化生成乙醛实验的改进[J]. 化学教学, 2003,(6): 11.
[8]伏劲松, 黄红梅, 彭蜀晋. 基于催化剂、有机氧化反应概念建构的乙醇氧化实验改进[J]. 化学教学, 2017,(1): 65~67.
[9]胡崇安, 丁伟. 乙醇催化氧化实验的改进[J]. 化学教育, 2011,(12): 71.
[10]王美志. 乙醇催化氧化实验的改进[J]. 化学教学, 2011,(9): 43~44.
[11]张雪艳. 关于铜丝催化氧化乙醇的三个改进实验[J]. 课程教育研究, 2015,(30): 182.
[12]陈锦, 李德前, 石磊. 借助两个注射器改进乙醇的催化氧化实验[J]. 化学教学, 2023,(5): 63~65.
[13]张婧, 牛晨, 韩秋霞, 李明雪. 乙醇催化氧化實验的改进[J]. 化学教学, 2019,(10): 58~61.

