退行性腰椎管狭窄患者椎间孔镜术后下腰痛的危险因素及风险预测模型构建
梁雁冰,王云阁,艾彬彬
(南阳市中心医院 骨三科,河南 南阳 473000)
经皮椎间孔镜手术是临床上针对保守治疗无效且临床症状已经严重影响日常生活工作退行性腰椎管狭窄(degenerative lumbar spinal stenosis,DLSS)患者的常用治疗方式之一,该治疗方式创伤小,可快速解除神经压迫,促进患者腰椎功能恢复[1-2]。但部分研究发现,受到各种因素影响,DLSS患者行手术治疗后仍可出现下腰疼痛现象,影响患者术后恢复,甚至导致疾病复发[3-4]。因此,探寻影响DLSS患者椎间孔镜术后下腰痛发生的危险因素,及时给予干预措施或对症处理,对提高DLSS患者椎间孔镜手术效果和改善患者预后意义重大。基于此,本研究分析DLSS患者椎间孔镜术后下腰痛发生的影响因素,并将相关影响因素构建风险模型,现报告如下。
1 对象和方法
1.1 研究对象
前瞻性纳入南阳市中心医院2020年7月至2022年7月收治的行经皮椎间孔镜手术治疗的DLSS患者为研究对象。本研究经医院伦理委员会审核批准。纳入标准:(1)DLSS符合《腰椎管狭窄症手术治疗规范中国专家共识(2014年)》[5]中相关诊断标准,并经CT、核磁共振等影像学检查确诊;(2)接受经皮椎间孔镜手术治疗;(3)患者签署知情同意书。排除标准:(1)既往有腰椎手术史;(2)术前存在下腰痛症状;(3)合并腰椎先天畸形或发育不全、脊柱骨折等;(4)合并精神疾病或认知障碍;(5)合并心、肺、肾等重要器官疾病;(6)合并感染性疾病。脱落标准:随访期间失访或自动退出。
根据上述标准共纳入86例DLSS患者,其中男52例,女34例;年龄40~65岁,平均(52.65±5.65)岁,体重指数(body mass index,BMI)21.0~26.7 kg·m-2,平均(23.39±2.02)kg·m-2;腰椎狭窄阶段L2~318例,L3~421例,L4~523例,L5~S124例。
1.2 研究方法
1.2.1下腰疼痛评估
所有患者行经皮椎间孔手术治疗后随访3个月,术后3个月返院复查,采用视觉模拟评分法[6]评估患者下腰疼痛情况,总分0~10分,0分表示无疼痛,10分表示能想象到的最严重的疼痛,本研究将视觉模拟评分法评分≥2分者判定为发生下腰疼痛,反之则为未发生。
1.2.2美国麻醉医师学会分级[7]评估
Ⅰ级为患者无全身性疾病,对麻醉及手术均有良好耐受性,一般情况下无风险;Ⅱ级为患者重要器官(心、肺、肾、肝和中枢系统)存在轻度病变。但补偿性功能健全,可耐受多数手术、麻醉;Ⅲ级为患者重要器官(心、肺、肾、肝和中枢系统)存在重度病变,但功能尚能代偿,麻醉及手术有一定风险。
1.2.3资料收集
设计一般资料调查表,包括性别,年龄,BMI,合并症(糖尿病、高血压、骨质疏松),ASA分级,腰椎狭窄节段,术中清理椎间隙,术后椎管内无菌性炎症和首次锻炼时间。
1.3 统计学方法

2 结果
2.1 术后下腰疼痛发生情况
随访3个月,86例DLSS患者行椎间孔镜术后发生下腰痛患者21例,发生率为24.42%(21/86)。
2.2 一般资料
发生组骨质疏松占比、术中清理椎间隙占比、术后椎管内无菌性炎症占比、首次锻炼时间高于未发生组(P<0.05)。两组其余资料比较,差异无统计学意义(P>0.05)。见表1。
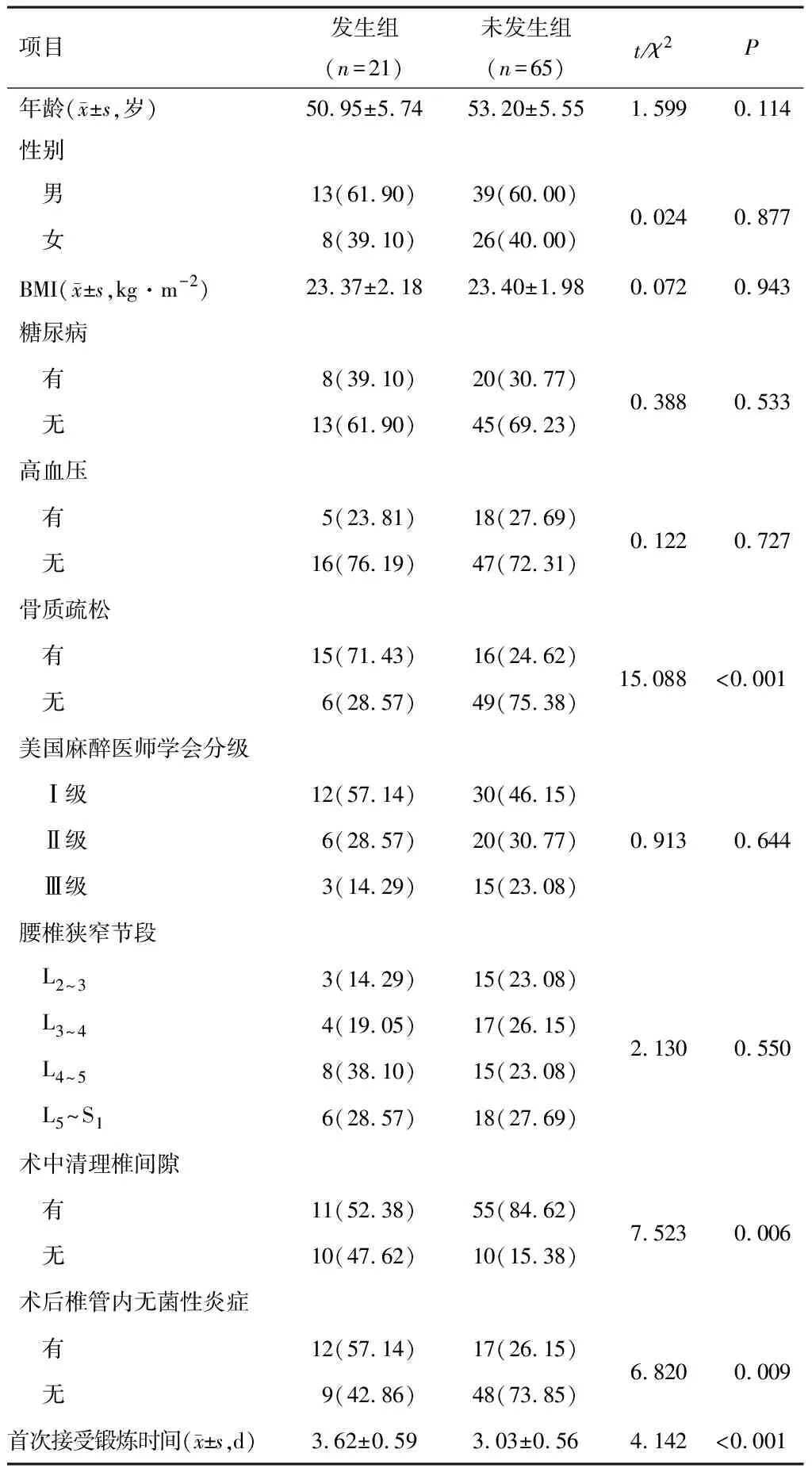
表1 两组患者一般资料比较
2.3 影响DLSS患者椎间孔镜术后下腰痛发生的logistic回归分析
将DLSS患者椎间孔镜术后下腰痛发生情况作为因变量(未发生=0,发生=1),将表1中差异有统计学意义的相关因子作为自变量,相关因素赋值见表2,采用多因素logistic回归分析,结果显示,骨质疏松、术中清理椎间隙、术后椎管内无菌性炎症、首次接受锻炼时间均是DLSS患者椎间孔镜术后下腰痛发生的危险因素(P<0.05)。见表3。

表2 自变量赋值情况

表3 影响DLSS患者椎间孔镜术后下腰痛发生logistic回归分析
2.4 DLSS患者椎间孔镜术后下腰痛发生的风险模型构建
根据表3中的回归系数构建影响DLSS患者椎间孔镜术后下腰痛发生的风险预测模型,采用Bootstrap内部验证法验证风险预测模型的区分度,如图1所示,C-index=0.870,说明该模型具有良好的区分度。绘制标准曲线对风险模型进行内部验证,如图2,校准曲线和Y-X直线相近,模型准确度良好。
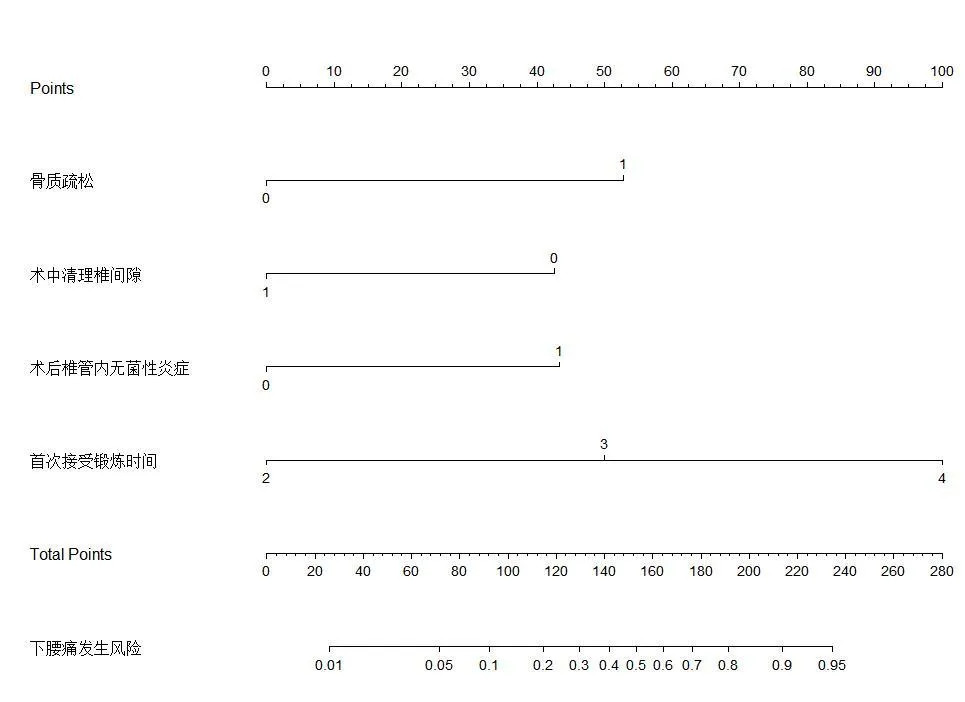
DLSS为退行性腰椎管狭窄。

图2 风险图校准曲线
2.5 DLSS患者椎间孔镜术后下腰痛发生风险预测评估效能
绘制ROC曲线对DLSS患者椎间孔镜术后下腰痛发生风险预测模型进行验证,风险模型评估DLSS患者椎间孔镜术后下腰痛的AUC为0.870,AUC的95% CI为0.779~0.961,P<0.001,敏感度0.810,特异度0.815,约登指数0.625,说明该风险预测模型具有良好预测效能。
3 讨论
经皮椎间孔镜手术是治疗DLSS的有效外科手段,可在极大程度上改善患者腰椎狭窄状况,但手术过程中对机体纤维组织的损伤及神经刺激易引起患者术后下腰疼痛[8]。本研究结果显示,86例DLSS患者行经皮椎间孔镜术治疗后发生下腰痛21例,占比24.42%,与余泳[9]研究相比略高,临床应给予重视。其中部分患者下腰疼痛反复发作,最终引起下肢放射性疼痛,影响患者手术效果及生活质量。因此,探寻影响DLSS患者术后下腰痛的危险因素,对临床及早制定干预措施具有重要意义。
本研究中,发生组患者合并骨质疏松、术后椎管内无菌性炎症、术中清理椎间隙占比以及首次接受锻炼时间均高于未发生组,且经logistic回归分析,合并骨质疏松、未清理椎间隙、有术后椎管内无菌性炎症、首次接受锻炼时间长均是DLSS患者行椎间孔镜术后发生下腰痛的独立影响因素。分析原因如下。骨质疏松:随着患者年龄增加,椎体及周围软组织逐渐退化,当周围神经末梢受到牵拉时则会引起疼痛,而骨质疏松导致机体负重能力下降,更易引起椎体和周围软组织的退行性病变,增加椎体和周围软组织张力,进而引发下腰疼痛[10]。对此,建议针对合并骨质疏松的DLSS患者术后应给予积极抗骨质疏松治疗,避免下腰痛的发生。术中清理椎间隙:术中清理椎间隙残留组织可预防术后残留组织对神经的压迫,同时术中清理残留组织过程中需要持续灌洗,生理盐水的大量冲洗不仅增加椎间盘含水量,减少椎间感染,改善椎间盘病变,促进骨融合,还降低术后下腰痛的发生率[11]。对此,建议术中尽可能清理椎间隙残留组织,避免术后下腰痛发生。术后椎管内无菌性炎症:术后椎管内无菌性炎症是DLSS患者术后常见并发症之一,术中清除纤维组织和退变髓核等操作时可增加炎症介质的释放,对硬膜囊和行走根产生刺激,引起疼痛感,而疼痛感可进一步刺激炎症介质释放,造成恶性循环[12]。同时,手术操作引起应激反应,引起毛细血管增生,促进局部新肉芽组织形成,导致新肉芽组织对窦椎神经造成压迫,引起术后下腰痛。对此,建议对术后出现椎管内无菌性炎症的DLSS患者,应及时采取对症措施(冰敷、热敷、抗炎治疗),避免术后下腰痛发生。首次接受锻炼时间:术后早期行功能锻炼可预防神经粘连,加速融合,促进患者术后功能恢复,而部分患者因术区疼痛及心理作用导致术后首次下地时间延长,肢体功能无法及时得到有效锻炼,致使机体血液长时间处于高凝状态,导致血液循环不畅,造成腰背肌肉出现不同程度的萎缩,进而引发下腰痛[13]。对此,建议医护人员及时评估患者术后心理和机体状态,给予心理辅导和正确锻炼指导,争取患者尽早下床活动。
4 结论
DLSS患者行椎间孔镜术后下腰痛发生率较高,合并骨质疏松、术中未清理椎间隙、有术后椎管内无菌性炎症、首次接受锻炼时间延长均是DLSS患者行椎间孔镜术后发生下腰痛的危险因素,基于以上因素构建的风险模型对DLSS患者行椎间孔镜术后是否发生下腰痛具有较高的评估价值。

