circPDE3B在食管鳞状细胞癌组织中的表达及对癌细胞生物学行为的影响
郑钊洋,王献增,张 曼,陈双双,杨 莹,刘红春
1)河南中医药大学第二附属医院检验科 郑州 450002 2)林州市人民医院胸外科 河南安阳 456550 3)郑州大学第一附属医院检验科 郑州 450052
我国是世界上食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)高发国家之一,ESCC患者的5 a生存率仅有20%~35%,且复发风险较高[1-2]。环状RNA(circular RNA,circRNA)是一类新发现的非编码RNA,在人体组织中广泛表达[3]。研究[4]表明,circRNA在恶性肿瘤中异常表达,并且可作为蛋白质诱饵、miRNA海绵参与转录和剪接的调节,参与肿瘤的发生发展。有研究[5-7]发现多种circRNA在ESCC进展中起重要作用。本研究检测ESCC组织和细胞中circPDE3B的表达,构建敲低circPDE3B表达的KYSE150细胞,探讨circPDE3B对ESCC细胞恶性生物学行为的影响;采用双荧光素酶报告实验验证circPDE3B靶向miR-1294的结合位点,探讨circPDE3B/miR-1294调控轴对ESCC发生发展的影响,以期为食管癌早期诊断标志物以及潜在治疗靶点的开发提供新思路。
1 材料与方法
1.1 临床组织标本选取2020年1月至2022年1月郑州大学第一附属医院临床病理信息完整的ESCC患者30例,其中男21例,女9例,年龄45~83岁。在手术切除之前,患者均未接受过化学治疗、放射治疗或免疫治疗,所有患者均在手术前签署知情同意书。本研究由该院医学伦理委员会批准(2021-KY-1131-002)。收集切除的癌组织及相应的癌旁(距原发灶5 cm以外)正常食管组织,用以检测circPDE3B的表达。
1.2 细胞和主要试剂ESCC细胞系KYSE30、EC9706、ECA109、KYSE150,正常食管上皮细胞系HEEC和人胚胎肾细胞系293T均购自上海市生命科学院细胞中心;RPMI 1640培养基、胎牛血清和青霉素-链霉素购自上海源培生物科技股份有限公司;反转录试剂盒和PCR试剂盒购自日本TaKaRa公司;si-circRNA、si-NC、miR-1294 inhibitor、inhibitor NC、miR-1294 mimic及mimic NC均购自上海吉玛制药有限公司;双荧光素酶报告实验试剂盒购自美国Promega公司;Trizol试剂和Lipofectamine 3000试剂盒购自美国Invitrogen公司;CCK-8试剂盒购自武汉亚科因生物科技有限公司;基质胶和Transwell小室购自美国Corning公司。
1.3 组织和细胞中circPDE3B和miR-1294表达的qRT-PCR检测使用Trizol提取组织和细胞中的总RNA,用反转录试剂盒反转录为cDNA,然后进行qPCR。反应体系20 μL:上、下游引物各1 μL, SuperMix 10 μL,模板1 μL,RNase Free Water 7 μL;反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸10 s,40个循环;最终72 ℃ 10 min中止反应。qPCR在QuantStudio 12K Flex系统上进行。采用2-ΔΔCt法测定靶基因相对表达水平。以GAPDH作为circPDE3B的内参基因,U6作为miR-1294的内参基因。引物序列见表1。

表1 引物序列
1.4 细胞分组与转染在37 ℃、体积分数5%CO2条件下培养KYSE150细胞,细胞复苏贴壁后每隔3 d传代1次。将处于对数生长期的细胞以2×105个/孔的密度接种到60 mm培养板上,细胞融合度达50%~60%时,采用Lipofectamine 3000试剂进行转染,严格按照试剂说明书操作,分别转染si-NC、si-circPDE3B#1、si-circPDE3B#2、si-circPDE3B#1+inhibitor NC、si-circPDE3B#1+miR-1294 inhibitor 48 h。
1.5 细胞增殖的CCK-8法检测将转染第1、2、3、4天后的KYSE150细胞接种到96孔板中,每孔注入100 μL细胞悬液(3×104个/mL),孵育24 h后加入10 μL CCK-8溶液,2 h后用酶标仪测定450 nm处的吸光度值。实验重复3次。
1.6 细胞克隆形成实验转染48 h后的细胞以1 000个/孔的密度接种到12孔板,孵育10 d后取出,PBS冲洗,多聚甲醛固定,结晶紫染色,Image J软件计数克隆形成的细胞团数量。每个克隆直径0.3~1.0 mm,含有50个以上的细胞团。实验重复3次。
1.7 划痕实验当KYSE150细胞融合达到90%~100%时,用200 μL吸管尖端在细胞板上画三条相互平行的轨迹。PBS冲洗,加入无血清培养基继续培养。观察划痕实验中细胞愈合情况,48 h后比较划痕愈合率。划痕愈合率=(初始划痕面积-48 h后划痕面积)/初始划痕面积×100%。实验重复3次。
1.8 细胞迁移和侵袭的Transwell实验用基质胶覆盖的Transwell小室进行细胞侵袭实验,不覆盖的进行细胞迁移实验。以无胎牛血清的培养基调整KYSE150细胞密度为2×105个/mL。取200 μL细胞悬液接种于上室,底部小室装入650 μL含体积分数20%胎牛血清的培养基,孵育36~48 h后取出,用多聚甲醛固定,结晶紫染色。在100倍倒置显微镜下拍摄,并用Image J软件计数跨膜细胞。实验重复3次。
1.9 双荧光素酶报告实验扩增野生型circPDE3B(circPDE3B WT)或突变型circPDE3B(circPDE3B MUT)序列,并将其插入到pmirGLO双荧光素酶载体中。将上述报告载体分别与miR-1294 mimic或mimic NC共转染293T细胞。48 h后使用双荧光素酶报告分析系统检测荧光素酶活性。
1.10 统计学处理ESCC组织和癌旁正常食管组织中circPDE3B表达的比较采用配对样本t检验;5种细胞中circPDE3B表达,si-NC组、si-circPDE3B#1和si-circPDE3B#1+inhibitor NC组,以及si-NC组、si-circPDE3B#1、si-circPDE3B#1+inhibitor NC组和si-circPDE3B#1+miR-1294 inhibitor组细胞增殖能力、克隆形成数、划痕愈合率、迁移细胞数和侵袭细胞数的比较均采用单因素方差分析和SNK-q检验。
检验水准α=0.05。
2 结果
2.1 ESCC组织和细胞中circPDE3B的表达ESCC组织中circPDE3B的表达(3.07±2.95)高于癌旁正常食管组织(1.45±1.34)(t配对=2.879,P=0.007);与HEEC细胞相比, EC9706、ECA109和KYSE150细胞中circPDE3B的表达升高,KYSE150细胞最高(表2)。选择KYSE150细胞进行后续实验。

表2 5种食管上皮细胞中circPDE3B的表达
2.2 敲低circPDE3B表达对KYSE150细胞增殖、迁移和侵袭的影响与si-NC组比较,si-circPDE3B#1和si-circPDE3B#2组细胞增殖受抑,circPDE3B表达降低,克隆形成数、迁移细胞数和侵袭细胞数减少,划痕愈合率降低(表3、4)。
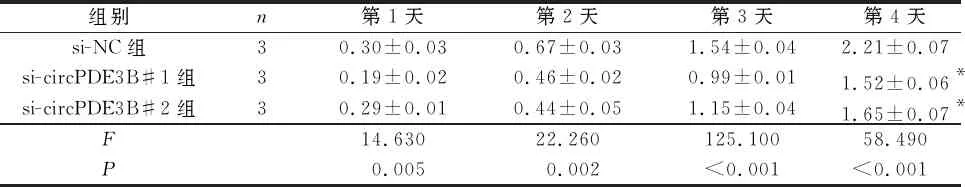
表3 3组KYSE150细胞吸光度值比较

表4 3组KYSE150细胞circPDE3B表达、克隆形成数、划痕愈合率、迁移细胞数和侵袭细胞数比较
2.3 circPDE3B和miR-1294靶向关系验证通过CircInteractome数据库预测出circPDE3B可靶向miR-1294的结合位点(图1)。将携带circPDE3B WT和circPDE3B MUT的报告载体分别与miR-1294mimic和mimic NC共转染入293T细胞内,结果显示circPDE3B WT和miR-1294 mimic共转染组的荧光素酶活性降低(表5)。
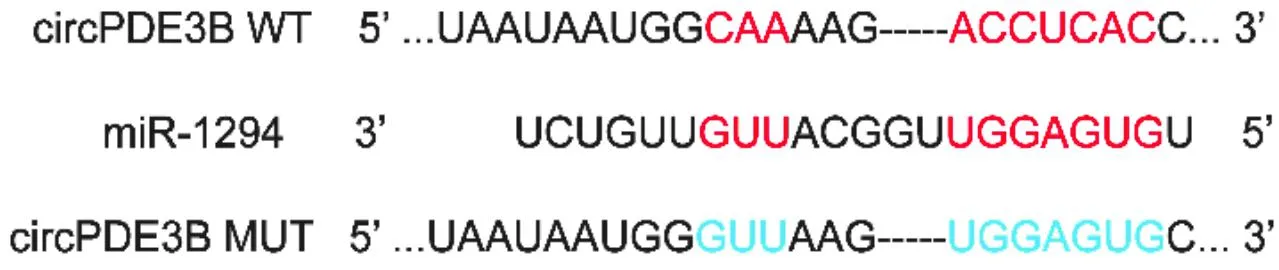
图1 circPDE3B与miR-1294的靶向关系

表5 双荧光素酶报告实验结果(n=3)
2.4 miR-1294 inhibitor对敲低circPDE3B表达的KYSE150细胞增殖、迁移和侵袭的影响与si-NC组比较,si-circPDE3B#1和si-circPDE3B#1+inhibitor NC组KYSE150细胞增殖受抑,克隆形成细胞数、迁移细胞数和侵袭细胞数减少,划痕愈合率降低;miR-1294 inhibitor可部分逆转以上变化(表6、7)。

表6 4组KYSE150细胞吸光度值比较
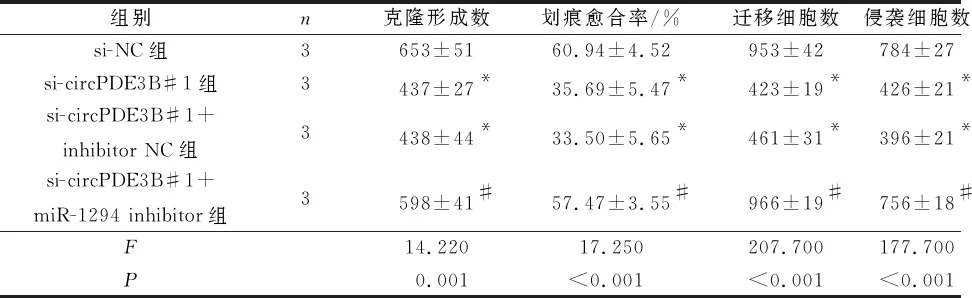
表7 4组KYSE150细胞克隆形成数、划痕愈合率、迁移细胞数和侵袭细胞数比较
3 讨论
多项研究[8-10]表明circRNA在食管癌中异常表达,并且能够通过“海绵作用”调控下游miRNA的表达,进而抑制或促进食管癌的进展。食管癌组织中circ_0006168高表达,且能够靶向调节miR-100/mTOR,促进食管癌的进展[11];高表达circ_0004771可通过作用于miR-339-5p/CDC25A通路,从而调节恶性食管癌的进展[12];在食管癌组织和细胞中,高表达的circ_0006948可直接与miR-490-3p结合,靶向癌基因高迁移率蛋白A2的3'UTR,进而诱导食管上皮间质转化[13]。本研究结果显示ESCC组织和细胞中circPDE3B表达升高,敲低circPDE3B可以抑制ESCC细胞的增殖、克隆形成、迁移和侵袭能力。
作为一组内源性非编码小RNA分子,miR-1294在食管癌中的异常表达越来越受到重视[14-16]。Zong等[17]发现,LncRNA TUG1可通过负调节miR-1294的表达,促进食管癌细胞的凋亡。最新的研究[14]表明,miR-1294不仅能抑制ESCC细胞增殖、迁移、侵袭,还可诱导细胞周期停滞在G0/G1期,发挥抑癌作用。本研究中双荧光素酶报告实验结果显示miR-1294和circPDE3B有靶向关系,抑制miR-1294可以部分逆转敲低circPDE3B导致的ESCC细胞增殖受抑,克隆形成数、迁移细胞数和侵袭细胞数减少,划痕愈合率降低。
总之,ESCC中circPDE3B表达上调,circPDE3B可能通过miR-1294影响ESCC细胞的增殖、迁移和侵袭。