骨髓巨噬细胞M2亚型共培养后的骨髓间充质干细胞移植治疗肝硬化大鼠模型的效果分析
郑欣瑞,许燕楠,王丹阳,邢飞飞,宗梦瑶,张士豪,战俊邑,刘 伟,陈高峰,陈佳美,刘 平,慕永平
上海中医药大学附属曙光医院,上海市中医药研究院肝病研究所,肝肾疾病病证教育部重点实验室,上海市中医临床重点实验室,上海 201203
肝移植是国际公认的终末期肝硬化的最佳治疗手段[1],但受制于供体缺乏、费用昂贵以及移植相关并发症等限制,使部分患者在等待供肝期间死亡[2-4]。近年来,干细胞移植成为肝硬化治疗研究的新热点,尤其自体骨髓来源间充质干细胞(bone marrow-derived mesenchymal stem cell,BMSC)具有易获取、无排异反应及伦理问题等优势,已在乙型肝炎肝硬化、酒精性肝硬化等治疗中初显成效[5-8],但也有研究[9]发现BMSC 移植后具有向肌成纤维细胞分化的潜能。因此,如何提高BMSC 治疗终末期肝硬化的效果显得尤为重要。课题组前期研究[10]表明,骨髓来源巨噬细胞(bone marrow-derived macrophage,BMDM)M2 亚型(M2-BMDM)可有效抑制四氯化碳(CCl4)诱导大鼠肝纤维化进展,BMSC 移植可有效抑制胆汁性肝纤维化进展[11]。但来源于M2-BMDM生长微环境的BMSC(命名为BMSCM2)移植是否能够进一步提高其对肝硬化的治疗效应尚不清楚。本研究观察了BMSCM2移植对CCl4/2-乙酰氨基芴(CCl4/2-acetylaminofluorene,CCl4/2-AAF)诱导大鼠肝硬化进展的影响。
1 材料与方法
1.1 材料 小鼠肌成纤维细胞L929细胞株购于中国科学院细胞库。DMEM/F12(Dulbecco’s Modified Eagle Media:Nutrient Mixture F-12)细胞培养基购于GIBICO 公司。BMSC 成脂诱导试剂盒(RAXMX-90031)、BMSC 成骨诱导试剂盒(RAXMX-90021)购于Cyagen公司,BMSC细胞周期检测试剂盒(C543)购于DOJINDO公司。α-平滑肌肌动蛋白抗体(α-smooth muscle actin,α-SMA,ab124964)、CD68 抗体(ab125212)、肝细胞核因子4α 抗体(hepatocyte nuclear factor 4 alpha,HNF-4α,ab41898)、Sox9(sex determining region Y-box 9)抗体(ab185230)、上皮细胞黏附分子抗体(epithelial cell adhesion molecule,EpCam,ab71916)均购于Abcam 公司;3-磷酸甘油醛脱氢酶抗体(GAPDH,60004-1-Ig)、细胞角蛋白7 抗体(cytokeratin7,CK7:15539-1-AP)、CK19 抗 体(10712-1-AP)均购于Proteintech 公司;白蛋白抗体(Alb,sc271605)购于Stan cruz Biotechnology 公司。实时荧光定量聚合酶链式反应(RT-PCR)引物序列由Takara 公司设计合成,逆转录试剂盒购自Takara 公司,Synergy Brands(SYBR)荧光染料购自TOYOBO 公司。肝组织羟脯氨酸(hydroxyproline,Hyp)含量测定试剂盒购于南京建成生物工程研究所。
1.2 大鼠BMDM分离、极化及鉴定 参照课题组已经建立的方法[10]。分离得到的BMDM 使用DMEM/F12+20%L929+10% FBS培养7 d后,即可获得成熟的M2-BMDM。
1.3 大鼠BMSC 的分离与鉴定 参照课题组已经建立的方法[11]分离大鼠BMSC,诱导成脂、成骨分化,并鉴定细胞周期。
1.4 实验动物 Wistar 雄性大鼠24 只,SPF 级,体质量160~180 g,购自上海斯莱克实验动物有限公司,实验动物生产许可证编号:SCXK(沪)2022-0004,于上海中医药大学实验动物中心饲养、造模和观察,实验动物使用许可证编号:SYXK(沪)2014-0008。
1.5 模型制备与分组干预 采用30% CCl4-橄榄油溶液2 mL/kg 皮下注射,每周2 次,共计6 周制备大鼠肝硬化模型。第7周开始,模型大鼠随机分为模型组(M 组)、BMSC 组、BMSCM2组,每组6 只。在继续30% CCl4-橄榄油溶液造模的同时,予以2-AAF 10 mg·kg-1·d-1灌胃以抑制肝细胞增殖,制备CCl4/2-AAF 大鼠肝硬化模型。于第7 周开始,将BMSC 和BMSCM2经尾静脉以单次注射的方式移植至大鼠体内,注射剂量为1×106cells/只。同时设正常对照组(N 组,n=6)。10 周末取材,留取血清及肝组织标本。
1.6 血清生化学检测 血清ALT 和AST 活性检测由上海中医药大学附属曙光医院检验科完成。
1.7 肝组织Hyp含量测定 参考文献[12]中的方法使用试剂盒检测。
1.8 肝组织病理和免疫组化染色方法 石蜡固定组织切片,厚4 μm,以进行HE、天狼星红、免疫组化染色。参考文献[13]中的方法进行免疫组化。组织切片脱蜡修复封闭后,α-SMA(1∶2 000)、CD68(1∶1 000)、EpCam(1∶500)、Sox9(1∶1 000)、CK7(1∶400)、CK19(1∶1 000)、HNF-4α(1∶400)、Alb(1∶50)等一抗孵育1 h,HRP 标记的二抗(1∶1 000)孵育30 min,洗涤,DAB 显色,苏木精对比染色,Leica SCN 400扫描仪扫描。
1.9 RT-PCR TNF-α、TGF-β1、CD68、α-SMA、EpCam、Sox9、CK7、CK19、HNF-4α、Alb mRNA 表达采用定量RTPCR 方法检测。总RNA 提取采用RNA 纯化试剂盒(Lot.250800,Toyobo 公司),mRNA 表达检测采用SYBR Green real-time PCR Master Mix(SYBR)(Lot.411900)(Toyobo 公司,Osaka,Japan),以及ViiA™ 7 real-time PCR System(ABI,American)。引物由Takara 公司设计合成(Takara Chemical)。SYBR 一步法RT-PCR 反应条件如下:42 ℃ 15 min、95 ℃ 2 min、95 ℃变性15 s,40 个循环,60 ℃延伸退火1 min。
1.10 免疫印迹 肝组织采用RIPA 缓冲液裂解,4 ℃17 000×g离心10 min,测定上清液蛋白浓度,10%凝胶电泳,转移至PVDF 膜上,5% BSA 混合溶液封闭1 h,一抗4 ℃孵育过夜,α-SMA(1∶2 000)、CD68(1∶2 000)、GAPDH(1∶10 000);二抗(1∶1 000)室温下孵育1 h,ECL法显影,使用image J分析计算灰度值积分。
1.11 统计学方法 采用SPSS 25.0 统计软件进行数据分析。计量资料用表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 BMDM 及BMSC的分离、培养与鉴定 本实验所分离的BMSC 符合漩涡状生长的细胞形态(图1a),成骨诱导发现BMSC周围有明显茜素红染色的钙结节样沉淀物(图1b)。成脂诱导显示BMSC 周围出现空泡样的脂滴,油红O 染色脂滴呈橘红色(图1c)。流式细胞仪分析显示,M2-BMDM 细胞CD206+95.5%(图1d);BMSC 细胞CD45-99.9%,CD90+99.9%,CD29+99.9%,且G1 期细胞占比为78.2%(图1e~f)。
2.2 抑制肝脏炎症反应的作用比较 HE 染色显示,M组大鼠肝组织可见大量肝细胞脂肪变性,纤维间隔可见大量炎性细胞浸润;与M 组比较,BMSC 组和BMSCM2组大鼠肝组织炎性细胞浸润和脂肪变性明显减少,尤以BMSCM2组改善更为明显(图2a)。
血清学检测结果显示,与N 组比较,M 组大鼠血清ALT、AST 活性显著升高(P值均<0.01);与M 组比较,BMSC 组和BMSCM2组ALT、AST 活性显著降低(P值均<0.01),且BMSCM2组ALT、AST 活性显著低于BMSC 组(P值均<0.05)(图2c)。
此外,与N 组比较,M 组肝组织TNF-α、TGF-β1、CD68 mRNA 表达水平显著增加(P值均<0.01);与M 组比较,BMSC 组和BMSCM2组TNF-α、TGF-β1mRNA 水平均显著降低(P值均<0.05),且BMSCM2组TNF-α、TGF-β1 mRNA 水平显著低于BMSC 组(P值均<0.05)(图2d)。CD68的免疫组化及蛋白印迹显示相同的趋势(图2e~f)。
2.3 抑制肝硬化进展的作用比较 天狼星红胶原染色显示,M 组大鼠肝组织胶原沉积明显增加,已形成完整假小叶结构;与M 组比较,BMSC 组和BMSCM2组胶原沉积明显减轻,尤以BMSCM2组改善更为明显(图3)。
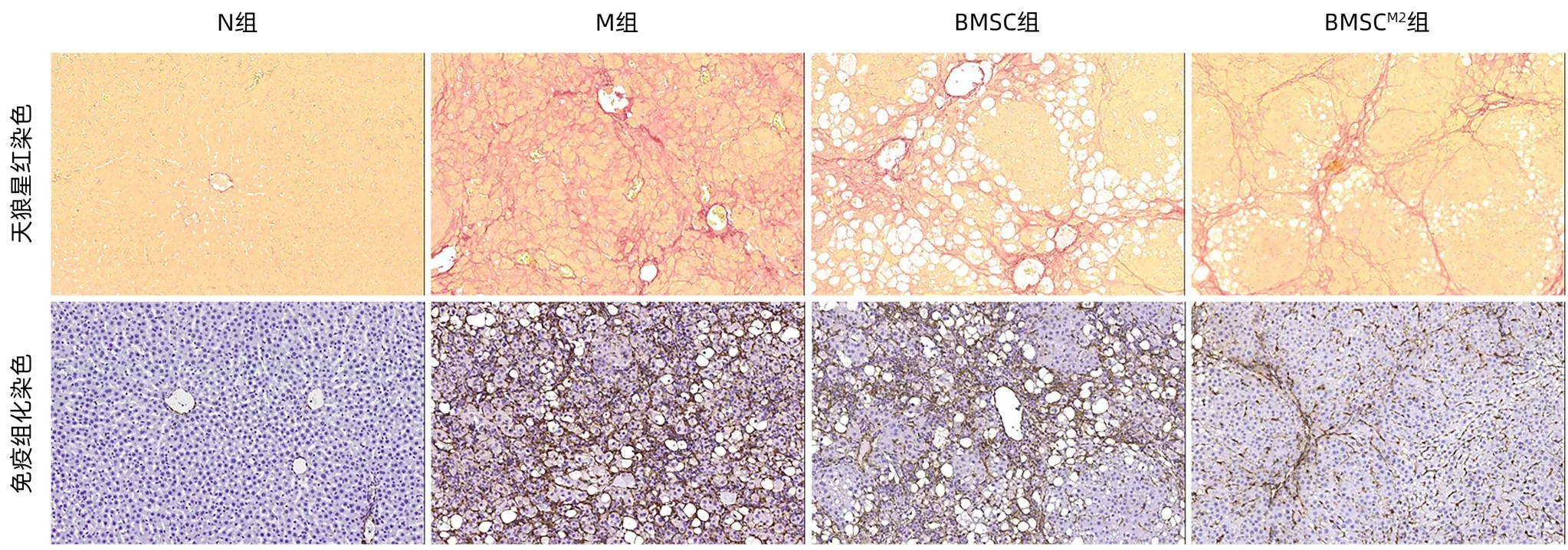
图3 天狼星红染色和α-SMA免疫组化染色结果(×200)Figure 3 Sirius red staining and α-SMA immunohistochemical staining results(×200)
肝组织Hyp含量检测显示,与N组比较,M 组Hyp含量显著增加(P<0.01);与M 组比较,BMSC 组和BMSCM2组Hyp 含量显著降低(P<0.05)(图4a)。免疫组化染色显示,与N 组比较,M 组肝组织α-SMA 阳性表达明显增加;与M 组比较,BMSC 组和BMSCM2组α-SMA 阳性表达均明显减少,且BMSCM2组更优(图3)。α-SMA mRNA 表达水平及蛋白印迹结果与免疫组化染色结果相吻合,且BMSCM2组均显著低于BMSC组(P<0.01)(图4b~d)。
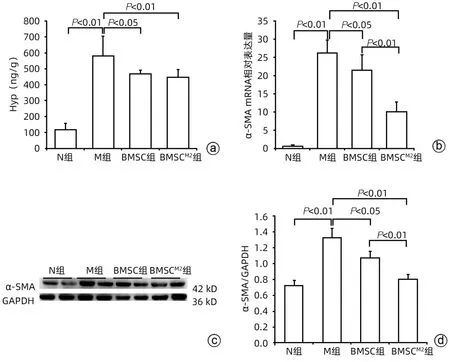
图4 BMSCM2抑制肝硬化进展Figure 4 BMSCM2 inhibits the progression of liver cirrhosis
2.4 抑制肝祖细胞增殖的作用比较 免疫组化染色显示,与N组比较,M组大鼠肝组织EpCam、Sox9阳性表达明显增加;与M 组比较,BMSC 组和BMSCM2组EpCam、Sox9阳性表达明显减少,尤以BMSCM2组改善最佳(图5)。EpCam 及Sox9 mRNA 表达水平与免疫组化染色相吻合,且BMSCM2组EpCam mRNA 水平显著低于BMSC 组(P<0.05)(图6)。
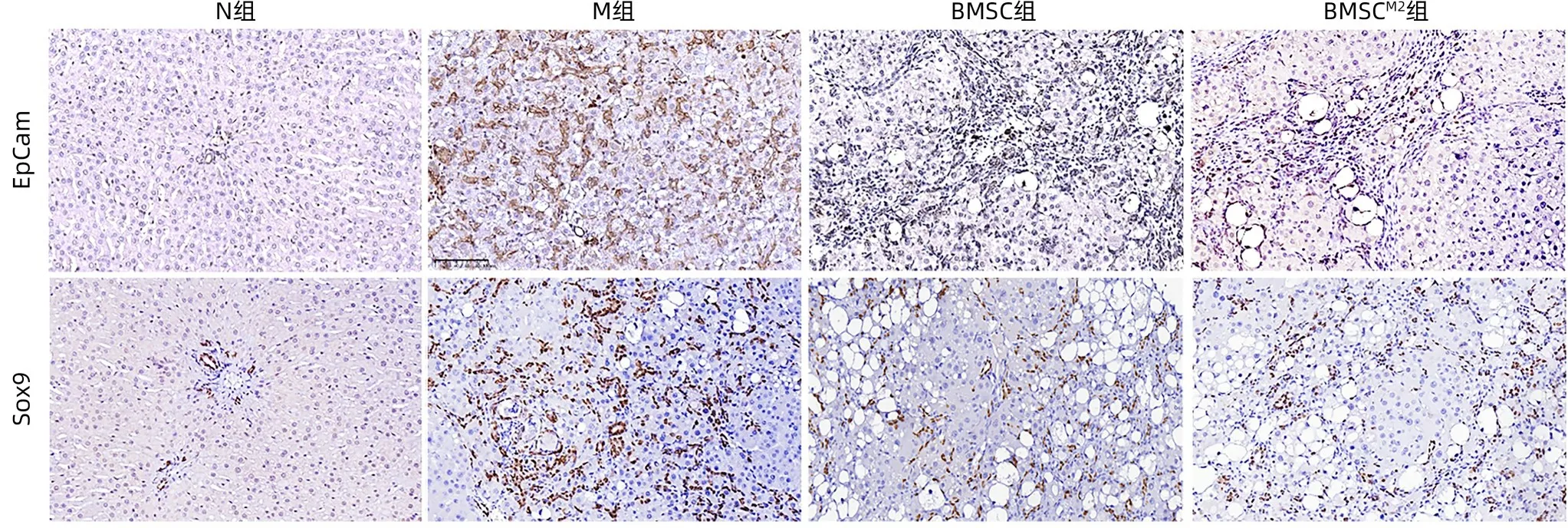
图5 EpCam和Sox9免疫组化染色结果(×200)Figure 5 Immunohistochemical staining results of EpCam and Sox9(×200)
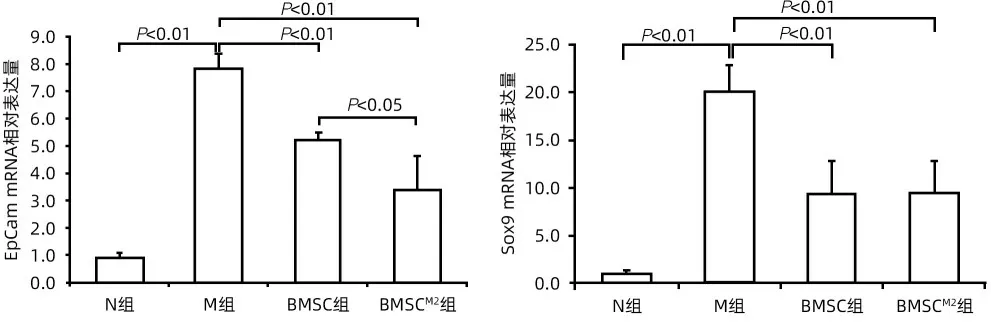
图6 BMSCM2抑制肝祖细胞增殖Figure 6 BMSCM2 inhibits hepatic progenitor cell proliferation
2.5 抑制胆管反应的作用比较 免疫组化染色显示,与N 组比较,M 组大鼠肝组织CK7 和CK19 阳性表达明显增加;与M 组比较,BMSC 组和BMSCM2组大鼠肝组织CK7 和CK19 表达明显减少,尤以BMSCM2组改善更佳(图7)。肝组织CK7 和CK19 mRNA 表达水平显示相同趋势,且BMSCM2组CK19 mRNA 水平显著低于BMSC 组(P<0.05)(图8)。
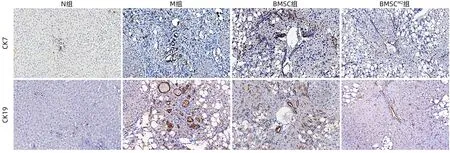
图7 CK7和CK19免疫组化染色结果(×200)Figure 7 Immunohistochemical staining results of CK7 and CK19(×200)
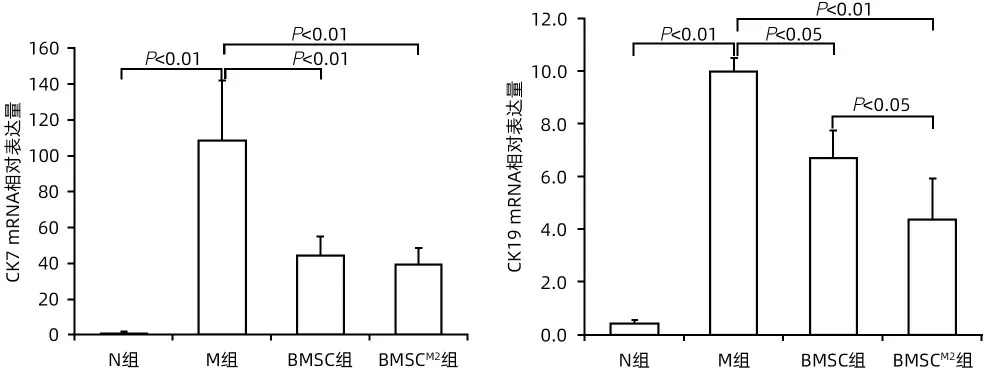
图8 BMSCM2抑制胆管反应Figure 8 BMSCM2 inhibits bile duct reactions
2.6 促进肝细胞增殖的作用比较 免疫组化染色显示,与N 组比较,M 组大鼠肝组织HNF-4α 和Alb 阳性表达明显减少;与M组比较,BMSC组和BMSCM2组HNF-4α和Alb表达明显增加,尤以BMSCM2组更为明显(图9)。HNF-4α及Alb mRNA 表达与免疫组化染色结果相吻合,且BMSCM2组HNF-4α显著高于BMSC组(P<0.05)(图10)。
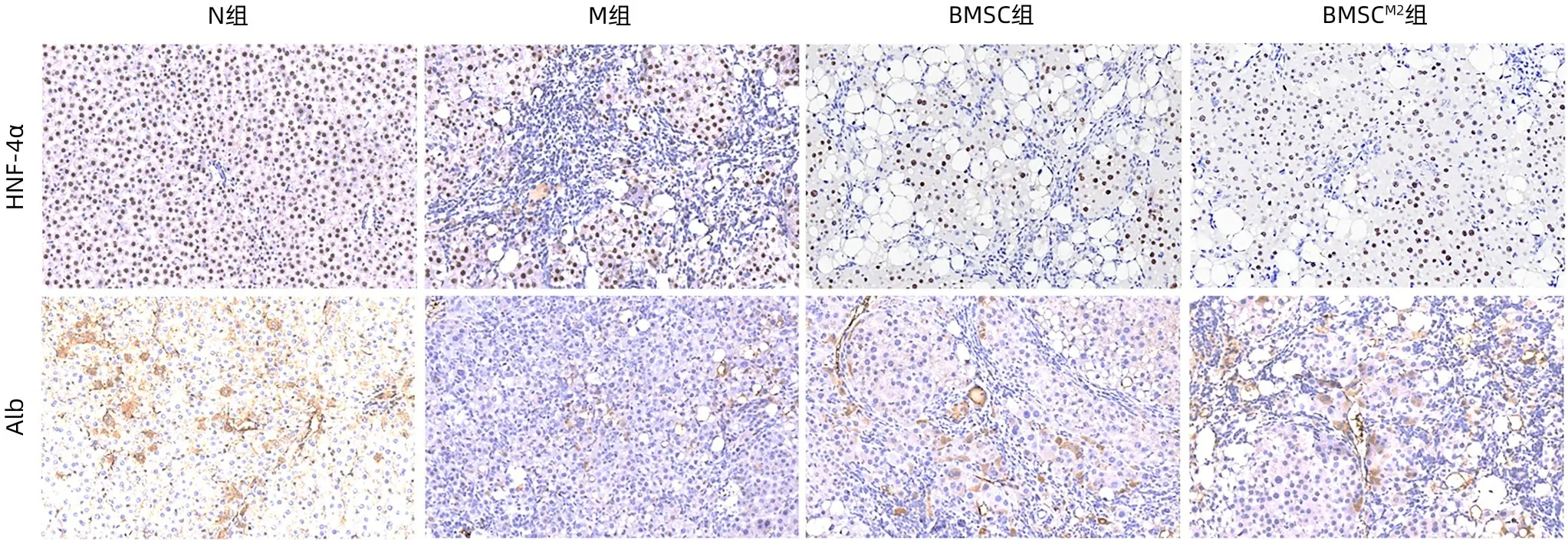
图9 HNF-4α和Alb免疫组化染色结果(×200)Figure 9 Immunohistochemical staining results of HNF-4α and Alb(×200)
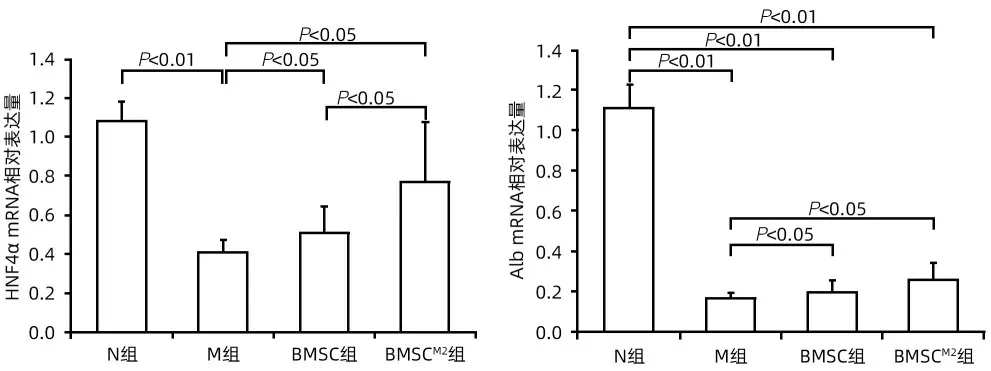
图10 BMSCM2 促进肝细胞增殖Figure 10 BMSCM2 promotes hepatocyte proliferation
3 讨论
巨噬细胞起源于单核细胞前体,具有吞噬、抗原提呈等多种功能,在组织稳态和宿主防御中发挥重要作用[14]。肝脏中的巨噬细胞主要由肝脏Kupffer细胞和浸润的单核巨噬细胞构成。在慢性肝损伤时,巨噬细胞可通过释放促炎细胞因子或趋化因子等激活肝星状细胞(HSC),使其转化为肌成纤维细胞,分泌大量的细胞外基质(ECM),最终导致肝纤维化的发生与发展[15]。同时,巨噬细胞具有高度的可塑性,其可根据环境信号快速地在促炎(M1)和抗炎(M2)之间进行表型转换,称之为巨噬细胞极化[16]。M1 和M2 巨噬细胞在转录表达谱、细胞表面标志、细胞因子等方面均具有高度异质性,对纤维化肝脏ECM沉积和组织重建发挥双重调节作用[17]。
间充质干细胞(mesenchymal stem cell,MSC)来源于骨髓、脂肪、脐带、皮肤、骨骼肌等多种组织[18],具有良好的自我增殖与多向分化潜能,获取容易,培养简单,免疫原性低[19]。近年来,MSC在肝硬化的治疗领域显示出广阔的应用前景[20],其中BMSC 被认为是最具有肝细胞再生能力的干细胞群体[5]。MSC治疗肝硬化的机制十分复杂,如移植的MSC 可分化为肝细胞样细胞[21];促进肝脏巨噬细胞由M1向M2转化,抑制HSC活化,促进M2巨噬细胞分泌MMP13,促进胶原降解[22-23];通过旁分泌功能表达各种细胞因子、趋化因子、生长因子以及外泌体等,间接和远程促进受损肝组织修复等[24]。
课题组前期研究[10]表明体外诱导分化的M1-BMDM和M2-BMDM 对CCl4诱导大鼠肝纤维化均具有良好的干预效应,两者均可通过抑制肝脏炎症反应和HSC活化,或促进肝脏巨噬细胞活化并释放MMP9、MMP13,促进ECM的降解,且M2-BMDM 的综合干预作用优于M1-BMDM。此外,课题组前期研究[11]表明BMSC 移植可有效抑制大鼠胆汁性肝纤维化进展。但目前尚不清楚M2-BMDM 是否可影响BMSC对肝硬化的治疗效应。本研究将来源于M2-BMDM 微环境的BMSC(BMSCM2)经尾静脉注入CCl4/2-AAF 诱导的大鼠肝硬化模型体内,结果表明BMSC 和BMSCM2均可显著抑制肝脏炎症反应和肝硬化进展,且BMSCM2显示出比BMSC更优的治疗作用。
HSC 活化是肝纤维化发生发展的关键细胞学基础[25],TNF-α 和TGF-β1 主要来源于活化的肝脏巨噬细胞,是促进HSC活化的关键细胞因子,参与HSC的活化并促进其产生大量ECM[26-27]。本研究结果显示BMSCM2注射可显著降低肝组织α-SMA 的蛋白表达以及α-SMA、TNF-α和TGF-β1的mRNA表达,其作用显著优于BMSC,提示与M2-BMDM 共培养后的BMSC 可进一步提高对HSC 活化的抑制作用,这可能与M2-BMDM 影响BMSC对肝脏巨噬细胞极化功能,或影响BMSC 的旁分泌功能等有关。
EpCam 和Sox9 是公认的肝祖细胞增殖的标志物[28-29]。胆管反应是各种慢性肝病常见病理改变,在肝硬化的发生与发展中发挥重要作用,CK7和CK19是公认的胆管上皮细胞标志物[30]。课题组前期研究[31]结果表明,在CCl4/2-AAF诱导的大鼠肝硬化模型中,2-AAF可剂量依赖性地促进肝祖细胞活化并向肌成纤维细胞和胆管细胞分化,促进肝硬化进展。本研究发现,BMSC和BMSCM2注射后均能显著抑制肝组织EpCam、Sox9、CK7和CK19的表达水平,显著增加肝细胞标志物HNF-4α 和Alb 的表达水平,且BMSCM2优于BMSC。提示BMSC 和BMSCM2治疗肝硬化的机制可能与抑制肝祖细胞增殖及其向胆管细胞分化,促进肝再生有关,且BMSCM2的治疗作用更为突出,这可能与M2-BMDM 影响BMSC 在肝硬化肝脏内的分化方向有关,也有可能通过促进BMSC 分泌调节性细胞因子如肝细胞生长因子、神经生长因子等刺激肝细胞再生有关[32]。
综上所述,BMSC 在肝硬化治疗领域已经取得长足发展,但M2-BMDM 是否可提高BMSC 的治疗效应尚未见报道。本研究结果证实来源于M2-BMDM 微环境的BMSC 经外周注射能够进一步提高BMSC 治疗肝硬化的效应,其机制与抑制肝脏炎症反应及HSC 活化,抑制肝祖细胞增殖及胆管反应,促进肝细胞增殖等有关,为进一步提高BMSC的肝硬化治疗作用提供了新思路。
伦理学声明:本研究方案于2021年11月15日经由上海中医药大学动物研究委员会批准,批号:PZSHUTCM211115023,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:郑欣瑞、许燕楠负责实验实施,收集数据,资料分析,论文撰写;王丹阳、邢飞飞、张士豪、宗梦瑶、战俊邑参与实验研究;陈高峰负责病理;刘伟、陈佳美、刘平参与实验设计;慕永平负责课题设计,提供写作思路,指导论文撰写并最后定稿。郑欣瑞、许燕楠对本文贡献等同,同为第一作者。

