再次肝移植治疗慢性移植物功能衰竭4例报告及文献复习
张 龙,韩国勇,陈志强,张 峰,吴金道
南京医科大学第一附属医院肝胆中心,江苏 南京 210029
肝脏移植是治疗各种类型终末期肝病的唯一有效手段。全世界每年新开展肝移植病例数不断增加,仅2021年美国即开展各类肝移植手术9 234例;肝脏移植患者总体预后也不断改善,目前肝移植患者3 年、5 年、10 年的生存率分别达到86.1%、81.4%和64.1%[1]。肝脏移植术后,移植肝脏因各种原因出现功能衰竭时,再次肝移植则成为唯一有效的治疗手段。再次肝移植比例为5.5%~11.4%[2-3]。依据再次肝移植距离前次移植的时间,一般分为早期再次肝移植(术后≤1 个月)和晚期再次肝移植(术后>1 个月),其临床特点显著不同。早期再次移植常见原因为原发性移植物无功能、肝动脉栓塞、门静脉栓塞等供体及外科因素,随着供肝获取管理的不断规范和外科技术的不断进步,其发生率持续下降。患者一般情况常较差,但移植手术相对简单,呈现出围术期死亡率较高,但渡过围术期的患者预后较好的临床特点[4-5]。晚期再次移植原因则是各种原因所致的慢性移植物衰竭,如缺血性胆道病、慢性排异、原发病复发等。与初次肝移植和早期再次肝移植相比,晚期再次肝移植患者手术复杂性显著增加。多数团队报告,晚期再次移植患者预后差于初次移植[2-3,6]。并由此引起在供体分配、手术指征等领域的诸多讨论。近年来,有团队报道在严格筛选受体的基础上,晚期再次肝移植患者亦能取得较好预后[7]。目前,专门针对晚期再次肝移植的临床经验总结尚未引起足够重视。鉴于肝移植人群基数不断扩大,晚期再次肝移植势必会成为肝脏移植外科医生越来越需要重视的临床课题,而不断提高再次肝移植临床治疗水平,持续改善患者预后,是肝脏移植外科医生努力的方向。
南京医科大学第一附属医院肝胆中心自2019年1月—2020 年12 月,连续开展4 例针对移植物慢性衰竭患者的再次肝移植术,手术均取得成功,主要手术指标良好,近期预后佳。在此基础上回顾性分析并复习相关国内外文献,旨在从患者筛选、手术技巧及围术期管理等方面总结相关经验,现报告如下。
1 对象和方法
1.1 对象
2019年1月—2020年12月,南京医科大学第一附属医院肝胆中心共开展针对慢性移植物衰竭的再次肝移植4 例,纳入再次移植组。再次移植原因为原发病复发1例(25%),慢性排异3例(75%)。均为尸体供肝全肝移植。其中,男2例,女2例。年龄45~70岁,平均54.8岁。同期完成初次肝移植27例,纳入初次移植组。其中,男12例,女15例。年龄36~72岁,平均55.4岁。所有供受体ABO血型均相同。
1.2 方法
供肝获取采用腹主动脉、门静脉双重UW 液灌注,肝肾联合切取,平均热缺血时间为4 min。移植术式均采用经典非转流式原位肝移植,肝上、肝下下腔静脉吻合采用3-0 普理灵缝线连续缝合,门静脉吻合采用4-0 普理灵缝线行门静脉主干端-端吻合。所有肝动脉吻合均采用7-0普理灵缝线连续缝合,其中再次移植组3例(75%)为供体肝总动脉-受体肝总-胃十二指肠动脉襻端端吻合,1 例(25%)为供体脾动脉-受体肝总-胃十二指肠动脉襻端端吻合。初次移植组均采用供体肝总动脉-受体肝总-胃十二指肠动脉襻端端吻合。胆道吻合均采用6-0普迪斯缝线连续缝合行供受体胆总管端-端吻合,不留置T管。术后初始抗排异方案均为“醋酸泼尼松+他克莫司+吗替麦考酚酯”三联抗排异,术中及术后第4 天常规使用“巴利昔单抗20 mg ivdst”。出院后常规门诊随访。
1.3 统计学方法
采用SPSS 23.0对实验数据进行分析,计量资料采用均数和范围表示,组间计量资料的对比采用t检验;计数资料采用例数(百分率)[n(%)]表示,采用χ2检验进行比较,P<0.05为差异有统计学意义。
2 结果
再次移植组4 例患者手术均取得成功。平均手术时间为420 min(385~480 min),平均无肝期75.8 min(44~123 min),术中平均输注红细胞11.5 U(8~16 U),输新鲜冰冻血浆1 350 mL(1 000~2 075 mL),术后平均ICU 住院时间3 d(2~4 d)。术后平均住院时间21 d(14~31 d),具体情况见表1。3例患者住院期间无明显并发症出现。1例患者出现下腔静脉吻合口狭窄,临床表现为术后顽固性大量腹水,每日腹腔引流1 500~2 000 mL。行经皮球囊扩张后治愈。初次移植组27 例患者手术均取得成功。平均手术时间为274.4 min(160~330 min),平均无肝期51 min(41~72 min),术中平均输注红细胞3.5 U(0~7 U),术后平均ICU住院时间2.4 d(1~6 d)。术后平均住院时间15.7 d(11~25 d)。晚期再次肝移植组与初次移植组在性别、年龄上差异无统计学意义,在手术时间、平均无肝期、术中输血和术后住院时间上差异均有统计学意义(P<0.05,表2)。全部31 例患者均取得随访,再次肝移植组1 例患者术后20 个月死亡,死亡原因为非缺血性胆道病,其余患者存活至今,一般情况良好,无远期并发症。首次移植组1 例术后26 d 死亡,死亡原因为移植物抗宿主病。1例术后6个月死亡,死亡原因为自身免疫性肝病复发,1 例术后第2 天发现肝动脉闭塞,行经皮肝动脉支架置入未能成功,于术后8个月死亡,死亡原因为缺血性胆道病。2例分别于术后16个月、22个月死亡,死亡原因为肝癌复发,其余22例存活至今,其中2 例出现胆道狭窄,行经皮肝穿刺胆道支架置入后好转,无血管相关并发症。

表1 4例再次肝移植患者临床资料Table 1 Clinical data of four patients undergoing liver re-transplantation
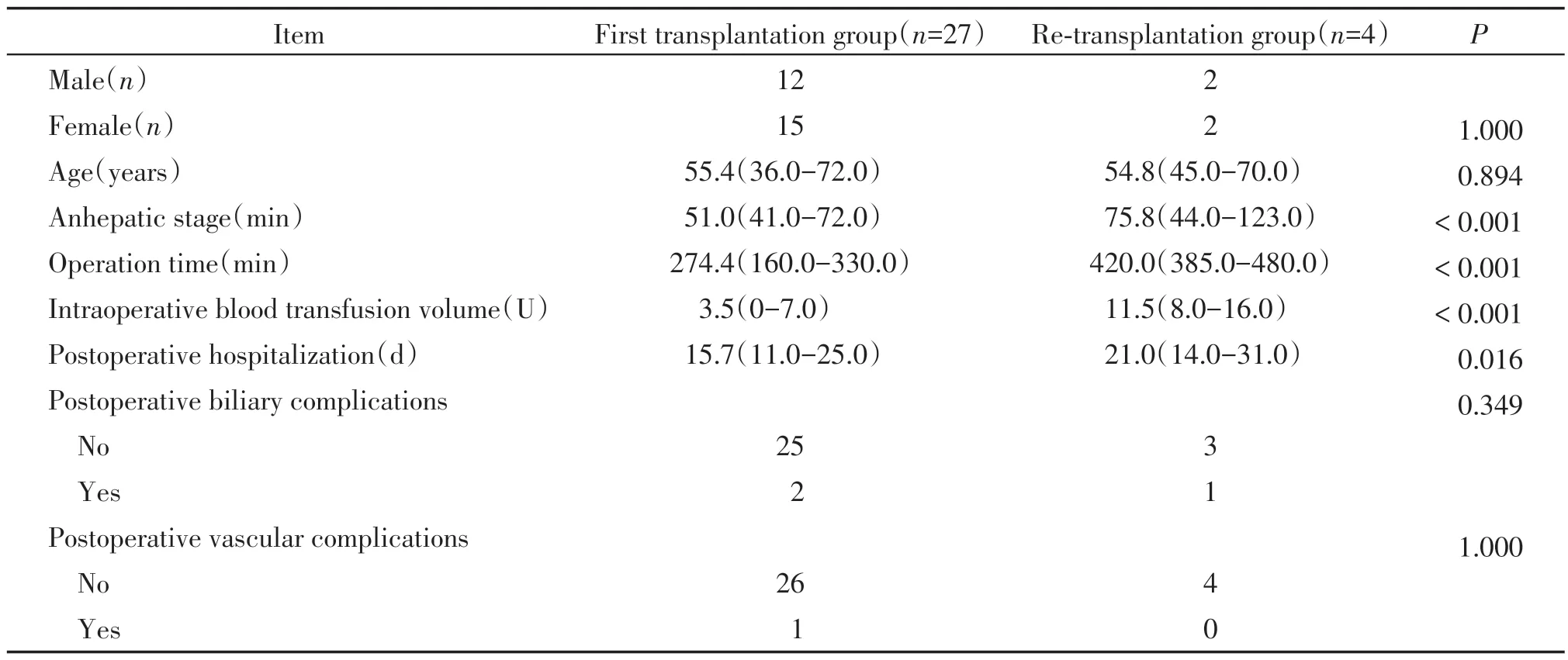
表2 同组首次肝移植与再次肝移植患者临床资料比较Table 2 Comparison of clinical data between the first liver transplantation and re-transplantation patients in the same group
3 讨论
3.1 晚期再次肝移植国内外研究进展
目前,专门讨论晚期再次肝移植的研究较少,笔者团队以“再次肝移植”为关键词,搜索国内外相关文献,发现晚期再次肝移植患者常见原因为非缺血性胆道病、慢性排异、原发病复发等。1年生存率50%~90%,3 年生存率44.0%~78.9%,5 年生存率42.0%~74.6%,呈现出不同移植中心、不同时期患者生存率方面较大差异,这可能与大部分研究纳入病例数较少有关[2-3,8-17]。这些研究中,再次肝移植预后均差于首次肝移植,但近年来已经大有改观,Jeffrey等[9]回顾了1986—2017年澳大利亚和新西兰地区的晚期再次肝移植情况,发现2000年以前患者1、5、10 年生存率分别为57%、48%、38%,2000 年之后对应的生存率分别为84%、73%和63%,有了明显改善。Takagi 等[10]回顾了1979—2017 年荷兰地区的再次肝移植情况,首次肝移植患者与再次肝移植患者的5 年生存率分别为74.0%、70.8%,两者已相当接近。这提示通过筛选合适的患者和供体,改善围手术期管理,改进手术技巧,晚期再次肝移植同样能取得较好的效果,从而消除晚期再次肝移植在伦理方面的争议。在供受体选择方面,Doyle等[18]最早提出供、受体年龄>45 岁,女性供体,受体术前机械通气,受体术前肾功能、胆红素,原发性免疫抑制以及距离前次移植时间是再次移植失败的危险因素。Markmann等[19]提出受体年龄、距离前次移植时间、受体状态等是危险因素。此后,更多学者提出以终末期肝病模型评分系统(model for end-stage liver disease,MELD)为代表的评分系统,并尝试以评分为依据预测再次肝移植患者预后并指导筛选适合再次肝移植的患者[20]。Hong 等[21]提出术中输血>30 U,移植次数>1次,受体术前机械通气,供体年龄>45岁,再次移植间隔>30 d,MELD评分>27分,受体术前白蛋白<25 g/L和受体年龄>55岁是再次移植的危险因素并以此为基础提出预测指数分类模型(predictive index classification model,PIC),并提出PIC Ⅰ~Ⅲ患者可尝试再次移植,不建议PIC-Ⅳ患者再次移植。本组4 例患者按照此预测模型,均属于PIC-Ⅰ/Ⅱ,移植均取得成功,一定程度上佐证了该模型的科学性。相信随着晚期再次肝移植研究的不断深入,会有更加适配的预测模型指导供受体选择。另外,拓展供肝来源的尝试也取得了一定进展,有研究比较了活体再次肝移植与心脏死亡供体肝移植的结果,发现两者预后接近[22-23]。
3.2 晚期再次肝移植手术技巧讨论
从外科手术技巧角度考虑,晚期再次肝移植手术难度显著提高。最主要原因在于患者经历过一次移植手术,普遍存在腹腔严重粘连,尤其是关键解剖结构附近粘连严重,而且,晚期再次肝移植患者病程后期出现长期门静脉高压,造成肝脏周围血管曲张,致密粘连合并血管曲张,导致手术难度明显增大。现有报道普遍证实再次肝移植出血量显著多于初次移植。Adani 等[3]报告再次移植平均输血量为(16±12)U,术后ICU 住院时间为(7±5)d,术后住院时间为(28±16)d。国内傅志仁等[15]报告再次移植平均手术时间10.6 h,平均出血量5 750 mL,而首次肝移植平均手术时间为6.7 h,平均出血量2 027 mL。滕大洪等[24]报告再次移植平均手术时间(11.4±4.6)h,输红细胞(22.5±14.6)U,术后ICU住院时间(146.40±192.98)h。其次,患者主要血管、胆管条件往往较差,血管及胆管吻合时技术困难明显增加,术后胆漏、腹腔感染、出血发生率也明显升高[14,16-17,25-27]。滕大洪等[24]指出,术中输血量、术后ICU滞留时间对术后生存率有明显影响[24]。本手术组在手术时间、术中输血量、术后ICU住院时间统计上均较以上报告有明显进步,但与本手术组同期首次肝移植患者比较,其手术时间、术中输血量、术后住院时间等均明显增加。这可能与本手术组开展病例数较少,数据代表性不充分有关,但相关手术经验亦值得总结,为后续深入探讨再次移植手术经验提供思路。本手术组提出以下几点经验。①受体术前精细评估。所有二次肝移植受体在移植等待期均常规完善上腹部CTA+CTV,掌握主要管道走行及变异情况。慢性移植物衰竭患者常伴随肝脏严重变形,主要管道系统旋转、移位,管径改变非常普遍。若按照常规经验切肝,极易损伤重要管道。术前通过CTA+CTV 熟悉主要管道走行,对术中减少出血,避免误伤有重要帮助。②切肝过程中优先控制第一肝门,仅在近肝门处结扎切断肝左右动脉及胆管,不做进一步游离,游离肝脏过程中配合第一肝门阻断。第一肝门附近曲张血管极多,往往稍游离即明显出血,造成手术出血多,进程慢。在判断移植可行的基础上,仅做必要的管道离断,尽量减少游离肝十二指肠韧带,待门静脉血流开放后再行动脉及胆管游离,此时曲张血管静脉压下降,出血显著减少。此外,在游离肝脏过程中配合阻断第一肝门,对减少肝周出血,优化手术野显露效果亦明显。③优先选用受体肝总动脉-胃十二指肠动脉袖片作为受体吻合动脉。该处动脉管径较粗,血管内膜条件往往较肝固有动脉好。实际操作过程中该处动脉游离稍困难,但吻合完成后动脉血流好,术后动脉栓塞及胆道并发症发生率低。④优先选择经典原位肝移植术式。鉴于再次移植患者下腔静脉周围广泛致密粘连及静脉曲张,采用背驮术式在病肝切取过程中可能引起大量出血,而经典原位术式在这一方面则有天然优势。Laroche等[28]报道了单中心66例晚期再次肝移植患者中,经典原位术式、背驮术式和转流术式三者远期预后相当,采用背驮术式和转流术式可能减少术后急性肾功能不全发病率。有研究提出,在病肝切取过程中,尽量采用锐性分离或结扎,严格避免大面积钝性分离,减少术中出血及术后创面渗出,这与我们的临床经验是一致的[15,29]。
3.3 晚期再次肝移植患者围手术期管理讨论
关于再次移植术后免疫抑制剂的使用,目前尚未形成共识,Mezochow等[30]回顾了2002—2018年美国116 各个肝移植中心共3 483 例再次肝移植患者的免疫抑制剂使用情况,发现不同移植中心方案并不一致,但都不倾向于在移植术后1 年内减少免疫移植剂用量。相信随着器官移植的不断开展和对移植物排异机制研究的不断进展,将来有可能形成更加统一的规范[31-32]。孙晓叶等[33]回顾了54例再次肝移植患者的免疫抑制剂使用情况,发现患者术后感染与否与患者血清FK-506药物浓度无关,并提出术后使用免疫球蛋白或输注新鲜冰冻血浆,术后常规使用抗真菌药物以减少再次肝移植术后感染。本组术后常规使用“他克莫司+吗替麦考酚酯+激素”三联抗排异模式,术中及术后第4天仍常规使用“巴利昔单抗”诱导免疫耐受,患者术后未见明确感染。值得注意的是,对合并新冠肺炎的肝移植患者,Colmenero 等[34]指出,基础抗排异方案中包含霉酚酸酯类是患者发展为重症病例的独立预测因子,尤其对使用霉酚酸酯类>1 000 mg/d 的患者,该结果更加明显。减量或停用霉酚酸酯类能阻止病情进一步加重。此外,对合并新冠感染的肝移植患者,在使用抗病毒药的同时应特别注意药物与免疫移植剂的相互作用,以较少免疫抑制剂相关不良反应。同时,笔者团队提出临床医师应重视术后早期抗凝。目前,早期抗凝与移植术后血管栓塞性并发症发生率的关系尚缺少循证医学证据,本手术组结合初次肝移植经验及再次移植病例观察,发现早期预防性抗凝并不增加出血风险,并有可能减少血管栓塞性并发症,因此所有患者在术后24~48 h 评估无活动性出血征象的前提下,均采用低分子肝素行预防性抗凝,所有患者围术期均未出现动静脉栓塞性并发症。
再次肝移植是治疗肝移植术后慢性移植物功能衰竭的唯一有效治疗手段。选择合适病例,改进手术技巧,提高围术期管理水平,有望取得较好疗效。

