基于网络药理学及实验研究探讨臭椿皮散治疗结直肠癌的潜在机制
石诺林,倪中亚,袁富文*
1上海中医药大学中西医结合研究院,上海 201203;2捷思英达医药技术有限公司,上海 201318
结直肠癌(colorectal cancer,CRC)是全球范围内最常见的癌症之一,也是导致癌症相关死亡的主要原因[1]。虽然联合化疗的使用大大提高了患者的5年生存率,但约有30%的患者出现复发或转移。重要的是,伴有肺转移的CRC患者的5年生存率极低,为10%~20%[2]。因此,迫切需要新的治疗方法。
结直肠癌归属中医学“脏毒”“肠蕈”“肠积”等范畴,主要病机为痰、湿、淤、毒等因素客于大肠,导致痰湿内生,进而痰淤互结,郁而化热,加之正气不足,无力驱邪外出,湿热淤毒蕴结于肠内,淤结不通,日久变生而成[3]。臭椿皮散(Chouchunpi San,CCPS)出自《太平圣惠方》,由臭椿皮、附子、干姜、鸡冠花、槐耳、甘草组成,具有清热燥湿、收敛止血的功效。现代研究表明,该方各药及有效成分具有较好的抗肿瘤作用。臭椿皮中药具有较好的抗肿瘤活性,可诱导肝癌、胃癌、非小细胞肺癌等肿瘤细胞凋亡、周期阻滞[4-7],且通过抑制PI3K/AKT信号通路诱导人黑色素瘤细胞发生凋亡,具有潜在的抗黑色素瘤活性;鸡冠花制剂及其提取物对于多种肿瘤细胞及荷瘤小鼠瘤块均有抑制作用[8];槐耳颗粒联合化疗药物可以显著提高结直肠癌患者生存期及生活质量[9]。
如今,中医药已日益成为一种具有吸引力的新型治疗药物来源,在预防和治疗癌症方面发挥了重要作用。研究显示,中医药对CRC的治疗包括预防肿瘤发生、降低毒性、提高治疗效果、降低复发和转移风险[10-11]。此外,长期使用中药与Ⅱ期和Ⅲ期CRC患者的生存结局改善有关[12-14]。中药复方成分之间的相互作用机制复杂,可以通过多个靶点发挥治疗作用。网络药理学具有系统性和整体性的特点,可从生物网络的整体角度来阐释疾病与药物之间的作用关系[15-17],为全面阐述臭椿皮散治疗结直肠癌的作用机制,本文运用网络药理学结合实验验证分析臭椿皮散治疗结直肠癌的潜在靶点和药理机制。
1 材料和方法
1.1 材料
小鼠结直肠癌细胞MC38 和人结直肠癌细胞Caco2(中国科学院上海细胞库);胎牛血清(Sigma公司,美国);DMEM 培养基(上海源培生物科技有限公司);青霉素-链霉素溶液、BCA蛋白浓度测定试剂盒、ECL化学发光液(上海碧云天生物技术公司);CCK8 试剂盒(Dojind 公司,日本,货号:CK04);STAT3抗体、p-SAT3抗体(Thermo公司,美国);GAPDH 抗体(上海赛信通生物试剂有限公司);辣根过氧化物酶标记山羊抗兔IgG(H+L)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(上海碧云天生物技术公司);玻璃旋转蒸发仪(Heidolph公司,德国);酶标仪(Thermo 公司,美国);全自动化学发光图像分析系统(上海天能公司);中药复方臭椿皮散由椿皮、干姜、槐耳、鸡冠花、甘草、附子组成,均购买于上海中医药大学附属曙光医院门诊药房。
1.2 方法
1.2.1 臭椿皮散活性成分和靶点的收集
通过TCMSP(https://tcmsp-e.com)数据库和HERB数据库(https://herb.ac.cn)检索臭椿皮散相关中药,分别以椿皮、干姜、槐耳、鸡冠花、甘草、附子为检索词,将以上两个数据库数据合并得到臭椿皮散复方的有效成分。根据每个成分的pubchem ID在Pubchem 数据库中下载对应成分数据,删除分子量≥500 kDa 成分,再根据Lipinsk 原则(miLog≤5、nOHNH≤5、nOH≤10)进一步筛选,并最终在Swiss ADME 数据库(www.swissadme.ch)筛选得到臭椿皮散有效成分(“GI absorption”为high,“High、Lipinski、Ghose、Veber、Ean、Megge”至少有3 个“YES”)。利用SwissTargetPrediciton 数据库(https://swisstargetprediction.ch)中对各成分的潜在靶点进行查找整合。筛选结束后,为标准化蛋白质靶点信息,统一在Uniprot 蛋白质数据库(https://www.uniprot.org)将化合物作用的蛋白质靶点进行规范。
1.2.2 结直肠癌相关靶点构建
以“Colorectal cancer”为关键词,分别在Gene-Cards 数据库(https://www.genecards.org)、Drugbank数据库(https://go.drugbank.com)、Pharmgkb 数据库(https://www.pharmgkb.org)和TTD 数据库(https://db.idrblab.net/ttd)中进行检索,获得的基因集作为疾病靶点,若靶点过多设定Score大于中位数的目标靶点为结直肠癌的潜在靶点,合并4个数据库靶点后,删除重复值得到结直肠癌靶点。将药物靶点和疾病靶点输入到Venn Diagrams(www.bioinformatics.com.cn/static/others/jvenn/example.html)数据库中获得交集靶点,制作韦恩图。
1.2.3 臭椿皮散-结直肠癌靶点PPI网络构建
将交集靶点提交到STRING 数据库(https://string-db.org)构建蛋白互作(protein-protein interaction networks,PPI)网络,将生物种类设置为“Homo sapiens”,最小互相作用阈值设定为“highest confidence”(>0.9),其余设置均为默认设置,进而得到PPI 网络。通过Cytoscape(https://cytoscape.org)内置工具分析靶点的网络拓扑参数,包括Degree、Betweenness及Closeness,确认网络中的核心靶点。
1.2.4 GO和KEGG富集分析
为了进一步明确臭椿皮散抗结直肠癌的可能机制,利用R 语言ClusterProfile 程序包对靶点进行KEGG 和GO 富集分析,筛选前10 个生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cellular component,CC)和 前30 个KEGG 通路,将所得结果进行可视化处理,分别以柱形图和气泡图展示结果。
1.2.5 分子对接
在Pubchem 数 据库(https://pubchem.ncbi.nlm.nih.gov)中确定化合物名称、分子量和3D 结构,在RCSB PDB数据库(https://www.rcsb.org)中下载活性成分所对应的3D 结构。利用AutoDockVina 软件(autodock.scripps.edu)对接配体和蛋白质,将目标蛋白晶体进行去除水分子、加氢处理,将靶点结构与活性成分进行分子对接,利用Vina 进行对接,并使用Pymol软件(https://www.pymol.org)进行可视化。
1.2.6 臭椿皮散水提物的制备
取臭椿皮散称重,按比例(臭椿皮30 g,干姜15 g,槐耳15 g,鸡冠花15 g,甘草9 g,附子9 g)以10倍水加入,在室温下放置浸泡1 h,回流煎煮1 h,过滤药液后。再次加入10 倍水回流煎煮1 h,将过滤药液与之前药液合并,记录2 次煎煮的药液回收量。将药液进行浓缩,将完成浓缩的药液放置干燥箱中进行干燥,48 h后,得药干冻粉,保存至-80 ℃冰箱进行后续实验。在实验开始前在无菌条件下称取适量臭椿皮散粉末,加入PBS并经过涡旋、超声等方式使臭椿皮散粉末完全溶解,用0.22 μm滤器过滤并配制成实验所需药物浓度,放置于-20 ℃保存。
1.2.7 CCK-8法检测细胞活性
将臭椿皮散配制成不同的药物浓度,取对数生长期MC38、Caco2 细胞,以1 000 个/孔接种于96 孔板,每孔加入100 μL 细胞悬液,培养过夜。实验分组每组4 个复孔,分别干预24 h、48 h、72 h,每孔加入含10 μL CCK-8 的培养基,37 ℃、5%CO2条件下避光培养2 h,于酶标仪450 nm 波长处检测各孔吸光度(OD值)。
1.2.8 流式细胞术
根据臭椿皮散浓度分为空白对照组(0 μg/mL)、低剂量组(125 μg/mL)、中剂量组(250 μg/mL)和高剂量组(500 μg/mL),处理MC38 细胞24 h。采用FITC 标记的膜联蛋白-V(annexin-V)/碘化丙啶(propidium iodide,PI)双染法和流式细胞术检测细胞凋亡。按照FITC 凋亡检测试剂盒的操作规程进行染色,以流式细胞仪进行检测。未经PI染色的荧光素阳性细胞被认为是凋亡细胞,使用Flowjo 软件进行数据分析,确定凋亡细胞百分比。
1.2.9 划痕实验
将结直肠癌细胞MC38按上述实验分组后接种于6孔板内,待细胞融合达95%以上,用无菌枪头划细胞单层,形成划痕,磷酸盐缓冲液(PBS)冲洗3 次除去划下的细胞碎片,继续用含1%胎牛血清DMEM培养基进行培养,分别在0 h 和24 h 时间点于10 倍光学显微镜下进行拍照记录,通过Image J软件计算细胞迁移率:(0 h 划痕距离-24 h 划痕距离)/0 h 划痕距离×100%。
1.2.10 Western blot实验检测相关蛋白
用细胞裂解液(RIPA裂解液,1%蛋白酶抑制剂和1 mmol/L PMSF)重悬细胞MC38,4 ℃12 000 r/min离心15 min,取上清,测定蛋白浓度。在蛋白原液中加入5×上样缓冲液,100 ℃下煮沸15 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),恒流将蛋白转移到聚偏氟乙烯(PVDF)膜上,用5%牛血清白蛋白(BSA)室温封闭1 h,4 ℃过夜孵育抗体GAPDH(1∶2 000)、STAT3抗体(1∶2 000)和p-STAT3抗体(1∶2 000),TBST洗涤3遍,洗涤后与辣根过氧化物酶(HRP)标记的羊抗兔或羊抗鼠二抗(1∶5 000)室温孵育2 h,用增强型电化学发光(ECL)液进行曝光,用Image J软件对条带进行灰度值分析。
1.3 统计学方法
采用GraphPad Prism 8.0.2 软件进行数据分析。结果以均数±标准差()表示,实验数据两组间差异采用独立样本t检验,多组件差异采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 臭椿皮散活性成分和靶点的获取
经TCMSP 和HERB 数据库共同检索臭椿皮散各组成的化学成分,筛选其中椿皮31种、鸡冠花5种、槐耳2 种、附子29 种、干姜64、甘草93 种,共检索出化合物227种。去除重复成分后共获得臭椿皮散的有效成分共计117个。通过Swisstarget Prediction 数据库筛选各成分的治疗靶点共计7 836 个,再利用蛋白质数据库(Uniprot)对筛选出来的靶点进行分析和注释,转换成基因名并删除重复值后,获得潜在治疗靶点共920个。
2.2 臭椿皮散治疗结直肠癌疾病相关靶点的获取
从GeneCards数据库中以关键词“colorectal cancer”检索结直肠癌靶点,以相关性得分(relevance score)≥10 位标准进行筛选,根据经验设定Score 大于中位数的目标靶点为结直肠癌的潜在靶点,同时在GrugBank、PharmGKB、TTD 数据库进行检索,几组数据合并,去除重复值后共获得疾病靶点9 194个(图1A);将筛选的臭椿皮散活性成分靶点与结直肠癌靶点取交集,通过绘制韦恩图,得到臭椿皮散-结直肠癌共同靶点787个(图1B)。

图1 臭椿皮散治疗结直肠癌相关靶点的韦恩图Figure 1 Venn diagram of the intersection of CCPS and CRC targets
2.3 中药-疾病调控网络的构建和分析
利用Cytoscape 软件构建“臭椿皮散-化合物-靶点-结直肠癌”网络(图2A),臭椿皮散治疗结直肠癌存在多个化合物作用于同一个靶点和1个化合物与多个靶点发生作用的现象。通过软件的分析模块对网络图进行分析,结果表明相关度(degree)排名前5 的 是licochalcone A(MOL000497)、odoratin(MOL005016)、licoricone(MOL004855)、licocoumarone(MOL004882)、quercetin(MOL000098)。在STRING 平台进行蛋白互作网络分析,使用Cytoscape 软件,以相关度(degree)≥2 倍中位数,并且相似度(closeness)和中间性(betweenness)>中位数为标准对关键基因进行分析和筛选,获得了17个核心基因(见图2B、C),结果分析显示STAT3在网络中的相关度为13,相似度为0.84,中间性为14.5,预测STAT3是臭椿皮散治疗结直肠癌的最主要靶点。其余基因为相对重要的靶点(表1)。
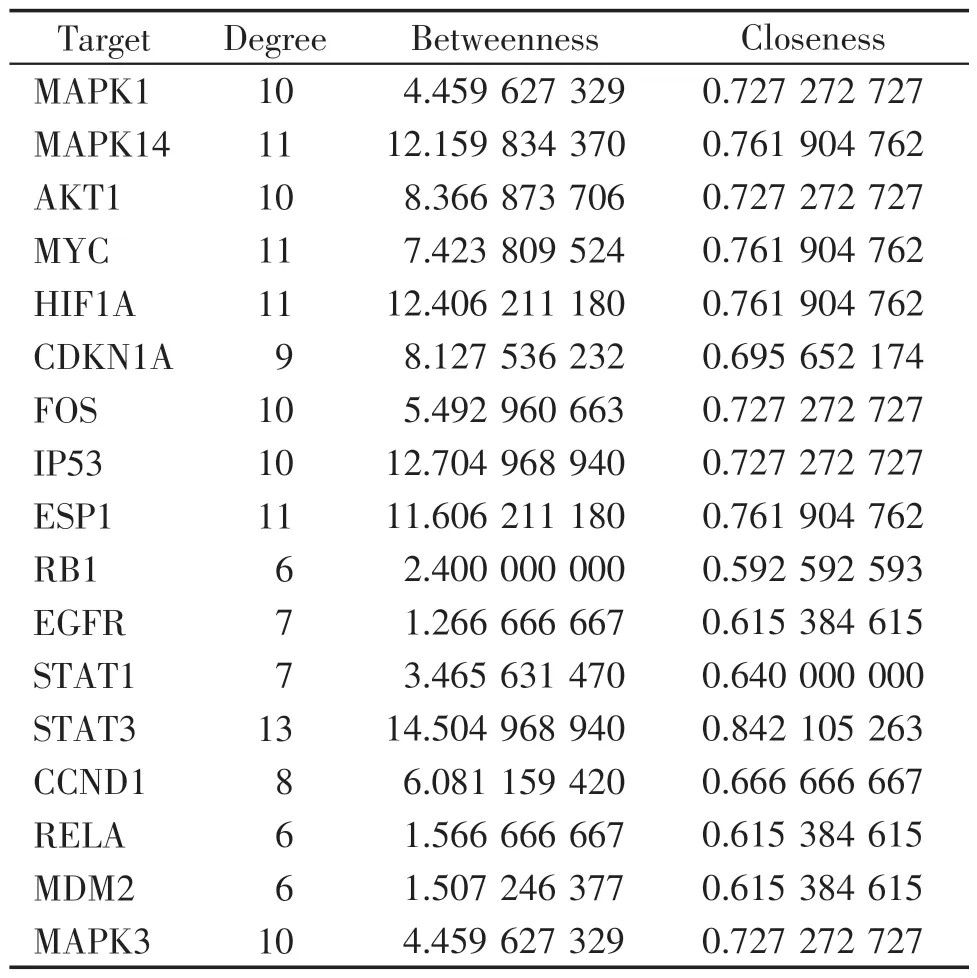
表1 臭椿皮散抗结直肠癌核心靶点的拓扑参数Table 1 Topological parameters of CCPS anti-CRC core targets

图2 中药-疾病调控网络的构建和分析Figure 2 Construction and analysis of TCM-disease regulatory network
2.4 KEGG和GO分析结果
使用R语言对臭椿皮散治疗结直肠癌相关靶点进行KEGG 通路分析及GO 功能富集分析。结果表明多个靶点的功能与结直肠癌的发生密不可分。臭椿皮散主要参与的生物学过程涉及对细胞凋亡、细胞衰老、外来生物刺激反应、细胞穿膜肽反应、氧化应激反应、对细胞外刺激的反应等过程,参与的通路主要涉及癌症通路、脂质与动脉粥样硬化相关的信号通路、AGE-RAGE 信号通路、PI3K-Akt 信号通路等(图3)。

图3 臭椿皮散治疗结直肠癌靶点的GO富集分析及KEGG通路分析Figure 3 GO enrichment analysis and KEGG pathway analysis of CCPS treatment target in CRC
2.5 分子对接验证
根据网络药理学分析的最关键靶点STAT3 与其对应的1 个核心化合物分子licochalcone A(MOL000497)对接后,配体在靶标中的位置和作用方式的可视化处理(图4)。由图可见,STAT3与licochalcone A结合能为-5.0 kJ/mol,接着用AutodockVina软件进行受体蛋白-小分子配体评估两者的结合能力,当结合能≤-5.0 kJ/mol时,认为配体可以和受体较好的结合,并且结合能力越低,越有利于构象的稳定。

图4 STAT3与licochalcone A的对接位置Figure 4 Docking position of STAT3 with licochalcone
2.6 臭椿皮散抑制结直肠癌细胞活性
为明确臭椿皮散对结直肠癌细胞的抑制作用,将MC38 细胞和Caco2 细胞经不同浓度的臭椿皮散分别处理24、48和72 h,实验结果表明细胞活性被抑制,且呈一定的浓度依赖性,差异具有统计学意义(图5)。为排除臭椿皮散对细胞的毒性,选择125 μg/mL、250 μg/mL 和500 μg/mL 3 个浓度作为低、中、高剂量进行下面后续实验。

图5 臭椿皮散抑制结直肠癌细胞增殖Figure 5 Effect of CCPS on CRC cell proliferation
2.7 臭椿皮散促进结直肠癌细胞凋亡
通过流式细胞术检测发现,与空白组相比,臭椿皮散低、中、高剂量组处理MC38细胞48 h后,明显促进MC38细胞凋亡,凋亡比例与臭椿皮散浓度成正比(图6)。

图6 臭椿皮散促进结直肠癌细胞凋亡Figure 6 CCPS increased apoptosis in CRC cell
2.8 臭椿皮散对结直肠癌细胞迁移能力的影响
臭椿皮散干预MC38 细胞24 h 后,与空白对照组相比,划痕愈合距离明显减小(P<0.05);随着臭椿皮散剂量的增加,划痕愈合距离逐渐减小,臭椿皮散低剂量、中剂量和高剂量组组间比较差异显著(P<0.05),表明臭椿皮散能够抑制MC38 细胞的迁移能力,并在臭椿皮散低、中和高剂量组呈现剂量依赖性(图7)。

图7 臭椿皮散抑制结直肠癌细胞迁移Figure 7 CCPS inhibited CRC cell migration
2.9 臭椿皮散对MC38细胞STAT3相关蛋白表达的影响
根据网络药理学筛选出的靶点为STAT3,使用低、中、高3 个浓度的臭椿皮散水提物干预MC38 细胞24 h,与空白组比较,3 个药物组中p-STAT3 表达明显降低;随着药物浓度的增加,p-STAT3表达量逐渐降低,呈现出剂量依赖性(图8)。
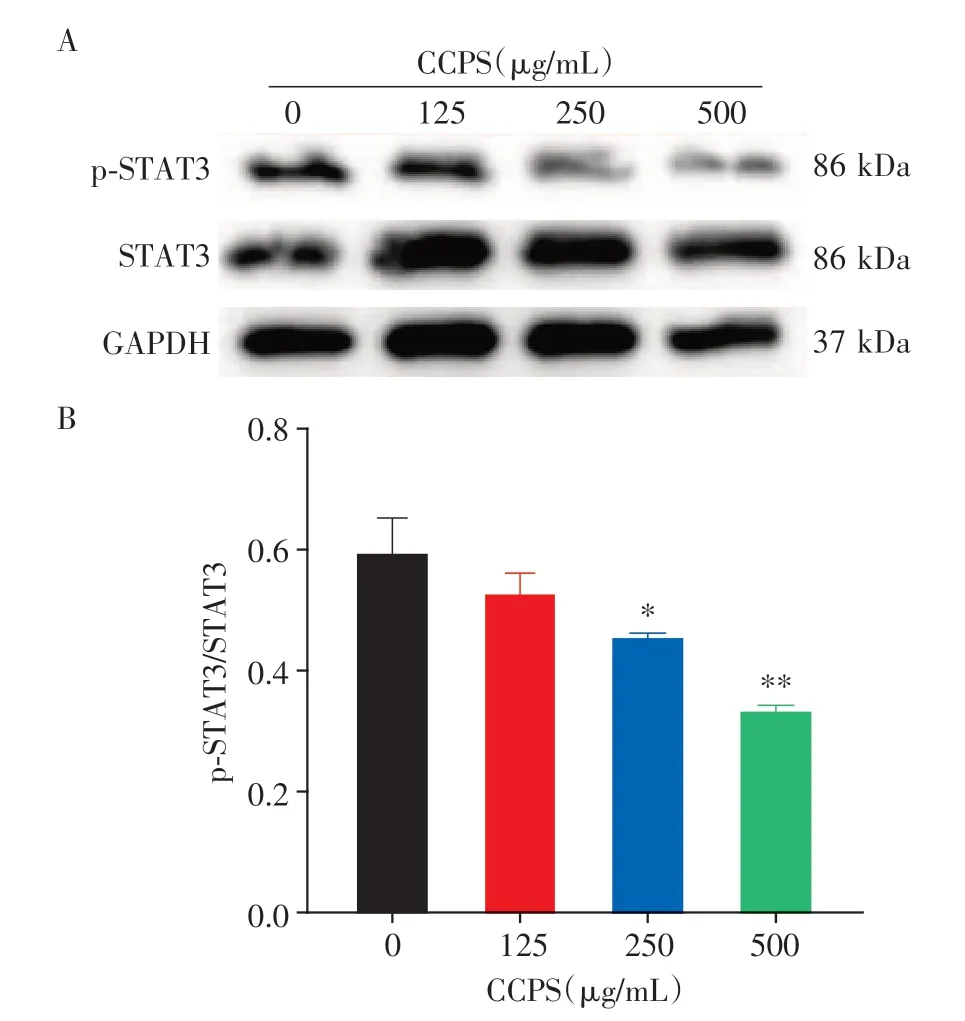
图8 臭椿皮散干预后STAT3相关蛋白表达情况Figure 8 CCPS suppressed CRC cells by inhibiting STAT3 protein phosphorylation
3 讨论
结直肠癌患者临床上主要表现为便秘、腹胀、腹痛、腹泻,严重者出现血便、呕吐,若肿瘤转移至其他器官还可能出现其他疾病,严重影响患者生存质量和生存时间。中医药在结直肠癌诊断治疗过程中的优势和特色明显,具有丰富的临床经验。臭椿皮散作为临床上治疗结直肠癌的经典中医方剂,对其药理机制的研究显得尤为迫切。
本文基于网络药理学方法,共筛选出117 种潜在药物成分和787个共同作用蛋白靶点。在臭椿皮散治疗结直肠癌的核心基因靶点筛选发现,基因关联程度最高的是STAT3。KEGG 和GO 分析结果也证明靶点主要与癌症的多种通路相关。进一步的细胞实验证明,臭椿皮散呈剂量和时间依赖性抑制结直肠癌细胞的增殖,且促进结直肠癌细胞凋亡和抑制细胞迁移,该抑制作用与其降低STAT3蛋白表达相关,提示臭椿皮散可能通过抑制STAT3靶点发挥对结直肠癌细胞增殖和迁移能力的抑制效应。信号转导和转录激活因子(STAT)家族包括STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b 和STAT6,它们介导多种细胞内信号通路。其中,STAT3 参与了细胞的增殖、存活、分化和血管生成等多种生物学过程[18],与本研究细胞表型实验结果相符合。在正常细胞中,STAT3 的瞬时激活主要是通过磷酸化将质膜上的细胞因子和生长因子受体的转录信号传递到细胞核[19]。然而,STAT3 在大多数癌症中呈过度激活,在患者肿瘤组织来源的样本中观察到STAT3 过表达[20]。研究发现,STAT3 在恶性黑色素瘤、非小细胞肺癌、乳腺癌以及卵巢癌等多种实体癌组织中活性增强[21-24]。此外,STAT3还与肿瘤免疫逃逸和肿瘤药物耐药性有密切关系[25-27],大量证据支持阻断STAT3 激活可以作为癌症和其他疾病的治疗靶点。
综上,本研究基于网络药理学及体外实验方法,以臭椿皮散为研究对象,探讨了其治疗结直肠癌的作用机制。根据结果,选取STAT3靶点进行验证,但本研究只采用了细胞实验进行验证,对于通路只考虑了蛋白水平变化,机制研究尚有不足,今后还需要从在体实验角度等层面进一步开展研究。

