循环miR-124作为铅神经毒性标志物的灵敏性、稳定性和组织特异性研究
周 慧,王 雁,李 华,汪溪洁,陈华英,马 璟
中国医药工业研究总院,上海益诺思生物技术股份有限公司,上海 201203
铅是一种不能通过生物降解,可以在环境中持续存在的环境毒物。世界卫生组织于2021 年发布的《世卫组织铅暴露临床管理指南》指出,铅暴露属于重大公共卫生问题,2019年有90万人因长期受铅暴露影响而死亡。当血铅浓度在20~40 μg/dL 时,人体即会出现相应的认知状态改变;当血铅浓度≥60 μg/dL 时,人体会有明显的神经毒性表现[1]。针对15~24 岁青少年的研究发现,当血铅浓度为1.5~10.0 μg/dL 时,出现行为障碍的可能性比血铅浓度低于检测限(<0.7 μg/dL)时高8倍[2]。在中国,成人血铅水平从2000—2002 年的8.0 μg/dL 下降至2016—2018 年的2.2 μg/dL[3],仍处于可能受铅暴露影响的水平。儿童对铅暴露更敏感,任何水平的铅暴露对儿童的发育都是不利的。目前,对于铅的暴露和风险评估主要依赖于血铅浓度,然而血中的铅含量仅占人体铅负荷的1%左右,大量的铅储存在软组织和骨骼中。具有相同血铅浓度的儿童面临的神经发育受损的风险也不一定相同。有研究报道,当血铅浓度处于100~200 μg/dL 时,有儿童无中毒症状,有儿童出现致命性脑病[4]。大脑是铅毒性的主要靶器官之一,极少量的铅暴露就会导致一系列生理和行为功能障碍,因此寻找更加灵敏的生物标志物,及时评估铅暴露引起的神经毒性非常关键。
循环微小核糖核酸(microRNA,miRNA)具有易获取性、高特异性和高灵敏性等特点,可作为脏器损伤的潜在生物标志物,如miR-122 可作为药物性肝损伤的高度特异性的生物标志物[5],miR-107可作为骨质疏松的生物标志物[6],循环miR-19b-3p 是心力衰竭的预后生物标志物[7]。在对铅作业工人研究发现,铅暴露可以引起循环miR-124 显著升高[8]。miR-124 是大脑中表达最多的miRNA,高度特异性地存在于中枢神经系统[9],靶向成年大脑25%~48%的总mRNA,其在人类、小鼠和大鼠中具有完全相同的序列,序列高度保守[10]。研究发现,miR-124在脑卒中患者外周血中表达升高,且卒中后梗死体积越大,miR-124浓度越高[11],因此有望开发成为脑卒中的早期预测和风险分层的生物标志物。
循环miRNA 作为生物标志物用于临床需要完成以下几个关键步骤,包括发现、证实、验证和临床应用[12],目前对于循环miRNA作为生物标志物的研究大多处于发现和证实阶段。2018年,美国食品药品监督管理局(food and drug administration,FDA)发布的《生物标志物证据框架指南》中指出,生物标志物的认证需要经过分析验证和临床验证,分析验证指验证生物标志物检测的性能特征满足使用条件;临床验证指验证生物标志物与目标结果的相关性满足使用条件。FDA 同年发布的《生物分析方法验证指南》指出,生物标志物的分析方法验证需要与药物分析的方法验证解决相同的问题,包括阐明方法的准确性、灵敏性、选择性、重现性和稳定性等特征。
miR-124在铅神经毒性中的研究尚处于发现和证实阶段。本课题组主要研究循环miR-124作为铅神经毒性生物标志物的高敏感性和高组织特异性,同时考察其在不同保存条件下的稳定性,对循环miR-124作为铅神经毒性效应标志物进行初步验证。
1 材料和方法
1.1 材料
SPF级Sprague-Dawley(SD)大鼠(北京维通利华实验动物技术有限公司),在恒温(20~26 ℃)、恒湿(40%~70%)的环境中饲养,动物自由摄食和饮水。动物管理及使用申请经上海益诺思生物技术股份有限公司动物管理和使用委员会批准(伦理批文编号:IACUC-2021-r-048)。
醋酸铅(上海西格玛奥德里奇贸易有限公司);对乙酰氨基酚(上海易恩化学技术有限公司);盐酸异丙肾上腺素注射液(重庆西南药业股份有限公司);硫酸庆大霉素注射液(焦作国药集团容生制药有限公司);2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)(北京索莱宝科技有限公司);苏木素染液和伊红染液(珠海贝索生物技术有限公司);miScript®SYBR®Green PCR 试剂盒、miRNeasy®Serum/Plasma Kit 试剂盒、miScriptⅡ逆转录试剂盒和miRNeasy Mini Kit 试剂盒(QIAGEN 公司,德国);miR-124 和miR-24 引物(Thermo Fisher Scientific 公司,美国);大鼠肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)ELISA 试剂盒、大鼠白细胞介素(interleukin,IL)-1β ELISA 试剂盒和大鼠IL-10 ELISA试剂盒(江苏酶免实业有限公司)。
1.2 方法
1.2.1 循环miR-124的稳定性研究
1.2.1.1 大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型的建立
生理状态下,循环miR-124的表达量较低,可能干扰检测方法的评估[13]。因此建立大鼠MCAO模型并采集血液样本用于miR-124的检测,然后与文献结果对比,对miR-124 的检测方法进行评价。将雄性SD大鼠随机分为对照组和模型组,对照组大鼠进行假手术(只术前麻醉和血管分离,不结扎及插入线栓),模型组大鼠采用Zea-Longa线栓法建立MCAO模型[14]。将大鼠使用3%戊巴比妥钠(30~45 mg/kg)腹腔注射麻醉,分离并结扎右侧颈总动脉,在颈总动脉结扎靠近头端方向切0.2 mm 的小切口。线栓从小切口插入颈总动脉,通过颈内动脉和颈外动脉的分叉进入颈内动脉。将线栓沿颈内动脉向入颅方向推进,插入大脑前动脉和大脑中动脉的分叉处,从而阻断同侧颈内动脉和对侧颈内动脉通过大脑前动脉的供血。脑缺血2 h 后,将留在体外的线栓轻拉出1 cm,以实现大脑中动脉再灌注。MCAO 手术后,将大鼠单笼饲养,注意保温。
在术后16~24 h,使用Longa 评分法对造模大鼠进行神经功能评分[14]。中度局灶性神经功能缺损(即行走时向左转弯,神经功能评分为2 分)和重度局灶性神经功能缺损(即行走困难并向左倾倒,神经功能评分为3分)的模型是稳定的模型,可以选择用于后续研究。随机选择2只稳定造模的大鼠,分离脑组织并用TTC溶液在37 ℃水浴中避光染色40 min。染色后,将脑组织置于4%福尔马林中4 ℃固定24 h。固定后,缺血区域为白色,正常区域为红色。
1.2.1.2 样本采集及循环miR-124的稳定性研究
将MCAO 造模成功的大鼠用3%戊巴比妥钠(30~45 mg/kg)腹腔注射麻醉,从腹主动脉采集血液到含有EDTA-K2的抗凝管中,样本采集2 h内完成离心并收集血浆样品。
将收集到的血浆样品分装为18份,每种保存条件使用3 份样品独立检测。3 份新鲜血浆样品立即检测作为对照,其他分装样品分别在室温储存(6±2)h、2~8 ℃储存(24±8)h、-70~-90 ℃储存(15±7)d和(30±7)d 后用于检测。3 份样品在-70~-90 ℃储存至少12 h,然后再室温解冻,3个循环后评估冻融稳定性。
1.2.2 循环miR-124的组织特异性研究
1.2.2.1 肝毒性模型建立及样本采集
将雄性SD 大鼠随机分为溶媒对照组和对乙酰氨基酚组,分别单次经口灌胃给予0.5%羧甲基纤维素钠或1 250 mg/kg的对乙酰氨基酚,每只大鼠的给药体积为10 mL/kg。24 h 后将大鼠用3%戊巴比妥钠腹腔注射麻醉,从腹主动脉采集1 mL 血液放入EDTA-K2抗凝管中,使用RT-qPCR 检测miR-124;采集3 mL血液放入含促凝剂和分离胶的试管中,使用生化分析仪检测肝功能指标丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)。
1.2.2.2 心脏毒性模型建立及样本采集
将雄性SD 大鼠随机分为溶媒对照组和盐酸异丙肾上腺素组,分别单次静脉注射给予0.9%氯化钠注射液或2.5 mg/kg的盐酸异丙肾上腺素,每只大鼠的给药体积为10 mL/kg。4 h 后根据1.2.2.1 收集和处理血样,使用RT-qPCR检测miR-124,使用免疫化学发光法检测心脏功能指标高敏心肌肌钙蛋白I(high sensitivitycardiac troponin,hs-cTnI)。
1.2.2.3 肾毒性模型建立及样本采集
将雄性SD 大鼠随机分为溶媒对照组和硫酸庆大霉素组,分别连续7 d 肌肉注射给予0.9%氯化钠注射液或80 mg/kg 的硫酸庆大霉素,每只大鼠的给药体积为2 mL/kg。第7 天给药24 h 后根据1.2.2.1收集和处理血样,使用RT-qPCR检测miR-124,使用生化分析仪检测肾脏功能指标肾损伤分子1(kidney injury molecule 1,KIM-1)、尿素氮(blood urea nitrogen,BUN)和肌酐(creatinine,CREA)。
1.2.3 循环miR-124灵敏性的比较研究
将雄性SD大鼠随机分为溶媒对照组、醋酸铅低剂量和醋酸铅高剂量组,分别连续56 d经口灌胃给予去离子水、300 或600 mg/kg 的醋酸铅溶液,每只大鼠的给药体积为10 mL/kg。在第1、7、56 天给药前和/或给药后1、4、8、24 h 采集血液检测miR-124的表达;在第1、14、21、56 天给药前和给药后1 h 采集血液检测IL-1β、IL-10 和TNF-α的表达;在第8、15、22、57 天采集脑组织检测IL-1β、IL-10 和TNF-α的表达;在第57天采集脑组织使用电感耦合等离子体质谱检测铅暴露量,并采集脑组织用10%中性福尔马林固定至少24 h,石蜡包埋,制成3 μm的切片进行HE染色,于光学显微镜下观察脑组织病理学改变。
1.2.4 RT-qPCR检测
根据miRNeasy®Serum/Plasma Kit说明书的要求从血浆中提取总RNA,使用RT-qPCR检测目的基因miR-124 和内参基因miR-24[15]。使用miScript 逆转录试剂盒合成cDNA:将9 μL 的Template RNA 与4 μL的5×miScript HiFlex Buffer、2 μL的10×miScript Nucleics Mix、2μL 的miScript Reverse Transcriptase Mix和3 μL的RNase-free Water 混合,最终反应体积为20 μL。反应在37 ℃孵育60 min,在95 ℃温育5 min。使用miScript®SYBR®Green PCR 试剂盒进行RT-qPCR 反应:用cDNA、引 物、10×miScript Universal Primer 各2 μL 以 及4 μL 的RNase-free Water 和10 μL 的2×QuantiTect SYBR Green PCR Master Mix 混合反应。所有检测重复进行3 次。miR-124 和内参miR-24 的前向引物均由Thermo Fisher Scientific 公司合成,序列分别为5′-ATTAAGGCACGCGGTGAATG-3′和5′-GTGCCTACTGAGCTGATAT-3′,PCR试剂盒中备有反向通用引物。
1.3 统计学方法
实验数据以均值±标准差()表示,使用SPSS Statistics 21.0 软件进行统计分析。组间比较采用t检验、单因素方差分析或Kruskal-Wallis检验,多重比较使用Dunnett-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 建立可靠的循环miR-124检测方法
在随机选择的稳定MCAO 模型中,经TTC 染色后发现大鼠梗死侧脑组织呈现白色梗死灶,而对侧非梗死脑组织呈现红色(图1A),表明成功制备脑缺血再灌注模型。
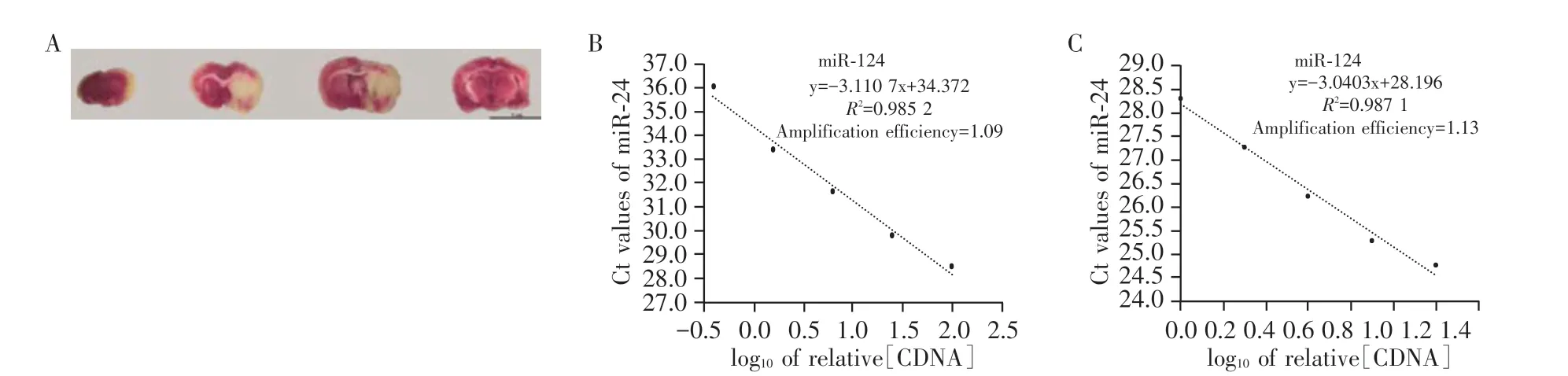
图1 建立可靠的循环miR-124检测方法Figure 1 Establishment of a reliable miR-124 detection method
从成功造模的MCAO 大鼠中收集血浆样本,使用RT-qPCR 检测目的基因miR-124 和内参基因miR-24,获得各自的扩增曲线、熔解曲线和标准曲线。miR-124 和miR-24 的扩增效率基本一致(1.09vs.1.13);熔解曲线均为单峰,表明设计的引物可以特异性扩增而不形成引物二聚体;相关系数分别为0.985 2 和0.987 1,线性良好(图1B、C)。以上结果表明本实验室成功建立循环miR-124 的检测方法,检测结果可靠。
在大鼠脑缺血再灌注后16~24 h 收集MCAO 模型组和对照组大鼠的血液样本,使用已建立的方法完成检测。与对照组大鼠相比,模型组大鼠循环miR-124的表达显著增加(12.60±6.71)倍(P<0.01,n=6),与文献报道基本一致[16],说明以上样本处理程序和检测方法可靠。
2.2 研究循环miR-124的稳定性
为了评估miR-124 的稳定性,取3 只成功造模的SD大鼠,采集血液样本处理后在不同保存条件下保存不同时间。与新鲜血浆相比,在室温储存6 h、2~8 ℃储存24 h、-70~-90 ℃储存17、36 d 的血浆样本中,miR-124 的表达差异无统计学意义。同时,miR-124在3个冻融循环后可以保持稳定(图2)。
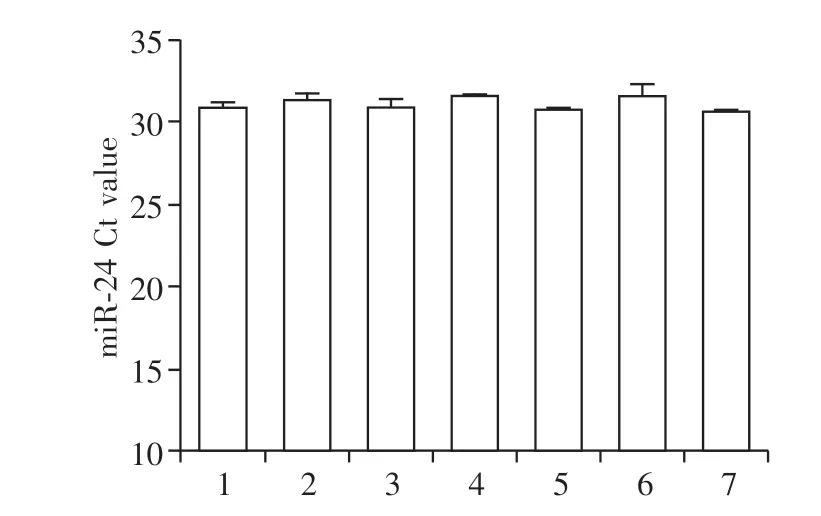
图2 循环miR-124的稳定性研究Figure 2 Stability study of circulating miR-124
2.3 研究循环miR-124的组织特异性
2.3.1 肝毒性模型中miR-124的表达变化
与溶媒对照组相比,1 250 mg/kg 对乙酰氨基酚组动物在给药后24 h ALT 和AST 显著升高(P<0.01,表1),表明成功建立了对乙酰氨基酚诱导的大鼠肝毒性模型。通过RT-qPCR 检测血浆miR-124水平,与溶媒对照组相比,对乙酰氨基酚组大鼠miR-124 的表达显著降低(P<0.01,表1)。
表1 对乙酰氨基酚对雄性大鼠ALT、AST和miR-124的影响Table 1 Effects of APAP on ALT,AST,and miR-124 in male rats(,n=6)
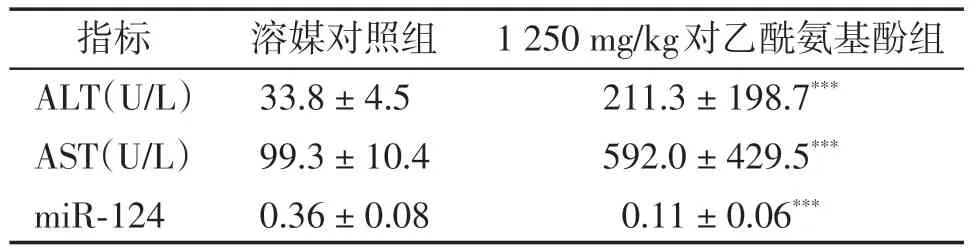
表1 对乙酰氨基酚对雄性大鼠ALT、AST和miR-124的影响Table 1 Effects of APAP on ALT,AST,and miR-124 in male rats(,n=6)
Compared with solvent control group,***P <0.01.
2.3.2 心脏毒性模型中miR-124的表达变化
hs-cTnI 是一种对心肌功能障碍具有高度敏感性和特异性的血清生物标志物。与溶媒对照组相比,2.5 mg/kg 异丙肾上腺素组动物给药后4 h 见hs-cTnI 显著升高(P<0.001,表2),表明成功建立了大鼠心脏毒性模型。与溶媒对照组相比,异丙肾上腺素组大鼠miR-124 未见明显改变(P>0.05,表2)。
表2 异丙肾上腺素对雄性大鼠hs-cTnI和miR-124的影响Table 2 Effects of isoprenaline on hs-cTnIand miR-124 in male rats(,n=6)

表2 异丙肾上腺素对雄性大鼠hs-cTnI和miR-124的影响Table 2 Effects of isoprenaline on hs-cTnIand miR-124 in male rats(,n=6)
Compared with solvent control group,***P <0.001.
2.3.3 肾脏毒性模型中miR-124的表达变化
KIM-1、BUN 和CREA 已被广泛用作急性和/或慢性肾损伤的血清学标志物。与溶媒对照组相比,80 mg/kg 硫酸庆大霉素组动物第7 天给药后24 h KIM-1和CREA升高(P<0.01,表3),BUN有升高趋势,表明成功建立了大鼠肾毒性模型。与溶媒对照组相比,硫酸庆大霉素组动物miR-124 未见明显改变(P>0.05,表3)。
表3 硫酸庆大霉素对雄性大鼠肾功能血清生化指标和miR-124的影响Table 3 Effects of gentamycin sulfate on serum biochemical parameters of renal function and miR-124 in male rats(,n=6)
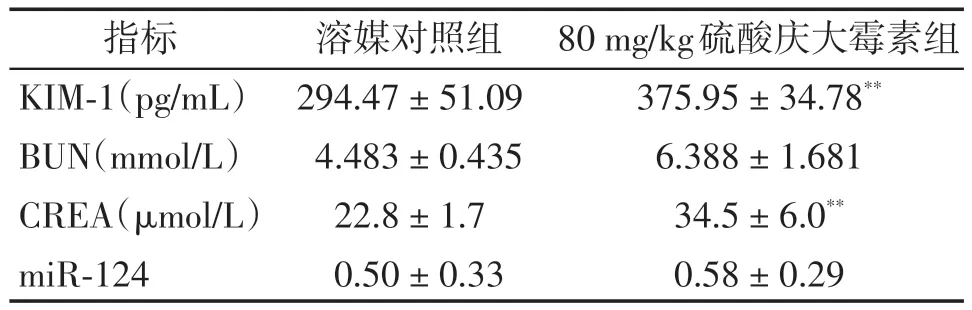
表3 硫酸庆大霉素对雄性大鼠肾功能血清生化指标和miR-124的影响Table 3 Effects of gentamycin sulfate on serum biochemical parameters of renal function and miR-124 in male rats(,n=6)
Compared with solvent control group,**P <0.01.
2.4 研究miR-124作为铅神经毒性标志物的灵敏性
2.4.1 建立铅神经毒性模型
SD大鼠连续56 d经口灌胃给予醋酸铅溶液,与溶媒对照组(去离子水)相比,300和600 mg/kg 醋酸铅组(PbAc 组)大鼠脑组织中铅含量显著增加(P<0.01,图3A);组织病理学检查见300和600 mg/kg醋酸铅组大鼠大脑胶质细胞增多(图3B);ELISA 检测结果显示300 和600 mg/kg 醋酸铅组动物重复给药第8、15、22 和57 天脑组织促炎细胞因子IL-1β和TNF-α显著升高,抗炎细胞因子IL-10显著降低(P<0.05,图3C~E),因此考虑炎症反应参与醋酸铅引起的神经毒性。
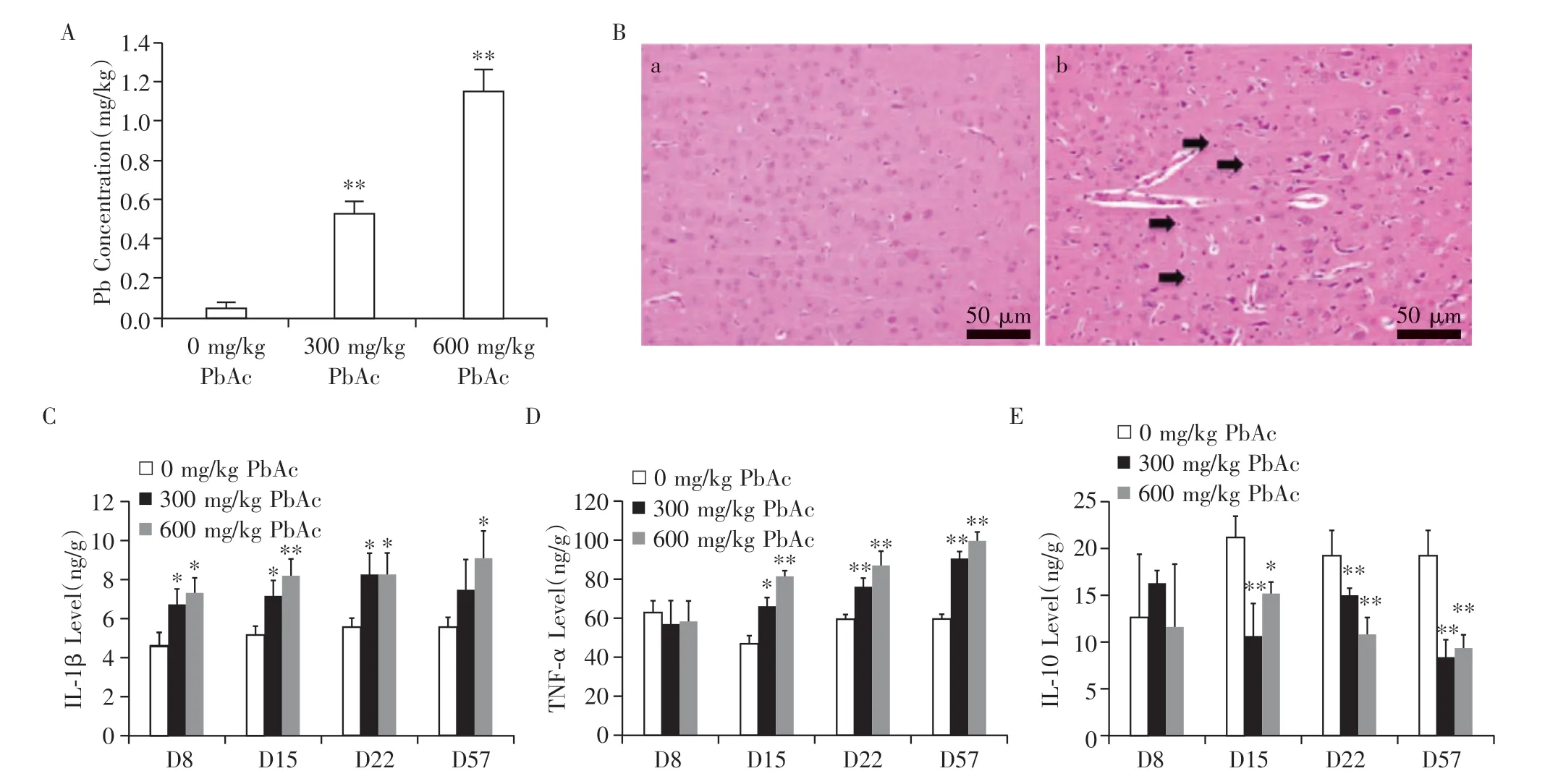
图3 建立醋酸铅神经毒性模型Figure 3 Establish of lead acetate neurotoxicity models
2.4.2 循环miR-124与细胞因子的灵敏性比较
与首次给药前基础值相比,600 mg/kg 醋酸铅组动物自第7 天给药前起见血浆miR-124 显著升高(P<0.05),300 和600 mg/kg 醋酸铅组动物重复给药后血浆miR-124 水平显著高于单次给药后相同时间点的血浆miR-124 水平(P<0.05,图4A、B),考虑血浆miR-124 水平与神经毒性的严重程度相关。与溶媒对照组相比,300和600 mg/kg醋酸铅组动物自第21 天给药后1 h 起见血清促炎细胞因子IL-1β显著升高(P<0.05,图4C);自第21 天给药前起见血清促炎细胞因子TNF-α 显著升高(P<0.01,图4D);血清抗炎细胞因子IL-10 未见明显改变(图4E)。由此可见,本实验条件下循环miR-124 升高的时间早于循环细胞因子,循环miR-124 可以更灵敏地监测铅神经毒性。与溶媒对照组相比,300 mg/kg 醋酸铅组大鼠第14 天给药前见TNF-α显著升高,因为第14 天给药后1 h 未见相应改变,且600 mg/kg 醋酸铅组大鼠第14 天给药前后TNF-α未见相应改变,因此考虑300 mg/kg醋酸铅组大鼠第14 天给药前的TNF-α升高为偶发改变。
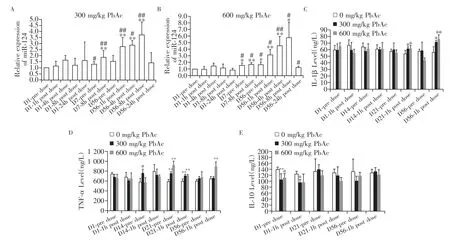
图4 循环miR-124与炎症细胞因子的灵敏性比较Figure 4 Sensitivity comparison of circulating miR-124 and inflammatory cytokines
3 讨论
生物标志物可以分为暴露生物标志物、效应生物标志物和易感生物标志物。血铅浓度是最广泛使用的铅暴露生物标志物,然而血铅浓度只能反映最近的铅暴露情况,铅暴露后在血液中的半衰期约为30 d,随后进入大脑、肝脏和肾脏等具有高交换率的软组织隔室,并最终在硬组织隔室骨骼和牙齿中牢固结合并积累。在怀孕、更年期和钙缺乏等生理条件改变时,骨骼中的铅可以重新入血从而增加血液中的铅水平[17],并带来新的毒性风险。相同的血铅浓度可能带来不同的神经毒性风险,因此血铅浓度结合效应生物标志物更有利于铅神经毒性的评价。
理想的生物标志物优先在特定的组织中表达且含量丰富,正常生理状况下体液中的浓度较低,组织损伤时生物标志物大量释放进入体液,通过检测体液中生物标志物的含量,诊断组织损伤情况。miRNA 可以通过抑制蛋白翻译和促进mRNA 切割在转录后水平调控靶基因的表达[18],因此miRNA水平的改变通常会早于蛋白水平。本研究将大鼠暴露于醋酸铅建立与铅暴露相关的神经毒性模型,同时检测了脑组织促炎细胞因子IL-1β和TNF-α以及抗炎细胞因子IL-10,结果显示IL-1β和TNF-α升高、IL-10 降低,提示醋酸铅暴露引起了神经炎症,与文献报道一致[8];同时比较了检测到循环miR-124 和循环细胞因子的含量改变的时间,结果显示给药第7 天即检测到循环miR-124 升高,给药第21 天检测到循环细胞因子IL-1β和TNF-α升高,提示循环miR-124 可以更早期、更灵敏地监测铅暴露引起的神经炎症。
尽管许多循环miRNA 已经在不同的人群和疾病条件下被证实,但迄今为止仍未用于临床,可归因于样本类型、样本处理方法和检测平台等的差异,导致研究之间存在不一致性和不可重复性。其中,血液样品处理方法可能会影响循环miRNA的稳定性,如肝素抗凝剂会影响miRNA 检测,血清分离胶和其他抗凝剂(如EDTA和柠檬酸盐)不会显著影响miRNA 的检测等[19]。本研究选择了EDTA-K2作为miRNA 的抗凝剂。全血在室温孵育时间超过24 h,发现miRNA可能从血细胞或血小板中释放[20],因此选择在采血后2 h内对全血样本进行离心的处理条件。确定样品处理程序后,本研究建立大鼠MCAO 模型,按照以上样本处理程序处理血液样本并检测循环miR-124的表达,通过与文献比对,认为样本处理程序和检测方法可靠。为了有效利用生物标志物获得有意义的结论,生物样本从采集到检测过程中的保存至关重要,稳定性评估应涵盖研究期间的样本处理和样本保存,如果为冷冻样品则需要评估至少3 个冻融循环的稳定性,并且冻融条件需要模拟预期的样本处理条件[21]。循环miRNA 在大多数情况下都是稳定的,但目前尚未查阅到有文献对miR-124 的稳定性进行研究。在本研究中,考察发现miR-124 在室温储存6 h、2~8 ℃储存24 h和-70~-90 ℃储存36 d以及3个冻融循环均可以保持稳定,为循环miR-124 样本的保存和处理提供了稳定性数据支持。
在临床用药过程中,肝脏、心脏和肾脏是常见的靶器官,有研究汇总了撤市的133 种药物的安全性表现,发现肝毒性(27.1%)、心脏毒性(18.8%)和肾毒性(10.5%)是药物停用的主要原因[22]。铅被吸收后首先与血液中的红细胞结合,然后分布至软组织和骨骼中,成人软组织中铅含量最密集的部位为肝脏和肾脏。SD大鼠使用醋酸铅染毒后,检测到铅大量存在于肝脏和肾脏中,并引起肝脏和肾脏的组织病理学改变[23]。为了排除以上器官毒性对神经毒性检测的干扰,分别用对乙酰氨基酚、异丙肾上腺素和庆大霉素建立肝毒性、心脏毒性和肾毒性模型,检测循环miR-124的表达变化。与溶媒对照组相比,在心脏毒性和肾毒性模型中,循环miR-124没有明显变化;在肝毒性模型中,循环miR-124 表达降低。大鼠大脑中miR-124 的浓度约是肝脏中miR-124 浓度的24 000倍[24],与神经毒性相比,肝毒性引起的循环miR-124 的变化非常轻微,不影响神经毒性的评估。虽然常见的心脏、肝脏和肾脏毒性不影响循环miR-124 作为生物标志物评价神经毒性,然而miR-124 参与中枢神经系统的多项生物学功能,中枢神经系统疾病如脑卒中、抑郁[25]、帕金森病[26]等也可能引起miR-124 含量的改变,因此循环miR-124 结合血铅浓度可以更加敏感、特异地评价铅神经毒性。
综上所述,含有miR-124的样本保存在室温、2~8 ℃、-70~-90 ℃,以及冷冻条件下3 个冻融循环时均非常稳定,可满足样本生物分析稳定性验证的要求;miR-124在脑组织的含量远高于其他脏器,循环miR-124 的变化受其他脏器损伤的干扰极小,具有良好的组织特异性;与炎症标志物相比,循环miR-124 可以更早期、更灵敏地检测铅暴露引起的神经炎症。因此认为miR-124可成为评价铅神经毒性效应的更早期、更敏感、更特异的生物标志物,可与血铅浓度结合用于铅神经毒性评价。

