PB 试验结合BBD 响应面法优化纳豆γ-聚谷氨酸发酵条件
严德林,黄 雷,邱 婧,陈世浪,梅芷晴,张凯旋,杨存义,高向阳,
(1.华南农业大学食品学院广东省功能食品活性物重点实验室,广东广州 510642;2.华南农业大学广州都柏林国际生命科学与技术学院,广东广州 510642;3.华南农业大学农学院广东省分子育种重点实验室,广东广州 510642)
纳豆由大豆蒸煮后接种纳豆芽孢杆菌(Bacillus subtilisnatto)发酵而成,起源于日本,日本人食用纳豆的历史已长达两千多年[1-3]。纳豆含有丰富的功能物质,如纳豆激酶、维生素K2等,具有预防心血管疾病、预防骨质疏松、降血糖、降低血压和抗氧化等保健功能[4-9]。目前,对纳豆的功能物质研究主要集中在纳豆激酶和维生素K2,对其他功能物质报道较少。γ-聚谷氨酸(poly-γ-glutamic acid,γ-PGA)是纳豆发酵过程产生的一种重要的活性物质,具有抗肥胖、促进钙吸收等功能[10-12]。γ-PGA 也是纳豆黏液的主要成分[13-14]。优质的纳豆黏液呈白色,味道清淡或微酸,质地柔软粘稠,拉丝长,这也是评判优质纳豆的重要标准[15-17]。
γ-PGA 是由D/L 谷氨酸单体或两个对映体通过α-氨基和γ-羧酸基之间的酰胺键连接在一起的阴离子多肽,其聚合度在1000~15000 之间,分子量越高,黏度越高[18-19]。γ-PGA 具有良好的水溶性,并且能完全被生物降解,对人体和环境无毒害无污染,在食品、农业、化妆品和医药等方面具有广泛的应用[20-24]。合成γ-PGA 的方法主要有化学合成、肽合成、生物转化和微生物发酵[25]。微生物发酵法生产γ-PGA 具有效率高、环境污染小、反应条件温和等优点[26]。
目前,微生物发酵产γ-PGA 多数采用液态发酵,缺乏对纳豆食品发酵产γ-PGA 条件优化的相关研究。本实验采用纳豆芽孢杆菌发酵纳豆,利用Plackett-Burman 试验设计结合Box-Behnken 响应面法,以γ-PGA 产生量和纳豆感官品质的加权综合评分为指标,对纳豆发酵条件进行优化。确定了纳豆γ-PGA 的最佳发酵条件,推动了高产γ-PGA 纳豆的市场发展。
1 材料与方法
1.1 材料与仪器
纳豆芽孢杆菌(Bacillus subtilisnatto)本实验室保藏;巴西10 号、巴西13 号、华夏3 号、粤小黄1 号、粤小黄2 号、粤小黄3 号6 种品种大豆 华南农业大学农学院大豆分子设计育种实验室提供;氯化钠 天津市大茂化学试剂厂;牛肉膏 广州环凯微生物科技有限公司;蛋白胨、琼脂粉 北京奥博星生物技术有限责任公司;γ-聚谷氨酸标准品 南京赛泰斯生物科技有限公司;十六烷基三甲基溴化铵(CTAB)上海麦克林生化科技有限公司;氢氧化钠天津福晨化学试剂有限公司;盐酸 广州化学试剂厂;无水乙醇 国药集团化学试剂有限公司。
HZS-H 水浴振荡器 哈尔滨东联电子技术开发有限公司;HYL-C3 组合式摇床 山东博科科学仪器有限公司;SW-CJ-2F 洁净工作台 苏静集团苏州安泰空气技术有限公司;YX-24HDD 手提式压力蒸汽灭菌器 江阴滨江医疗设备有限公司;HC-3018 高速离心机 安徽中科中佳科学仪器有限公司;UV-1750 紫外可见分光光度计 日本岛津公司;BCD-215YD 冰箱 青岛海尔股份有限公司。
1.2 实验方法
1.2.1 培养基的配制 斜面培养基:牛肉膏0.5%,蛋白胨1%,氯化钠0.9%,琼脂1.5%,pH7.2;种子培养基:牛肉膏0.5%,蛋白胨1%,氯化钠0.9%,pH7.2。上述所有培养基于121 ℃下灭菌30 min 后冷却待用。
1.2.2 纳豆芽孢杆菌的活化和培养 将纳豆芽孢杆菌接种于LB 斜面固体培养基上,37 ℃活化24 h,活化2 次。将平板上的纳豆芽孢杆菌接种到液体培养基中,在37 ℃恒温水浴中180 r/min 摇瓶培养24 h,随后5000 r/min 离心10 min,再加入无菌水,形成1×107CFU/mL 的菌悬液,作为种子液保存。
1.2.3 纳豆发酵产γ-PGA 的工艺流程
1.2.3.1 纳豆发酵 对大豆进行挑选、清洗,随后用干净自来水常温浸泡18 h。将浸泡好的大豆沥干,于常压、121 ℃下蒸煮30 min,自然冷却至37 ℃左右进行接种(接种后需要搅拌均匀大豆和种子液),发酵。发酵完成后放于4 ℃冰箱下进行后熟24 h[27-28]。
1.2.3.2γ-PGA 的初步纯化 称取1 g 纳豆于离心管中,加入10 mL 蒸馏水,8000 r/min 离心15 min,除去菌体,取上清液,加入3 倍体积的无水乙醇,在4 ℃下静置过夜后,8000 r/min 离心15 min,取沉淀,加入与上清液体积相等的蒸馏水溶解,随后稀释20 倍后进行测定。
1.2.4 单因素实验 通过不同品种大豆发酵纳豆,根据发酵结果取最优大豆进行后续发酵工艺实验。在大豆浸泡pH7.0、接种量4%、装瓶量15%、发酵温度37 ℃和发酵时间24 h 的固定条件下,分别考察大豆浸泡pH(6.6、6.8、7.0、7.2、7.4)、接种量(1%、2%、4%、6%、8%)、装瓶量(5%、10%、15%、20%、25%)、发酵温度(33、35、37、39、41 ℃)和发酵时间(18、21、24、27、30 h)对纳豆发酵工艺的影响。每个因素进行3 次平行实验,记录平均值。
1.2.5 Plackett-Burman 试验设计 Plackett-Burma(PB)是一种2 水平的试验方法,可以用较少的实验从众多影响因素中快速筛选出显著影响因素[29]。根据前期单因素预实验结果,对大豆浸泡pH、接种量、装瓶量、发酵温度、发酵时间5 个因素进行考察。每个因素选取高(1)和低(-1)两个水平,设置3 个虚拟列。设计N=12 的PB 试验(表1)。
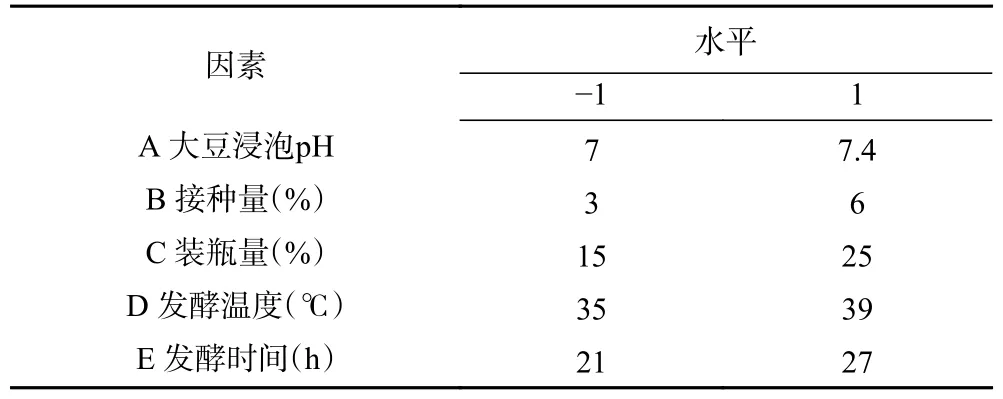
表1 Plackett-Burman 试验设计因素水平Table 1 Plackett-Burman experimental design factor level
1.2.6 最陡爬坡试验 响应面拟合方程只有在接近最优值(综合得分最高)的区域才能完全模拟真实情况。因此,需要通过最陡爬坡试验逼近最优值区域,进行有效的响应面分析。根据PB 试验结果,得到对综合得分影响最明显的3 个因素,并根据其正负效应设计步长和变化方向。估计值为正则为正效应,反之则为负效应,快速达到最优响应区域[30]。
1.2.7 Box-Behnken 响应面试验 根据PB 试验和最陡爬坡试验分析结果确定的3 个因素,以综合评分为响应值,对每个因素的3 个水平进行(-1、0、+1)编码。每个试验点平行3 次。呈现正效应的因素采用高水平,呈现负效应的因素采用低水平。Box-Behnken 试验设计(BBD)的因素及水平见表2。

表2 Box-Behnken 试验因素与水平Table 2 Factors and levels of Box-Behnken test
1.2.8γ-PGA 测定 本文参考Yan 等[31]的方法进行发酵纳豆γ-PGA 测定。
1.2.8.1γ-PGA 标准溶液的配制 精确称取一定量的γ-聚谷氨酸标准品,用蒸馏水溶解,稀释至含量为100 μg/mL 的γ-PGA 标准液。精密量取10、20、30、40、50 mL 上述溶液,分别置于1~5 号容量瓶中,用蒸馏水定容至100 mL,摇匀,得到10~50 μg/mL 的γ-PGA 标准液,待检测。
1.2.8.2 CTAB 溶液的配制 配制2% NaOH 溶液,并以此为溶剂,加入CTAB,搅拌溶解,配制成5 g/L的CTAB 试液。
1.2.8.3 CTAB 比浊法 取2 mL 待测液于试管中,准确加入2 mL CTAB 试液,轻微振荡,静置3 min,将反应液倒入比色皿中,以蒸馏水和CTAB 试液混合作为空白,测定在波长224 nm 下的吸光值。以γ-PGA 标准品浓度为横坐标,224 nm 处的吸光值为纵坐标,得到γ-PGA 标准曲线的线性方程为Y=0.0216X+0.0734,R2=0.9913。将所测得的样品吸光值代入标准曲线,并根据下式(1)计算γ-PGA 含量:
1.2.9 感官评价方法 由经过专业培训的人员组成评价小组(5 男5 女)对纳豆的色泽、气味、滋味和拉丝进行评分,分值范围为0~10 分[32]。纳豆感官评分标准见表3。

表3 纳豆感官评价表Table 3 Natto sensory evaluation table
1.2.10 综合评分的计算方法 以γ-PGA 产量和感官评价的综合评分为指标进行分析[33],如下式(2):
1.3 数据处理
每个样品重复测定3 次,利用Desgin-Expert 8.06 软件对试验结果进行分析,优化各因素最优条件并根据预测结果进行验证。采用SPSS 16.0 对数据进行显著性和误差分析,采用Origin 2018 作图。
2 结果与分析
2.1 单因素优化发酵条件
2.1.1 不同大豆品种筛选 在一定发酵条件下,测定巴西10 号、巴西13 号、华夏3 号、粤小黄1 号、粤小黄2 号、粤小黄3 号6 种品种纳豆的感官总分及γ-PGA 含量,计算综合评分。由图1 可知,6 种品种大豆发酵纳豆产γ-PGA 及其感官品质有一定的差异。整体上看,华夏大豆和粤小黄大豆发酵纳豆γ-PGA产生量及其感官品质高于巴西大豆发酵纳豆,且γ-PGA 产生量和纳豆感官品质呈一定的正比关系。粤小黄2 号纳豆γ-PGA 产生量和综合评分最高,分别达到3.28 mg/g 和9.45,华夏3 号感官总分最高为31.83。巴西10 号纳豆γ-PGA 产生量和综合评分最低,分别为2.30 mg/g 和8.07,粤小黄3 号感官总分最低为30.00。根据以上结果,选用γ-PGA 产生量和综合评分最高的粤小黄2 号进行后续的发酵实验。
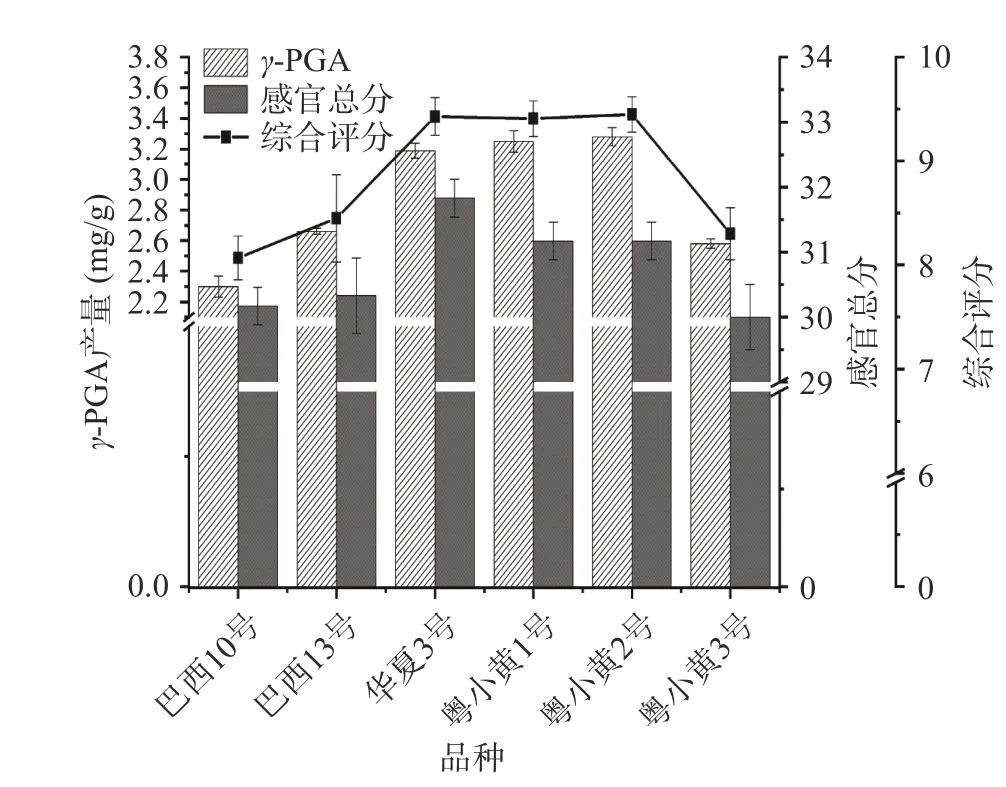
图1 不同大豆品种发酵纳豆产γ-PGA 的差异Fig.1 The difference of γ-PGA produced by fermented natto from different soybean varieties
2.1.2 不同大豆浸泡pH 对纳豆发酵产γ-PGA 的影响 测定大豆浸泡pH6.6、6.8、7.0、7.2、7.4 的粤小 黄2 号纳豆的感官总分及γ-PGA 含量,计算综合评分,大豆浸泡pH 对纳豆品质的影响如图2 所示。由图2 可知,随着浸泡pH 的增大,γ-PGA 产生量及综合评分呈现出先上升后下降的趋势,当浸泡pH 达到7.2 时,γ-PGA 产生量及综合评分达到最大值,之后开始降低。可能是因为pH 过高或者过低,不利于菌株生长繁殖,最终形成芽孢,停止产γ-PGA[34]。但是纳豆的感官总分几乎保持不变,说明此pH 区间对纳豆感官品质的影响不大。因此,纳豆发酵产γ-PGA的大豆最佳pH 为7.2。

图2 不同大豆浸泡pH 对纳豆发酵产γ-PGA 的影响Fig.2 Effects of different soybean soaking pH values on the production of γ-PGA by natto fermentation
2.1.3 不同接种量对纳豆发酵产γ-PGA 的影响 测定接种量为1%、2%、4%、6%、8%的粤小黄2 号纳豆的感官总分及γ-PGA 含量,计算综合评分。接种量对纳豆品质的影响如图3 所示,由图3 可得,随着接种量的增大,纳豆γ-PGA 产生量、感官总分和综合评分呈现出先急速上升后缓慢下降的趋势。当接种量小于4%时,三个评价指标均处于低水平。这是因为当接种量较低时,纳豆芽孢杆菌不能将纳豆充分发酵,但当接种量达4%时,纳豆芽孢杆菌能最大程度地利用大豆中的营养物质,使γ-PGA 产生量、感官总分和综合评分达到最佳。当接种量大于4%时,三个评价指标缓慢下降。可能是菌量过多,形成竞争。也可能是由于营养物质的减少与其代谢产物的增加抑制了发酵过程,导致纳豆γ-PGA 产生量变少,感官总分和综合评分降低[3]。因此,纳豆发酵产γ-PGA 的最佳接种量为4%。
2.1.4 不同装瓶量对纳豆发酵产γ-PGA 的影响 测定装瓶量为5%、10%、15%、20%、25%的粤小黄2 号纳豆的感官总分及γ-PGA 含量,计算综合评分,装瓶量对纳豆品质的影响如图4 所示。由图4 可得,随着装瓶量的增大,纳豆γ-PGA 产生量、感官总分和综合评分呈现出先急速上升后下降的趋势。当装瓶量为20%时,纳豆γ-PGA 产生量、感官总分和综合评分最高,这与周雪琴等[34]、Yang 等[35]的研究结果一致。这可能是因为装瓶量过少时,营养物质缺乏,不足以支撑菌株的生长繁殖,最终形成芽孢,停止产γ-PGA;当装瓶量过多时,会导致营养物质不能被最大利用,发酵不完全,感官品质不够好。因此,纳豆发酵产γ-PGA 的最佳装瓶量为20%。

图4 不同装瓶量对纳豆发酵产γ-PGA 的影响Fig.4 Effects of different bottling quantities on production of γ-PGA by natto fermentation
2.1.5 不同发酵温度对纳豆发酵产γ-PGA 的影响温度是影响微生物生长与代谢的重要原因。测定发酵温度为33、35、37、39、41 ℃的粤小黄2 号纳豆的感官总分及γ-PGA 含量,计算综合评分。发酵温度对纳豆品质的影响如图5 所示,由图5 可知,随着发酵温度的增大,纳豆γ-PGA 产生量、感官总分和综合评分呈现出先急速上升后缓慢下降的趋势。当发酵温度为37 ℃时,纳豆γ-PGA 产生量、感官总分和综合评分最高,这与Feng 等[36]的研究结果相近。温度过高或过低不仅对菌株的正常生长有影响,而且发生反应所需要的酶在高温下失活,在低温下活性受到较大的抑制,从而导致γ-PGA 的产量降低,发酵不完全,感官品质变差[26]。因此,纳豆发酵产γ-PGA 的最佳发酵温度为37 ℃。

图5 不同发酵温度对纳豆发酵产γ-PGA 的影响Fig.5 Effects of different fermentation temperatures on γ-PGA production by natto fermentation
2.1.6 不同发酵时间对纳豆发酵产γ-PGA 的影响测定发酵时间为18、21、24、27、30 h 的粤小黄2 号纳豆的感官总分及γ-PGA 含量,计算综合评分。发酵时间对纳豆品质的影响如图6 所示,由图6 可知,随着发酵时间的延长,纳豆γ-PGA 产生量、感官总分和综合评分迅速增长,当发酵时间达24 h 时,三个评价指标达到最大,这与陈乐乐等[3]、Yang 等[35]的研究结果一致。之后γ-PGA 产生量、感官总分和综合评分随时间的增加趋于平稳或缓慢降低。发酵时间的长短对菌株的繁殖及成品纳豆的性质都会有一定影响。发酵初期,纳豆菌代谢加快产物积累,γ-PGA产生量、感官总分升高;随着发酵时间到一定的范围,纳豆菌代谢下降,逐渐不转化剩余的营养物质,故γ-PGA 产生量、感官总分趋于平稳或者缓慢降低[37]。因此,纳豆发酵产γ-PGA 的最佳发酵时间为24 h。

图6 不同发酵时间对纳豆发酵产γ-PGA 的影响Fig.6 Effects of different fermentation time on the production of γ-PGA by natto fermentation
2.2 Plackett-Burman 试验
纳豆发酵产γ-PGA 综合评分的Plackett-Burman试验结果及方差分析见表4、表5。利用 Design Expert 8.0.6 软件,以综合评分Y 为响应值,得到回归方程为Y=7.81-0.018A-0.017B-0.050C+0.66D+0.33E,R2=0.9987。表明该回归方程模型的拟合度良好,回归方程具有代表性。其中R2adj=0.9976,表明模型适用于99.76%的效应值。表5 方差分析结果显示,发酵温度(D)、发酵时间(E)、装瓶量(C)的结果对综合分数(Y)有较显著影响(P<0.01),各因素影响的大小为D>E>C,其他2 个因素影响不显著,故取发酵温度、发酵时间和装瓶量这三个因素进行后续爬坡试验。

表4 Plackett-Burman 试验设计与结果Table 4 Plackett-Burman test design and results
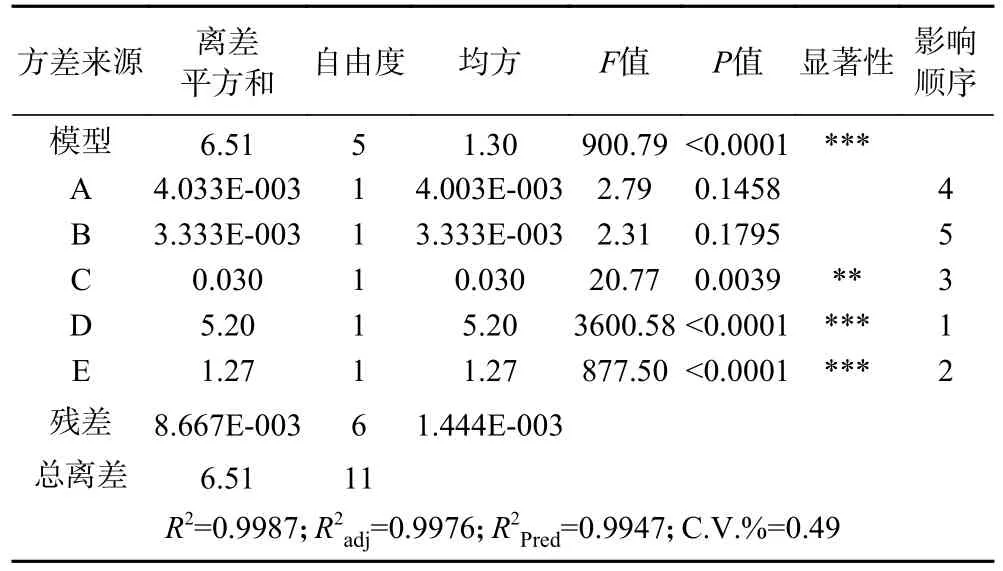
表5 Plackett-Burman 试验设计方差分析Table 5 Analysis of variance for Plackett-Burman trial design
2.3 最陡爬坡试验结果
从表6 中可以看出,随着装瓶量、发酵温度、发酵时间这三个重要因素的趋势性变化,纳豆γ-PGA 产生量、感官总分和综合评分呈先上升后下降的趋势,并且在第3 组实验的条件下,三个指标达到最高。因此,以该试验组为下一步响应面的中心试验点,进行响应面试验。

表6 最陡爬坡试验设计及结果Table 6 Test design and results of steepest climb
2.4 响应面分析结果
纳豆发酵产γ-PGA 综合评分的响应面分析试验结果见表7,回归模型的方差分析见表8。利用Design Expert 8.0.6 软件对表7 中综合评分数据进行二次多元回归拟合,回归方程如下:Y综合评分=10.04-0.029A+0.065B+0.096C+5.000E-003AB-7.500E-003AC+0.010BC-0.27A2-0.60B2-0.25C2。

表7 Box-Behnken 试验设计及结果Table 7 Box-Behnken test design and results
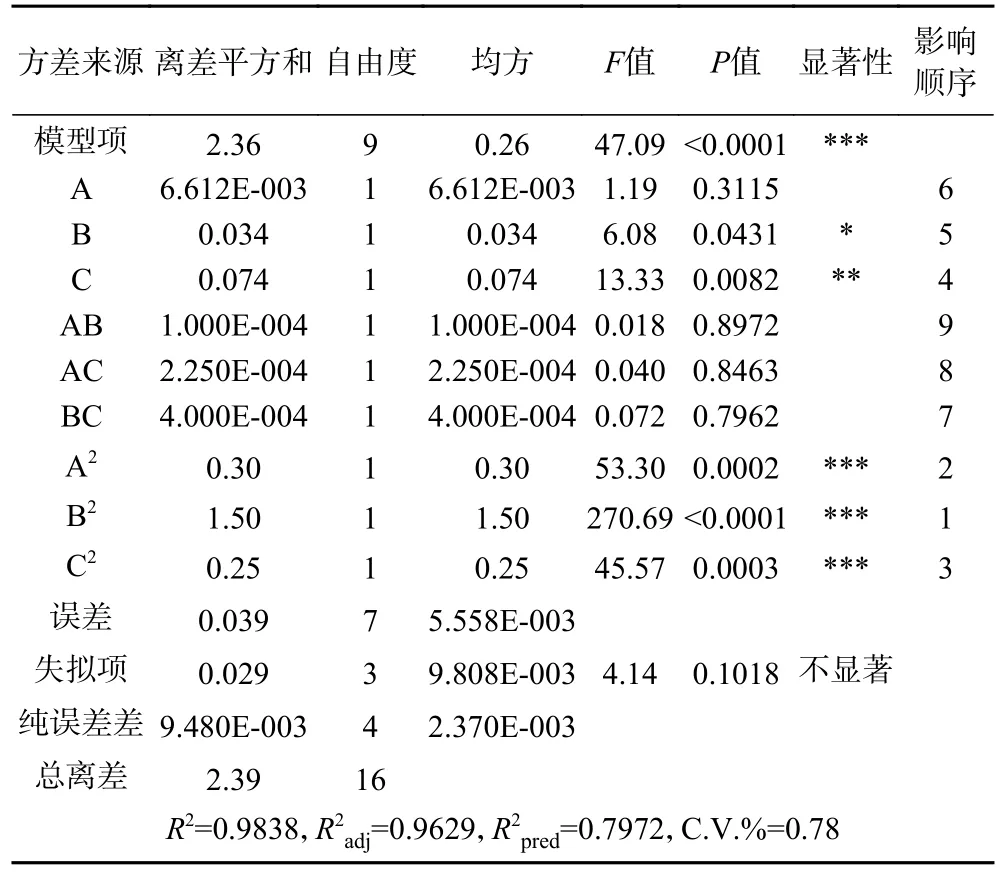
表8 Box-Behnken 试验回归模型及方差分析Table 8 Box-Behnken test regression model and variance analysis
由表8 可知,综合评分模型的F值为47.09,P<0.0001,说明模型均高度显著,模型成立。失拟项为4.14,P>0.05 不显著,说明未知因素对实验的影响小。该模型R2为0.9838,R2adj为0.9629,即表明该模型可以解释96.29%的纳豆发酵综合评分的变化,仅有大概3.71%变化不能被预测。模型与实际实验的拟合程度好,可用于分析与预测各因素对纳豆发酵产γ-PGA 综合评分的影响。由表8 可知,方程中一次项B 对纳豆发酵产γ-PGA 的综合评分影响显著(P<0.05),而一次项C 对纳豆发酵产γ-PGA 的综合评分影响较显著(P<0.01),二次项A2、B2、C2的影响极显著(P<0.001),说明各因素对纳豆发酵产γ-PGA 综合评分的影响呈二次关系,而非简单的线性关系。由F值检验可知各因素对综合评分影响的大小顺序为:C>B>A,即发酵时间>发酵温度>装瓶量。
2.5 响应面因素间的交互作用分析
为了更直观地观察3 因素之间的交互作用,确定综合评分最高点。根据上述回归方程和回归模型方差分析表,利用Design-expert 软件绘制响应面分析图及其等高线图(图7)。每个响应面代表在保持一个变量的最优条件下,其他两个自变量之间的交互作用对纳豆发酵产γ-PGA 综合评分的影响。
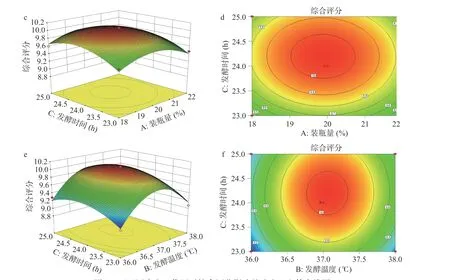
图7 两两因素交互作用对综合评分影响的响应面和等高线图Fig.7 Response surface and contour map of the interaction of pairwise factors on the comprehensive score
从图7 的响应面分析图可以看出,在一个变量确定的情况下,其他两个因素对综合评分的影响基本呈抛物线状,且存在极大值点,变化趋势为先增大后减小。响应面越陡,等高线的疏密度分布越不均匀,说明交互作用越大。图7 的(a)、(c)图中曲面相对较为陡峭,(b)、(d)图中等高线的疏密度分布较不均匀、呈近似马鞍形[38],说明装瓶量与发酵温度、装瓶量与发酵时间均有一定交互作用,对综合评分有一定的影响,但不显著,与表8 中的P值相对应(P>0.05)。图7 的(e)图虽然曲面相对较为陡峭,但是其等高线(f)图近似圆形,说明发酵温度与发酵时间的交互作用不显著,这与回归模型中的方差分析结果一致。

2.6 验证实验
回归模型预测的纳豆发酵产γ-PGA 最优发酵条件及综合评分为:装瓶量19.89%,发酵温度37.06 ℃,发酵时间24.20 h,综合评分为10.05。根据实际情况,将发酵条件修正为装瓶量19.90%、发酵温度37.10 ℃、发酵时间24.20 h,进行3 次平行发酵验证实验。结果得出,γ-PGA 产量为3.65 mg/g,感官总评分为31.67 分,综合评分为10.04 分。实际值与预测值无显著性差异(P>0.05),说明得到的最优发酵条件参数可靠,模型得到的实验结果具有较强的实际意义。
3 结论
以γ-PGA 产生量和纳豆感官总分的综合评分为依据,对纳豆发酵产γ-PGA 进行工艺优化。结果表明:在大豆浸泡pH、接种量、装瓶量、发酵温度和发酵时间单因素优化实验的基础上,采用Plackett-Burman 试验设计方法筛选出对综合评分影响最大的3 个因素是装瓶量、发酵温度和发酵时间。通过最陡爬坡试验选取接近综合得分最高的3 个重要水平,最后通过Box-Behnken 响应面试验设计,得到纳豆发酵产γ-PGA 的最优实际发酵条件:装瓶量19.90%、发酵温度37.10 ℃、发酵时间24.20 h,此时,综合评分为10.05。最终验证实验的综合评分为10.04,与预测值相差不大。这说明模型得到的预测结果稳定可靠,能够指导实际生产应用。

