粒径和含结合酚不溶性膳食纤维对白芸豆皮体外发酵特性的影响
金 姝,张 斌,高 彤,扶 雄,黄 强,
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.广州酒家集团利口福食品有限公司,广东广州 511445)
白芸豆(Phaseolus vulgarisLinn),生物学名为多花菜豆,富含蛋白质、多糖等多种营养成分[1]。目前对白芸豆的研究主要集中在酶抑制剂、植物凝集素等成分的提取分离及其保健功能等方面[2-3],加工过程会产生豆皮、豆渣等副产物,白芸豆皮占全豆颗粒质量的7.5%~8.0%,其细胞壁不溶性碳水化合物富含纤维素、半纤维素和木质素等膳食纤维[4],对其进行综合加工利用具有重要意义。
膳食纤维具有调节人体肠道微生物的种群丰度及肠道内环境平衡等重要作用。其中不溶性膳食纤维不仅可以促进肠道蠕动,增加排便,也能够被肠道微生物所酵解,产生短链脂肪酸(short-chain fatty acids,SCFAs),进而为肠道细胞提供营养,保护肠道健康[5],近年来已有研究报道了一些果蔬和植物中不溶性膳食纤维的大肠发酵特性[6-7]。此外,不溶性膳食纤维中通常还含有结合酚类物质,Saura-Calixto等[8]曾报道酚类等抗氧化剂可以以膳食纤维作为载体,通过氢键、疏水作用等与其联接形成结合态酚类化合物,到达结肠后经肠道菌群发酵释放并被进一步酵解转化为小分子酚类物质,在结肠内发挥其抗氧化、抗炎等生理活性,帮助保护肠道健康。
尽管不溶性膳食纤维有诸多益处,但其质地粗糙影响口感。通过微波、挤压、超微粉碎技术等方法能够有效改善其理化性质,降低界面张力和空间位阻效应,提升其口感和应用价值。超微粉碎技术现已用于姜粉、黄芪粉、麦麸膳食纤维等的改性[9-10],在粉碎的过程还会增加颗粒表面积,促进多酚等抗氧化物质的溶出释放[11]。目前已有文献报道了不同粒径膳食纤维的发酵速率及SCFAs 产量等基础的发酵动力学规律[12-13],但关于粒径对不溶性膳食纤维调节肠道菌群组成丰度的影响研究仍不够充分,因此本研究以白芸豆皮(whole skin powder,WS)为原料并提取得到其中的含结合酚不溶性膳食纤维(insoluble dietary fiber-bound phenolics,IB),将两者分别经过普通粉碎和超微粉碎得到不同粒径的样品,通过体外发酵实验对比不同粒径WS 和IB 的体外发酵特性,并探究其对肠道菌群结构的调控作用。本文将为后续对膳食纤维益生元效应的研究提供基础和方向,并可以指导白芸豆皮的废物利用和膳食纤维相关食品保健品的产业化开发。
1 材料与方法
1.1 材料与仪器
白芸豆皮 广州酒家集团利口福食品有限公司提供;低聚果糖 美国Ingredion 公司;中温α-淀粉酶(EC 号:232-565-6;活性:10000 U/g)、胃蛋白酶(EC 号:232-629-3;活性:3000 U/mg)、胰酶(EC 号:232-468-9;活性:4000 U/g)上海麦克林生化科技股份有限公司;其他试剂或药品均为分析纯。
Dhg-9070(A)恒温鼓风干燥箱 上海一恒科学仪器有限公司;FW80 高速粉碎机 天津市泰斯特仪器有限公司;XDW-6B 实验室专用低温超微粉碎机济南达微机械有限公司;Mastersizer 3000 马尔文粒度仪 英国Malvern 公司;EVO18 扫描电子显微镜 德国Zeiss 公司;Leica TCS SP5 激光共聚焦扫描显微镜 德国Leica Microsystems 公司;STA 8000同步热分析仪 美国PerkinElmer 公司;BS201S 型电子分析天平 德国 Startorius 公司;MR-Hei-Tec型加热型磁力搅拌器 德国Heidoiph 公司;LDZh-100KBS 型立式压力蒸汽灭菌锅 上海申安医疗器械公司;HYQX-II 厌氧培养箱 上海跃进医疗器械有限公司;7890A GC-FID 气相色谱仪 美国Agilent公司;DYY-6C 型电泳仪 北京六一生物科技有限公司;2720 型PCR 扩增仪 美国Applied Biosystems 公司;E6090 型TBS-380 荧光计 北京原平皓生物技术有限公司;nova seqPE250 高通量测序仪美国 Illumina 公司。
1.2 实验方法
1.2.1 白芸豆皮(WS)的粉碎改性 将湿豆皮原料清洗并去除杂质后放入40 ℃鼓风干燥箱内烘干48 h,烘干后用高速粉碎机进行粉碎[10],分别过200 目、40 目筛得到WS-200、WS-40,另取干豆皮用超微粉碎机在振幅5.5 mm、温度0 ℃的条件下进行干法振动式超微粉碎处理,并过500 目筛得到WS-500,将上述样品装进密封袋,在室温下储存于干燥器中备用。
1.2.2 含结合酚不溶性膳食纤维(IB)的提取及其粉碎改性 IB 的提取参考Go 等[14]的连续酶法并进行部分修改。将100.00±0.01 g WS 加入装有1000 mL 85%乙醇溶液的烧杯中,在30 ℃下超声除杂40 min,重复3 次,并用蒸馏水洗涤3 次。向上述处理的样品中加入800 mL pH7.5 的磷酸盐缓冲液(0.1 mol/L),用分散仪分散,调节pH 至1.5,加入3000 U/mg 的胃蛋白酶1.2 g 并在40 ℃下反应1 h。将pH 调节至7.5 后加入4000 U 的胰酶并在37 ℃下消化4 h。消化后将酶解体系加热至65 ℃处理40 min。然后加入800 mL 马来酸盐缓冲液(0.1 mol/L),将pH 调节至6.9,添加10000 U/g 的中温α-淀粉酶30 g 后在37 ℃下反应16 h。将样品在4500×g 离心10 min,沉淀用蒸馏水洗涤三次,真空冷冻干燥后得到IB。按上述WS 的粉碎方法将IB 进行粉碎处理,得到IB-40、IB-200、IB-500,置于干燥器中备用。
1.2.3 WS 和IB 主要成分的分析 总淀粉含量的测定按照Megazyme K-TSTA 总淀粉检测试剂盒方法;蛋白质含量的测定参考GB 5009.9-2016 的凯氏定氮法;纤维素、半纤维素、木质素含量的测定参考NY/T 3494-2019 方法;多酚含量的测定参考Hossain等[15]的方法并做适当修改,采用福林酚法,按没食子酸当量(mg GAE/g)测定;阿魏酸含量的测定采用高效液相色谱串联质谱法[16]。
1.2.4 样品的结构表征
普通高校社区学院,是近年来普通高校继续教育学院服务当地社区、开展社区教育的重要载体。普通高校社区学院以社区成员为主要教育对象,以非学历教育培训为主要形式,以满足社区成员文化教育需求为基本出发点和落脚点,具有显著的公益性质。
1.2.4.1 粒径的测定 将样品分散于蒸馏水中,用Mastersizer 3000 马尔文粒度仪测定样品的平均粒径和比表面积,采用湿法进样,折射率为1.336[17],测定时在3000 r/min 转速搅拌、80%功率超声条件下使样品在蒸馏水中保持分散均匀。
1.2.4.2 微观形貌的观察 扫描电子显微镜观察:分别取少量样品于粘有导电胶的样品台上,经过吹扫使其均匀分布,在真空状态下,使用离子溅射镀膜仪对其进行喷金,样品制备好后放入仪器内,在800×放大倍数下观察样品。加速电压为15 kV,工作距离(WD)为7.3 mm 左右;激光共聚焦显微镜观察:室温下在避光的环境中观察不同样品中结合酚。其中仪器的参数设置为:在10×物镜下,使用405 Diode 激光源,并将发射波长设置为440~470 nm[18]。拍摄明场和荧光场叠加视角的照片。
1.2.5 体外发酵实验
1.2.5.1 体外发酵条件 参考Wang 等[6]的方法进行并作适当修改。配制碳酸-磷酸盐缓冲液,将其与实验所需的其他材料一起放入高压灭菌锅中于121 ℃下灭菌20 min。然后趁热向碳酸-磷酸盐缓冲液中加入半胱氨酸盐酸盐并通入二氧化碳去除氧气,放入厌氧箱过夜。准确称取干基50 mg 的WS 和IB 样品于带有橡胶塞的厌氧小瓶中,低聚果糖(fructooligosaccharide,FOS)和不添加任何碳水化合物的厌氧瓶分别用作阳性和空白对照,然后与缓冲液一同转入厌氧箱。发酵所用的粪便样本取自三位年龄介于20~30 岁之间、身体质量指数(body mass index,BMI)均在正常范围内(18.5 kg/m2<BMI<25 kg/m2)的健康志愿者,志愿者提前签署知情同意书。在实验当天收集新鲜粪便样品于无菌试管中并立即转移到厌氧箱中,将三名志愿者的粪便混合与碳酸盐-磷酸盐缓冲液以1:3(w/v)的比例混合,然后通过四层纱布过滤得到粪便接种物溶液。将1 mL 粪便接种物溶液和4 mL 碳酸-磷酸盐缓冲液分别加入厌氧瓶中,用橡皮塞和铝盖封口后置于37 ℃水浴锅中振荡培养发酵并计时。
1.2.5.2 产气量的测定 分别在发酵4、8、12、24和48 h 后,从水浴锅中取出厌氧瓶,用带有刻度的注射器扎入橡胶塞,根据注射器的位移刻度量测量发酵产气量数据。随后打开橡胶塞停止厌氧微生物继续反应,然后分别收集发酵后的上清液和沉淀物并保存在-80 ℃以备后续测试。
1.2.5.3 短链脂肪酸含量的测定 解冻发酵后的上清液,利用气相色谱法[19]分析样品中短链脂肪酸的含量。将上清液在16000×g 转速下离心10 min,吸取800 μL 上清液与200 μL 内标混合物(含50 mmol/L 4-甲基戊酸)于无菌离心管中混合均匀。通过配备有FID 检测器的气相色谱仪分析短链脂肪酸的种类和含量,所用色谱柱为极性ZB-FFAP 毛细管柱(30 m×0.25 mm×0.25 μm)。柱温箱初始温度设置为80 ℃,以8 ℃/min 的速度升到192 ℃,并在192 ℃下保持3 min。前进样口和前检测器的温度设置为230 ℃,以1 mL/min 的恒定流速输送氮气作为载体。根据脂肪酸标准品的色谱图中各类短链脂肪酸的保留时间确定样品中短链脂肪酸的种类,再以脂肪酸标准品中4-甲基戊酸为内标与目标脂肪酸的峰面积之比为矫正因子,根据样品中各短链脂肪酸的相对峰面积进行定量。
1.2.5.4 DNA 提取和测序 解冻发酵后的沉淀物,参考试剂盒QIAamp®DNA Stool Mini Kit 的使用说明,将沉淀样品在13000 r/min 下离心10 min,弃去上清液,使用磷酸盐缓冲液将下层沉淀均质化,然后将其转移到盛有裂解液的管中,进行DNA 提取。从沉淀样品中提取细菌总DNA,储存在-20 ℃下等待分析使用。通过分光光度计测定提取的DNA 浓度,并用琼脂糖凝胶电泳鉴定其纯度。选择16S rRNA的标准细菌V3~V4 区进行PCR 扩增,整个反应在Thermocycler PCR 系统中进行,其主要程序包括:98 ℃下预变性2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,共包含25~27 个循环,最后72 ℃延伸5 min。PCR 产物使用Agencourt AMPure Beads 试剂盒进行纯化,其浓度通过双链DNA定量检测试剂盒测定。使用MiSeq Reagent Kit V3 试剂盒进行文库构建,在Illumina MiSeq 平台上机进行双端测序。
1.3 数据处理
实验数据以重复测量的平均值±标准差表示。使用SPSS 19.0 版本对数据进行统计分析。通过单因素方差分析(ANOVA)进行统计学差异分析,采用Duncan 多重检测综合评价试验组之间的差异(P<0.05)。使用GraphPad Prism 7.0 版本进行绘图。
2 结果与分析
2.1 WS 和IB 的主要成分
WS 和IB 中的主要成分如表1 所示。WS 中的主要成分是不溶性膳食纤维,主要包括纤维素、半纤维素和木质素等[5],其中纤维素和半纤维素含量较高,分别为28.64%±2.01%和32.65%±0.93%,木质素的含量最低,仅为1.37%±1.40%。此外WS 中还含有19.49%的淀粉。经过连续酶法提取得到的IB 中淀粉和蛋白质的含量明显降低了(分别为4.01%和0.51%),而纤维素的纯度提高了约30.57%,说明中温α-淀粉酶、蛋白酶和胰酶有效除去了WS 中的淀粉、蛋白质等杂质,提高了不溶性膳食纤维的纯度,该结果与刺梨果渣[6]的研究结果较为一致。WS 中多酚物质的含量为1.848 mg GAE/g,而IB 中多酚含量相对较低,为1.598 mg GAE/g,且IB 中阿魏酸含量也降低了24.8 μg/g,这是由于在提取IB 的过程中除去了部分游离酚类物质,造成阿魏酸等多酚含量的损失。

表1 WS 和IB 的主要成分Table 1 Main components of WS and IB
2.2 膳食纤维粒径分布及比表面积
白芸豆皮及其膳食纤维的粒径分布如图1 和表2 所示,从图中可以出,所有样品均只有一个明显的粒径分布峰,说明样品颗粒尺寸分布较为均匀,且不同目数的样品分别在20、110、500 μm 存在一个主峰,平均粒径分布差异较为明显。WS 和IB 的体积平均粒径经过普通粉碎后分别从575.00、480.67 μm 降到127.67、111.33 μm,经过超微粉碎改性后的WS-500 和IB-500 则分别可以达到33.00、28.27 μm 左右(表1)。相同粒径级分的WS 和IB其比表面积也有所不同,WS-40 的比表面积仅为18.24 m²/kg,显著低于IB-40 的41.84 m²/kg(P<0.05),这是由于WS 结构完整,含有淀粉等成分,而IB 中大量的纤维状结构使其具有更大的比表面积[5]。随着粒径的减小,WS 和IB 的比表面积逐渐增大,值得注意的是WS-500 的比表面积显著大于IB-500(P<0.05),这可能是由于超微粉碎过程剧烈的撞击破坏了IB 的微粒结构及其内部的纤维状网状结构[20],比表面积的增大能够使其具有更好的持水性、持油性、抗氧化活性等理化性质[10]。

表2 不同样品的粒径分布和比表面积Table 2 Particle size and specific surface area of different samples
2.3 膳食纤维微观形貌
六种样品的微观形貌如图2 所示。从图中可以看出,白芸豆皮(WS)的微观结构较为完整致密,还有少量块状和球形颗粒,可能是豆皮中存在的淀粉等成分。而经过连续酶法提取得到的不溶性膳食纤维(IB)中难以观察到球状的颗粒,说明连续酶法操作除去了豆皮中的淀粉、蛋白质等杂质,且IB 呈海绵状网络结构,有较多明显的孔隙和通道,结构疏松,与Zhang 等[21]观察到的银耳不溶性膳食纤维的形貌较为接近。随着粒径的降低,样品颗粒明显减小,WS-500 有较多的片状结构,有部分黏连;而IB-500 则有部分呈条形结构,与IB-40 和IB-200 相比发生了明显的破碎和裂解,这是由于在超微粉碎过程中的高速剪切、冲击和研磨使得样品剧烈碰撞,粒径急剧减小[22]。比表面积的增大将使其在进入结肠后提高肠道微生物对其的附着性和生物可及性,增强其可发酵特性[23]。

图2 不同样品的扫描电子显微镜图Fig.2 Scanning electron microscopy image of different samples
六种样品的激光共聚焦扫描显微图见图3,图中可观察到不同粒径大小样品中所含结合酚的存在情况。阿魏酸是结合酚中的一种重要的酚酸,广泛存在于植物中,且通常与细胞壁多糖等大分子物质相结合,在405 nm 的激发波长下,阿魏酸能够自发绿色荧光[24]。从图中可以出,WS 和IB 两种样品中均存在一定含量的阿魏酸,IB 中的荧光较WS 稍弱,可能是在提取IB 过程中部分游离阿魏酸被除去。随着粒径的减小,两类样品中的绿色荧光都更为明显,说明粉碎过程阿魏酸容易裸露于颗粒表面,分散更为均匀。因此,超微粉碎可以提高多酚的生物可及性,与文献报道一致,即超微粉碎处理能够破坏微粒结构,促进更多小分子活性物质的溶出[22]。
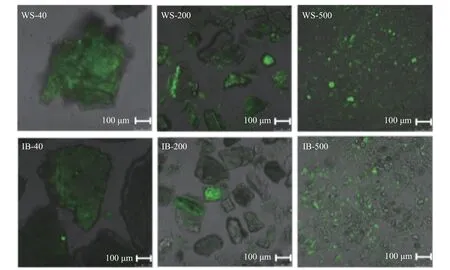
图3 不同样品的激光共聚焦扫描显微镜图Fig.3 Laser confocal scanning microscopy image of different samples
2.4 膳食纤维体外发酵产气量和发酵速率
发酵过程中的产气量通常可以作为发酵速率的指标[25]。图4 展示了不同粒径样品在48 h 体外发酵过程中的产气量。阳性对照FOS 产气量和产气速率最高,短时间迅速产生较多的气体容易引起腹胀等不适症状[19]。与FOS 相比,WS 和IB 中主要是不溶性膳食纤维等不易被酵解的成分,故样品的产气量相对较低,发酵速率较为平缓,这种缓慢的持续性发酵使得底物能够逐渐进入远端结肠并在此提供短链脂肪酸等能量和营养物质[26]。
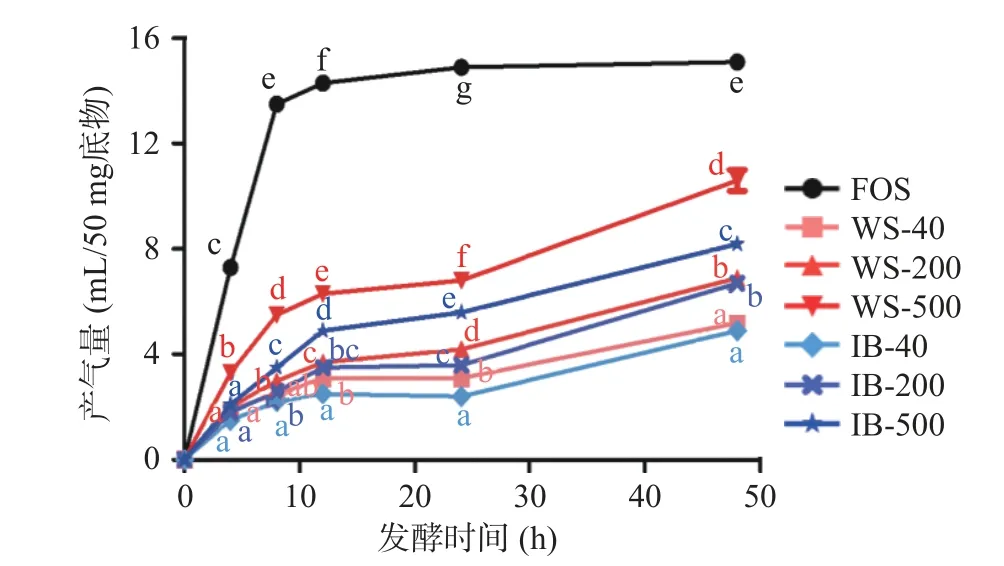
图4 不同样品体外发酵48 h 过程中的产气情况Fig.4 Gas production during 48 h in vitro fecal fermentation time course
IB 的产气量和产气速率均低于WS,即IB 比未处理的WS 具有更好的慢发酵特性,这是由于在WS 中淀粉等其他易被酵解的组分含量较高。从粒径大小分析,WS 和IB 组内三个样品的产气量和产气速率均为500 目>200 目>40 目,即粒径越大的底物发酵速率越慢,而粒径越小的底物因为具有更大的比表面积,即有更大的微生物-基质界面[13],且表面较为多孔、粗糙,更容易被肠道微生物附着和利用,发酵速率相对较快。
2.5 短链脂肪酸的组成和浓度分析
在大肠发酵过程中膳食纤维等底物会被肠道微生物发酵降解而产生乙酸、丙酸和丁酸等短链脂肪酸(SCFAs),SCFAs 可以降低结肠内环境的pH,改善肠道微生物的组成结构,减少肠道粘膜的损伤,维持肠道健康[27],所以其浓度可以用来表征膳食纤维的益生元活性[7]。不同粒径样品在48 h 体外发酵过程中短链脂肪酸的产量如图5 所示,从图中可以看出,WS 的产酸量均高于IB,两组样品随着粒径减小,产酸量提高,与产气情况一致。FOS 作为阳性对照,乙酸产量始终最高,24 h 和48 h 时丙酸和丁酸的产量也显著高于样品组(P<0.05)。与FOS 相比,前12 h 内不同粒径的WS 和IB 在产丙酸方面都有一定优势,从图中可以看到前12 h 六种样品的丙酸产量均高于FOS,该结果与之前的报道较为一致[6],这是由于丙酸主要由膳食纤维中的葡萄糖、木糖、甘露糖等发酵而来,丙酸盐能够抑制内源性胆固醇的合成,还是一种有效的肝脏糖异生底物,对代谢健康产生积极影响[28]。不同粒径IB 在丁酸产量上没有明显差异,而不同粒径WS 丁酸产量差异显著(P<0.05),WS-500的丁酸产量显著高于WS-200 和WS-40,造成两组样品差异的原因可能与其淀粉含量有关,IB 中淀粉含量较WS 中低(表1),而生淀粉颗粒在发酵过程中对丁酸产量的增加具有重要贡献[19],WS 粒径越小,发酵速度越快,到达发酵平台的时间越早,可以为微生物利用乙酸和乳酸交互共生提供足够的时间,从而产生更多的丁酸[13]。
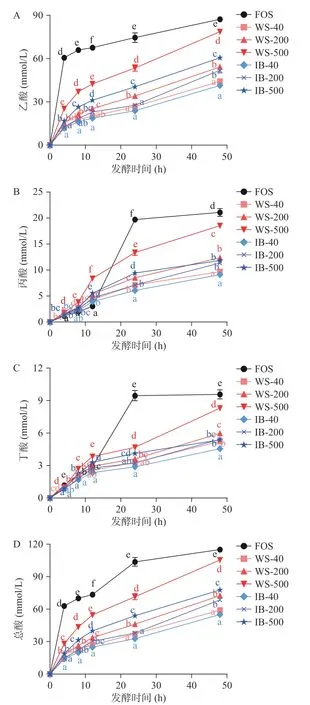
图5 不同样品体外发酵48 h 过程中产乙酸(A)、丙酸(B)、丁酸(C)和总酸(D)的情况Fig.5 Acetate (A),propionate (B),butyrate (C) and total SCFA(D) production during 48 h in vitro fecal fermentation time course
2.6 肠道菌群组成丰度
通过16s rRNA 基因测序,定量分析体外发酵48 h 后肠道菌群分别在门水平(A)和属水平(B)上的组成丰度,结果如图6 所示。从门水平上看,与空白组相比,FOS 显著促进了Actinobacteria 的丰度,而WS和IB 则对Bacteroidetes 丰度的增值效果更为明显,同时也一定程度上促进了Firmicutes 的相对丰度。FOS 作为阳性对照,具有公认的益生元效应,可以促进多种Actinobacteria 的丰度[19]。从粒径大小的对比来看,在WS 组中,随着粒径减小,Firmicutes 的相对丰度也逐渐增高,这一现象在IB 组中有一些差异,IB-200 组Firmicutes 的丰度高于IB-40,但IB-500 组中Firmicutes 的丰度反而有所下降,而Actinobacteria 的丰度显著增加了,推测超微粉碎改性得到的IB-500 比表面积更大,更适合具有粘附能力的Actinobacteria 所粘附利用,从而快速生长[29]。

图6 不同样品体外发酵48 h 后肠道菌群在门水平(A)和属水平(B)上的物种组成丰度Fig.6 Microbial community composition at the phylum level(A)and genus level(B)after 48 h in vitro fecal fermentation
在属水平上,FOS 对Bifidobacterium丰度的促进尤为明显,这与之前的报道一致。Bifidobacterium作为一种重要的肠道有益菌可以促进碳水化合物酵解转化形成乳酸和乙酸[30],这应该是FOS 组具有较高的乙酸和丙酸含量的原因。与空白组相比,WS和IB 均促进了Bacteroides的相对丰度,且WS 的促进效果要优于IB,Bacteroides是人体肠道菌群中一类最基本的降解多糖的菌属,具有非常广泛的糖化作用,能够有效酵解部分难以消化的膳食纤维[6]。与WS 相比,IB 的优势显示在对Ruminococcaceae ruminococcus和Lachnospira两种菌属丰度水平的促进上,其中Ruminococcaceae ruminococcus可以发酵不溶性膳食纤维中的纤维二糖和纤维素并产生乙酸和丁酸[6]。从粒径角度分析,WS 和IB 两组样品对Bacteroides的促进效果均呈现出粒径越小,促进效果越好的趋势。值得注意的是,与WS-200 和IB-200 相比,在WS-500 和IB-500 组中均观察到Ruminococcaceae ruminococcus和Lachnospira相对丰度的降低,尤其是Lachnospira,这可能说明不同的菌属对于底物粒径的选择有不同的偏好[31],Lachnospira可能更偏向于利用粒径适中的底物。此外,IB-500 对Bifidobacterium丰度也有一定的促进作用,且该效果明显高于IB-40 和IB-200。益生菌菌株与膳食纤维的相互作用是其发挥益生效果的一个重要因素,Bifidobacterium对膳食纤维有很大的粘附力,对纤维素的粘附机制主要涉及疏水相互作用和静电相互作用[32],因此IB-500 可能因其粒径较小,比表面积较大,增强了其与Bifidobacterium的粘附作用,进一步显著促进了Bifidobacterium的丰度。
2.7 ASV 水平肠道菌群丰度分析
各样品在体外发酵48 h 后肠道菌群中最丰富的ASVs 和关键ASV(绿色显示)的组成差异在聚类热图(图7)中进行了更直观的展示。与空白组相比,FOS 明显提高了ASV9013、ASV8209、ASV13871 和ASV189 这四个ASV 的相对丰度。6 个样品组的颜色区域与空白组和FOS 组相比均有明显不同,表明WS 和IB 的酵解显著改变了肠道菌群的组成。从图中可以注意到WS 和IB 的发酵在降低了ASV18112、ASV21919、ASV9013、ASV542 和ASV8209 几个ASV 的同时显著提高了unidentified Lachnospiraceae ASV168 和 unidentified Clostridiales ASV16610、ASV4234 和ASV4936 的相对丰度(P<0.05)。两组样品相比,WS 还促进了BacteroidesASV26058、ASV6075、ASV9536 的相对丰度,IB 则显示出对unidentified Lachnospiraceae ASV26400、LachnospiraASV13961 以 及RuminococcusASV6393 等ASV 的促进。随着粒径的减小,WS 和IB 组中ASV168、ASV16610、ASV4234 和ASV4936 等几个ASV 的热图颜色均越深,说明粒径越小,WS 和IB 对上述ASV 的丰度增加越显著(P<0.05)。值得注意的是,unidentified Lachnospiraceae ASV26400和LachnospiraASV13961 两个ASV 的丰度变化有所不同,WS-500 和IB-500 相比于WS-200 和IB-200均使其相对丰度显著下降(P<0.05),这也与属水平上观察到的现象相符,这可能是由于Lachnospira中的不同种科类其对于底物颗粒大小有不同的偏好[31]。与之相反,只有WS-500 和IB-500 的发酵促进了BacteroidesASV13871 的相对丰度,且IB-500 的促进效果更为显著(P<0.05),粒径较大的40 目组和200 目组均没有促进效果,前期研究表明,B.uniformis会趋向于在较小颗粒的玉米麸皮颗粒上聚集[31]。此外,只有IB-500 显著提高了BifidobacteriumASV189 的相对丰度,这与属水平上IB-500 显著促进Bifidobacterium相对丰度的结果一致,表明不同种属的肠道微生物对底物的粒径有不同的偏好。

图7 不同样品体外发酵48 h 后肠道菌群ASV 水平物种丰度热图Fig.7 Heatmap of the microbial community composition at ASV level after 48 h in vitro fecal fermentation
2.8 肠道菌群组成结构的PCA 图分析
针对上述不同样品体外发酵48 h 后肠道微生物群落的差异,PCA 图(图8)给出了更为直观的主成分分析结果。前两个主成分捕获了81.25%的微生物群落变异(PC1:56.98%,PC2:24.27%)。FOS 与BifidobacteriumASV9013 显著相关(P<0.05),与前述分析一致。WS 组和IB 组相比,相同粒径下的IB 对PhascolarctobacteriumASV559 和RuminocccusASV6393 的贡献均比WS 更大,这可能是由于IB 中的膳食纤维纯度更高,更有利于促进有益菌的生殖,即具有更好的益生效应[33]。从粒径大小分析,WS-40 与 WS-200 以及 IB-40 与 IB-200 在 PCA图中均没有显著分离,都与ASV26400、ASV559、ASV6393 有关;而WS-500 和IB-500 则产生了明显的分离,说明粒径的急剧减小对于微生物群落变异有显著的影响,与Yao 等[13]对多种不同粒径膳食纤维(谷物、豆类、坚果、蔬菜、水果和麸皮)的研究结果一致,即不同粒径底物的发酵结果不同,且粒径对不同化学成分膳食纤维底物的发酵结果的影响也不一致。粒径接近的WS-500 和IB-500 就产生了不同的发酵结果,WS-500 与unidentified Lachnospiraceae ASV168 和unidentified Clostridiales ASV4234 高度相 关,而 IB-500 则 与BacteroidesASV13871 和BifidobacteriumASV189 高度相关,具有更为显著的益生效果。其中Bacteroides不仅能够通过多糖利用位点(polysaccharide utilization loci,PULs)来编码多糖降解系统的基因簇来降解半纤维素等,还可以使用PUL 机制参与与其相邻微生物Eubacterium ramulus之间的交互共生关系[34]。由于IB 含有结合酚,所以当Bacteroides利用其多糖部分将葡萄糖发酵转化为丁酸的同时还能促使Eubacterium ramulus降解黄酮类化合物,这种PUL 介导的种间互生过程不仅有利于肠道微生物获得所需的营养物质,对人类肠道健康也可能起到有益的作用[35]。相同粒径大小的IB 较WS 具有更好的、更为明确的益生元活性,促进有益菌的生殖,改善肠道菌群结构。

图8 不同样品体外发酵48 h 后肠道菌群ASV 水平的主成分分析Fig.8 PCA analysis of the microbial community composition at ASV level after 48 h in vitro fecal fermentation
3 结论
经过超微粉碎后,WS 和IB 的粒径急剧减小,比表面积显著增大,其中的结合酚更均匀地分散于颗粒表面。体外发酵实验证明了WS 和IB 都具有慢发酵性,可以产生丰富的乙酸、丁酸等短链脂肪酸,其发酵速率和产酸量均随着粒径的减小而提高,且WS的发酵速率和产酸量均高于对应粒径的IB。菌群组成分析发现粒径越小的WS 和IB 对Bacteroides丰度的促进效果也越显著,但是部分有益菌对底物粒度表现出不同的偏好,其中Lachnospira倾向于在较大粒径的样品组中增殖。IB 中膳食纤维的纯度更高,使得相同粒径分级下IB 对肠道菌群组成的正向调控作用比WS 更为显著,可以促进Bacteroides、Bifidobacterium和Ruminococcaceae ruminococcus等有益菌的相对丰度。底物成分和粒径大小会共同决定发酵结果,在实际应用中应该选择膳食纤维含量更高的底物,并通过粉碎方法适当降低其粒径以获得更好的益生效应。

