鸡miR-133a-3p的表达、生物信息学分析及其靶基因初筛






摘要:为了研究鸡不同组织中miR-133a-3p的表达情况并预测其靶基因,进行GO、KEGG富集分析,对关键靶基因进行初筛,阐明其在机体中的作用。通过miRBase检索15个物种的miR-133a-3p序列,采用MEGA 7.0进行多物种序列比对及系统进化树构建;使用TargetScan、miRDB预测鸡miR-133a-3p的靶基因,再取交集,对其进行GO、KEGG富集分析;通过qPCR检测miR-133a-3p在罗斯308肉鸡各组织中的表达量,并检测其靶基因在不同生长周龄(W0~W6)胸肌中的表达规律。结果表明,不同物种miR-133a-3p的成熟序列同源性极高,物种间保守,系统进化树分析发现,鸡miR-133a-3p与原鸽聚为一支;预测获得145个靶基因,GO富集分析显示,靶基因富集到酶活性调控、分子功能负调控、内质网系统形成、肌球蛋白结合等条目,KEGG结果显示,靶基因富集到p53、mTOR、FoxO、肌动蛋白细胞骨架调控等多条与肌肉生长发育相关的信号通路;对肌肉生长发育相关通路进行分析,挖掘到PIK3CB、NRAS、EGFR、PRKAA1、IGF1R这5个显著富集基因;miR-133a-3p仅在胸肌、腿肌、心脏中表达,且在胸肌中的表达量显著高于心脏、腿肌(Plt;0.01);随着生长周龄的增长,miR-133a-3p在胸肌中的表达量先升后降,而靶基因IGF1R的表达量呈先降后升的规律,它们的拐点均在第3周龄,二者负相关。综上说明,鸡miR-133a-3p在肌肉组织中特异性表达,很可能通过靶基因IGF1R调控肌肉生长发育。
关键词:鸡;miR-133a-3p;生物信息学;表达分析;肌肉生长发育;靶基因筛选
中图分类号:S831.2" 文献标志码:A
文章编号:1002-1302(2024)24-0179-08
收稿日期:2024-07-02
基金项目:四川省科技厅科技计划(编号:2019YJ0341);国家开放大学产教融合协同育人中心建设试点项目(编号:2023CY3314)。
作者简介:余春莲(1991—),女,重庆人,硕士,讲师,主要研究方向为畜禽遗传育种。E-mail:519154841@qq.com。
通信作者:杨炜蓉,博士,副教授,主要研究方向为动物遗传育种。E-mail:constance890711@126.com。
在畜禽育种与生产中,肌肉发育是一个关键的生物学过程,它直接影响动物的生长速度、肉质及经济价值[1]。随着生物信息学和分子生物学的迅速发展,人们对肌肉发育相关基因及其调控机制的认识越来越深入。微小RNA(microRNA,miRNA)是一种长约22 nt的内源性非编码RNA,通过与肌生成相关基因相互作用,控制成肌细胞增殖、分化等肌生成过程,在肌肉发育中发挥着至关重要的作用[2]。miR-133是一类肌肉组织特异性表达且高保守的功能型miRNA,它通过其序列结构、丰度表达、多样性的转录方式,调控肌发育相关基因表达,从而调控骨骼肌细胞的增殖和分化过程[3-5]。miR-133a-3p作为miR-133家族中的一员,已被证实在小鼠、山羊、牛、人和虹鳟鱼等物种的骨骼肌细胞增殖分化、肌管形成、肌肉损伤修复、肌肉再生过程中发挥重要功能[6-11]。然而,miR-133a-3p在家禽中的研究较少,特别是关于它对鸡骨骼肌生长发育的研究仍不清楚。在鸡这一重要的经济动物中,肌肉发育的质量直接关系到其生产性能和商业价值,对鸡肌肉发育相关miR-133a-3p的研究显得尤为重要。Li等发现,miR-133a-3p在鸡骨骼肌中的表达差异上调,证实它与肌肉生长发育密切相关,然而对它的分子调控机制以及在不同组织中的表达规律并没有研究[12-14]。本研究采用生物信息学分析手段,对鸡miR-133a-3p的序列特征、保守性、靶基因预测等方面进行综合分析,旨在揭示其在鸡肌肉发育中的潜在调控机制。同时,本研究利用qPCR技术检测miR-133a-3p在罗斯308肉鸡各组织中的表达水平以及miR-133a-3p及其靶基因在不同生长周龄胸肌组织中的表达规律,对靶基因进行初筛。
1 材料与方法
1.1 试验动物
饲养试验于2024年4—6月在四川大恒家禽育种有限公司开展。以罗斯308肉鸡为试验素材,按照动物试验伦理委员会的要求,于1日龄(W0)饲喂至6周龄(W6)。期间每周龄采集1次样品,每次采集3只。采集组织样品包括心脏、肝脏、脾脏、肺脏、肾脏、胸肌、腿肌,样品经液氮速冻后于-80 ℃冷冻保存。
1.2 主要试剂
反转录试剂盒(PrimeScriptTM IV 1st strand cDNA Synthesis Mix)购自日本TaKaRa公司;QuantiNovaTM SYBR Green PCR试剂盒、DNase/RNase-free去离子水购自西格玛奥德里奇(上海)贸易有限公司;TRIzolTM Plus RNA 纯化试剂盒购自赛默飞世尔科技公司。
1.3 试验方法
1.3.1 查询miR-133a-3p的位置及其序列、结构
利用miBase (https://mirbase.org/)下载鸡(Gallus gallus)、斑马鱼(Danio rerio)、原鸽(Columba livia)、猩猩(Pan troglodytes)、眼镜王蛇(Ophiophagus hannah)、鲤鱼(Cyprinus carpio)、西洋鲑(Salmo salar)、牛(Bos taurus)、猪(Sus scrofa)、兔(Oryctolagus cuniculus)、小鼠(Mus musculus)、人(Homo sapiens)、鹌鹑(Callithrix jacchus)、鸭嘴兽(Ornithorhynchus anatinus)、山羊(Capra hircus)这15个物种的miR-133a-3p序列(表1),并在NCBI上查询gga-miR-133a-3p(登录号:MIMAT0001126)在基因组上的定位信息。
1.3.2 miR-133a-3p序列比对及系统进化树构建
利用MEGA 7.0 软件的Alignment程序,对已获取15个物种的miR-133a-3p成熟体进行不同物种间的序列对比;通过MEGA 7.0软件的 phylogeny程序,计算各模型组合的贝叶斯信息准则分数,采用基于距离参数的邻接法(neighbor-joining,NJ),构建miR-133a-3p的系统进化树。
1.3.3 gga-miR-133a-3p靶基因预测及功能分析
分别利用2个在线网站miRDB(https://mirdb.org/index.html)、Targetscan(https://www.targetscan.org/vert_80/),预测gga-miR-133a-3p的靶基因。利用在线工具Draw Venn Diagram(https://bioinformatics.psb.ugent.be/webtools/Venn/)对2个网站的预测结果取交集,以降低假阳性。利用R包ClusterProfiler v4.2对gga-miR-133a-3p的靶基因交集进行基因本体论(GO)及京都基因与基因组百科全书(KEGG)富集分析。基于Plt;0.05的筛选标准,选择显著富集的GO条目和KEGG通路,最终结果以矩状气泡图的形式呈现。
1.3.4 组织表达分析
采用TRIzolTM Plus RNA 纯化试剂盒提取罗斯308肉鸡各组织样品的总RNA,按照反转录试剂盒操作步骤合成cDNA,通过实时荧光定量PCR方法检测基因的相对表达量。分别以U6、β-actin为内参,每个样品重复3次,采用2-ΔΔCT法计算gga-miR-133a-3p及其靶基因的相对表达量,引物信息见表2。扩增体系(总体积为 10 μL):上下游引物各0.5 μL,SYBR Green 5 μL,cDNA 1 μL,ddH2O 3 μL;扩增程序:95 ℃预变性 3 min;95 ℃变性20 s,55 ℃退火20 s,72 ℃延伸20 s,共39个循环。
1.4 数据分析
gga-miR-133a-3p及其预测靶基因的组织表达量数据均使用SPSS 24.0软件进行单因素方差分析;试验结果用平均值±标准差表示,最后将数据导入Graphpad Prim 9.0,绘制柱状图和折线图。
2 结果与分析
2.1 gga-miR-133a-3p的结构与定位
gga-miR-133a-3p定位于鸡20号染色体上基因LOC101747836内部;前体序列gga-miR-133a全长95 bp,其5′-UTR、3′-UTR分别加工生产2个成熟的miRNA,分别为gga-miR-133a-5p、gga-miR-133a-3p,并构成发夹结构(图1)。
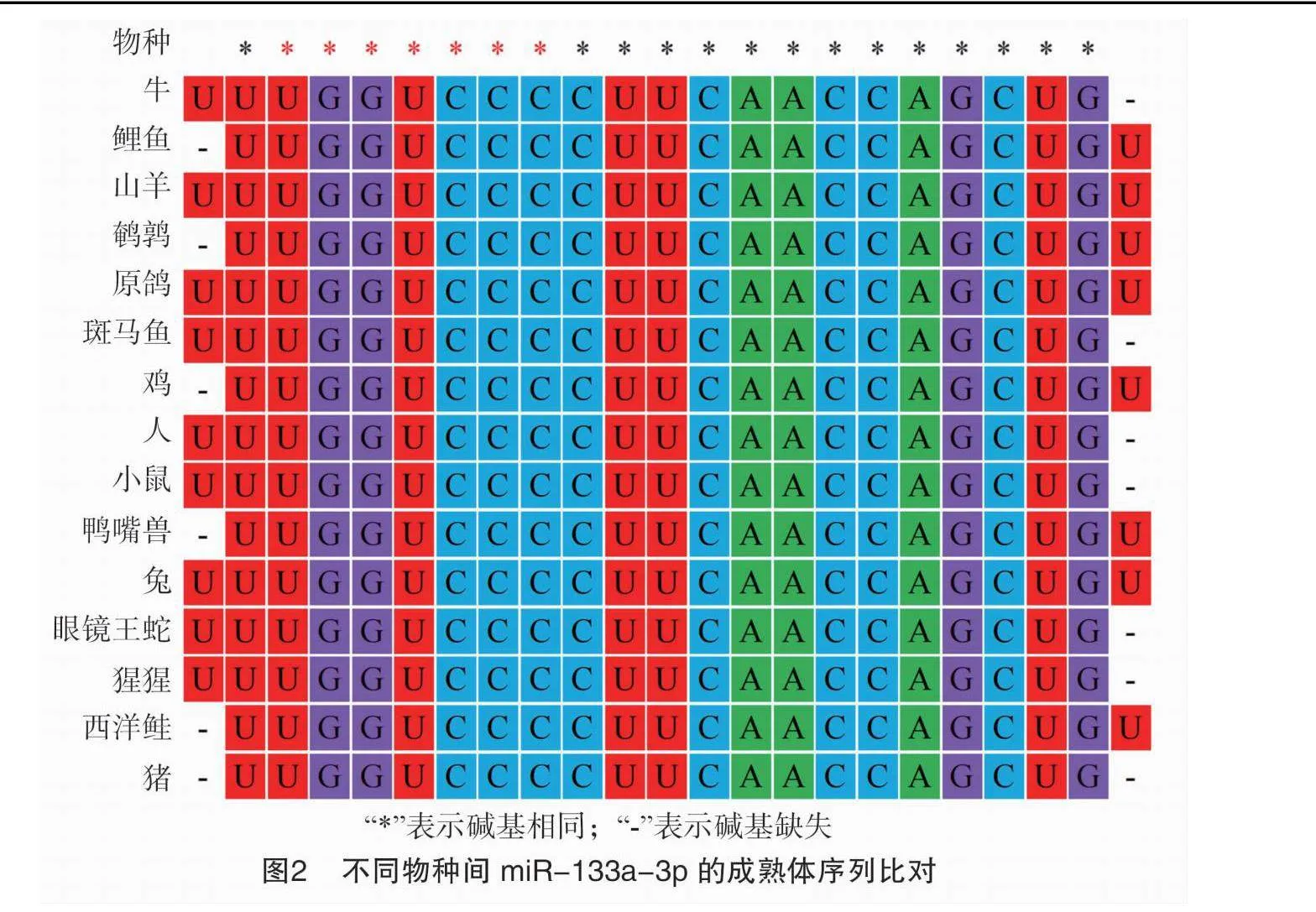
2.2 miR-133a-3p不同物种间序列比对分析
对15个物种的miR-133a-3p成熟体序列进行多序列比对分析,结果见图2。各物种间miR-133a-3p成熟体序列基本相同,同源性极高,且序列长度基本相同,均为21~23 nt。其中21个碱基(即第2~22位碱基)高度保守,仅第1、23位的U碱基存在个别缺失。各物种的miR-133a-3p的种子序列(UGGUCCC)完全一致。
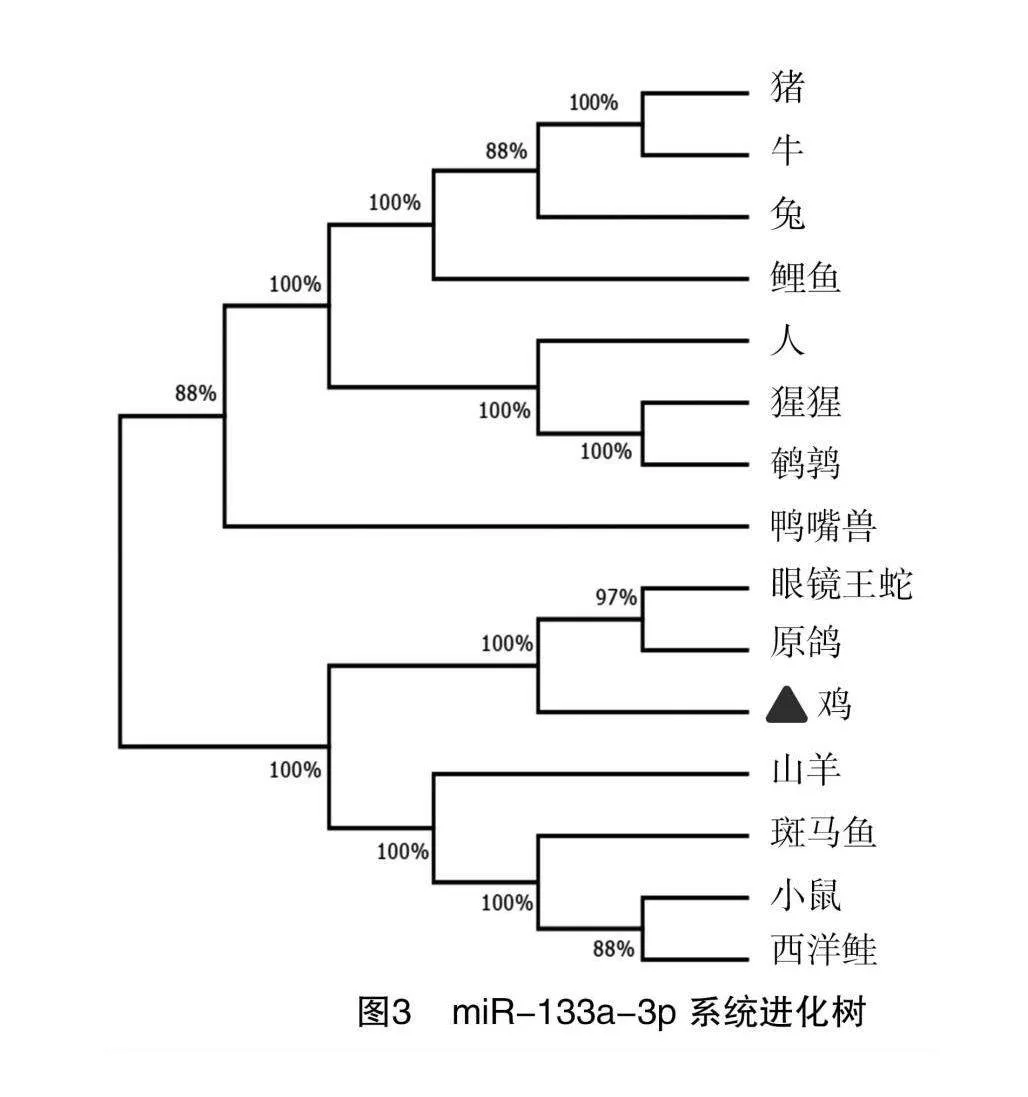
2.3 miR-133a-3p系统进化树构建
利用MEGA 7.0 软件对miR-133a-3p在鸡、原鸽、鹌鹑、猪、牛、山羊、兔、小鼠、西洋鲑、鲤鱼、眼镜王蛇、猩猩、人、鸭嘴兽、斑马鱼这15个物种的前体序列进行比对分析,构建系统进化树。结果(图3)表明,miR-133a-3p在进化中保守性较高,成熟序列基本相同;鸡与原鸽聚为一支,二者同为鸟类。
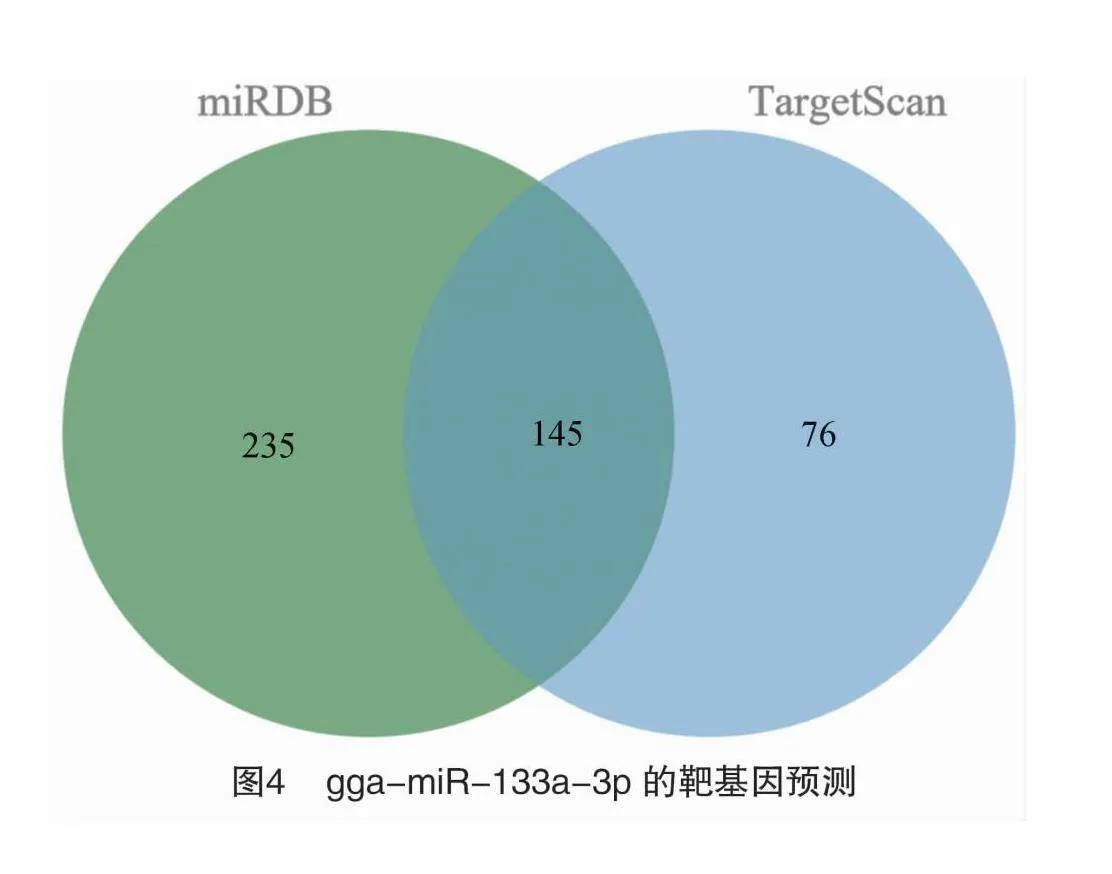
2.4 gga-miR-133a-3p靶基因预测
通过2个在线数据库miRDB、TargetScan对 gga-miR-133a-3p的靶基因进行预测,分别预测到380、221个靶基因; 取2个预测结果的交集降低其假阳性,共得到145个共同靶基因(图4)。
2.5 gga-miR-133a-3p靶基因的GO富集分析
对gga-miR-133a-3p的靶基因进行GO富集分析,分为BP(生物学过程)、CC(细胞组分)、MF(分子功能)3个部分,结果见图5。在BP中,靶基因主要富集于mRNA代谢过程调控、细胞因子响应、酶活性调控、分子功能负调控、酶联蛋白受体信号途径等条目;在CC中,靶基因主要与内质网系统、高尔基氏体、细胞核、囊泡等的形成有关;关于MF,靶基因主要具有与肌球蛋白结合、酶活性等分子功能。
2.6 gga-miR-133a-3p靶基因的KEGG富集分析
对gga-miR-133a-3p的靶基因进行KEGG通路富集分析,结果如图6所示。靶基因主要参与线粒体自噬、磷酸酰肌醇信号系统、肌动蛋白细胞骨架调控、mTOR、FoxO、p53、嘌呤代谢、泛酸和辅酶A生物合成等信号通路。肌肉发育相关信号通路及其靶基因见图7。其中PIK3CB、NRAS是肌动蛋白细胞骨架、mTOR、FoxO 这3条信号通路的共同基因;EGFR是肌动蛋白细胞骨架、FoxO信号通路的共同基因;PRKAA1、IGF1R是mTOR、FoxO信号通路的共同基因。
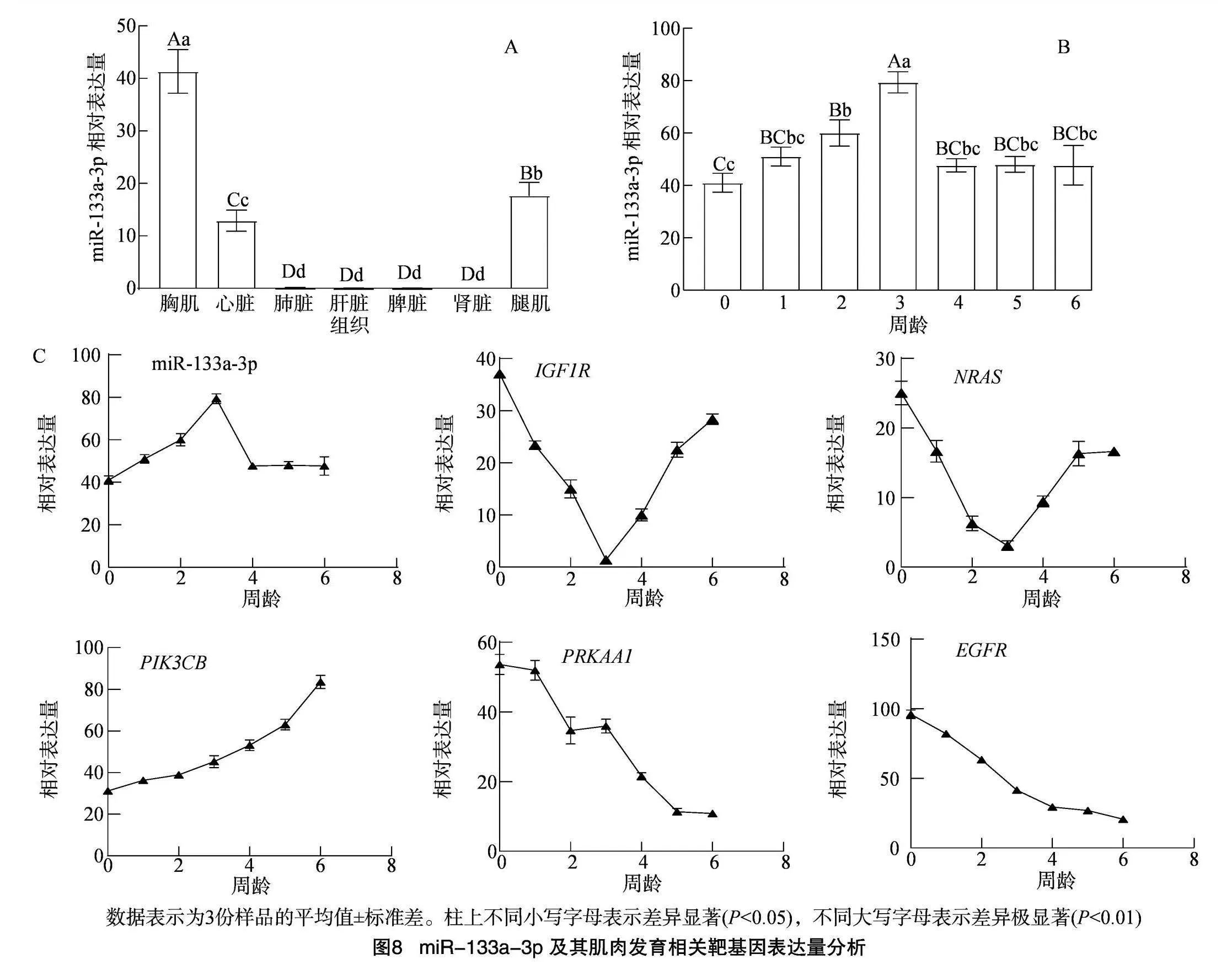
2.7 gga-miR-133a-3p组织时间表达谱及靶基因初筛
gga-miR-133a-3p 的组织表达情况如图8-A所示,在肝脏、肺脏、脾脏、肾脏中均未检测到 gga-miR-133a-3p表达,仅在胸肌、腿肌、心脏中表达,且在胸肌中的表达量极显著高于心脏、腿肌(Plt;0.01),在腿肌中的表达量极显著高于心脏(Plt;0.01)。gga-miR-133a-3p 的时间表达情况如图8-B所示,在罗斯308肉鸡胸肌中,随着周龄(W0~W6)的增长,miR-133a-3p表达量呈先升后降的规律,且在3周龄达到表达量峰值。对5个肌肉发育相关信号通路富集靶基因在不同生长阶段胸肌中的表达规律进行检测,结果如图8-C所示。IGF1R的mRNA表达量随着周龄的增长呈先降再升的规律,与miR-133a-3p表达量先升后降的规律相反,且它们的拐点均出现在3周龄。
3 讨论
骨骼肌生长发育是一个复杂的生物学过程,受到众多基因和信号通路的协同调控。本研究从miRNA分子角度,探究其在肌肉生长发育中的调控机制。miRNA是一类长约22 nt的小分子非编码RNA,主要通过其种子区序列与靶基因的3′-UTR靶序列特异性识别结合形成沉默复合物,从而抑制靶基因翻译[1,15-16]。miR-133a-3p是肌源性miRNA-133家族中的一员,已在多个物种中被证实参与肌肉相关基因的表达[6-11]。本研究通过qPCR检测技术发现,gga-miR-133a-3p在罗斯308肉鸡的肾脏、肺脏、脾脏、肝脏中均未被检测到,而在胸肌、腿肌、心肌中高度表达,这说明gga-miR-133a-3p是一种肌肉特异性表达miRNA,这与Li等的研究结果[12-14]一致。罗斯308肉鸡属于快大型肉鸡,生长速度快,3~4周龄达到生长速度高峰期,第6周龄(W6)就可生长至2.5 kg的上市体重。在试验中,我们发现miR-133a-3p表达量随着罗斯308肉鸡生长日龄的增长,呈先增后降再至平稳的规律,并且在3周龄的时候达到表达量的最高峰,出现拐点后表达量缓慢降低;这与罗斯308肉鸡的生长曲线规律相吻合,也说明miR-133a-3p是维持肉鸡肌肉生长发育的重要因子。贾富民等研究发现,gga-miR-133a-5p虽然也在骨骼肌中高表达,但在其他非肌肉组织中也检测到表达,并没有表现出和gga-miR-133a-3p一致的肌肉特异性;说明miR-133a-3p、miR-133a-5p虽然由同一个前体mir-133a加工生成,但其结构差异也导致功能上的差异[17]。鸡的胸肌主要由快肌纤维构成,心肌主要由慢肌纤维构成,腿肌由快肌纤维、慢肌纤维嵌合构成[18]。gga-miR-133a-3p在胸肌中表达水平显著高于心肌、腿肌,这表现出明显的快肌纤维偏向性,推测其与快肌纤维的转化密切相关。
miRNA的序列和结构决定其分子功能。通过对15个物种的miR-133a-3p序列进行比对,发现各物种的miR-133a-3p成熟体序列几乎相同,没有发现碱基突变,仅在第1、23位碱基处存在个别缺失,且种子区序列(UGGUCCC)完全相同。这说明miR-133a-3p在各物种中高度保守,并且具有相同的靶基因,在各物种中功能类似;这与刘芳君等的研究结论“miRNA 在不同物种中相对保守,具有相似的功能和调控机制” [19]相吻合。通过构建进化树,我们发现鸡与同为鸟类的原鸽聚为一支,符合物种进化规律。
识别筛选出 gga-miR-133a-3p 的靶基因是探索其功能及机制的关键。本研究利用miRDB、TargetScan 这2个在线平台预测其靶基因,通过取其交集得到145个靶基因。通过GO分析,富集到肌球蛋白结合这一显著条目;在KEGG分析中,得到肌动蛋白细胞骨架、FoxO、mTOR、p53等与肌肉相关的信号通路;这符合miR-133a-3p在肌肉组织中特异性表达的结果以及参与肌肉生长发育调控的预期。肌动蛋白细胞骨架调控信号通路影响细胞的信号转导、细胞骨架的组装与调节、肌肉生长与发育调控等多个方面,通路的异常与失活可能导致肌肉发育受到阻碍[20]。p53信号通路主要通过其肿瘤抑制、调控细胞周期,影响肌肉细胞的生长、发育和适应性变化[21];同时p53信号通路参与调节肌肉细胞的能量代谢和氧化应激反应,保持细胞的稳态,进一步促进和保持肌肉的健康和功能[22]。mTOR信号通路通过促进蛋白质合成、维持健康的代谢状态、参与细胞增殖和分化、响应营养和激素刺激等方式,来促进肌肉的生长和发育[23]。FoxO信号通路在骨骼肌生长发育中发挥着多方面的作用,包括调控细胞增殖与分化、纤维类型转换、蛋白质合成与降解、代谢适应以及衰老与再生等过程,这些作用共同影响着骨骼肌的结构、功能和适应性反应[24-25]。综上,这些通路很可能是miR-133a-3p在肌肉生长发育中发挥功能的桥梁。
研究发现,PIK3CB、NRAS、EGFR、PRKAA1、IGF1R在肌动蛋白细胞骨架调控、mTOR、FoxO、p53等肌肉发育相关信号通路中显著富集,推测它们可能是miR-133a-3p发挥肌肉生长发育相关调控作用的重要靶基因。结合相关文献,PIK3CB编码磷酸肌醇3激酶(PI3K)催化亚单位β亚型的一个亚型,属于PI3K信号通路中一员,在肌肉损伤时表达显著上调,并已证实通过IGF-I/PI3K通路促进小鼠损伤骨骼肌的修复和再生[26]。N-Ras蛋白是NRAS基因编码的产物,属于RAS/MAPK信号通路的一部分,在肌肉细胞增殖和分化中起间接作用[27]。EGFR编码一种跨膜蛋白,即表皮生长因子受体(EGFR),属于受体酪氨酸激酶(RTKs)家族,通过PI3K-AKT-mTOR途径调控基因转录、细胞周期、蛋白质合成、细胞存活等过程,从而促进肌肉细胞的增殖和分化[28]。PRKAA1基因作为AMPK的α1催化亚基,通过调节AMPK的活性,影响肌肉细胞的能量代谢、蛋白质合成和肌肉再生过程,从而间接影响肌肉的生长和发育[29]。大量研究已证实,IGF1R是协调肌肉生长、增强肌肉修复、增加肌肉质量和力量的关键因素之一;miR-322通过靶向IGF1R加重地塞米松诱导小鼠肌肉萎缩[30-31]。CircRILPL1通过结合miR-145激活IGF1R/PI3K/AKT通路促进牛肌肉增殖和分化[32]。以上研究表明,PIK3CB、NRAS、EGFR、PRKAA1、IGF1R这5个基因在肌肉生长发育中发挥着重要作用。本研究对这5个靶基因在不同生长周龄罗斯308肉鸡的胸肌组织中的表达量进行检测,发现IGF1R的mRNA表达趋势与gga-miR-133a-3p呈负相关,说明它很可能是miR-133a-3p发挥肌肉生长发育相关调控作用的重要靶基因,但其具体的分子调控机制还需通过靶标试验及分子功能机制试验作进一步的验证。
4 结论
miR-133a-3p序列在各物种间较为保守,符合进化规律;靶基因富集分析结果表明,PIK3CB、NRAS、EGFR、PRKAA1、IGF1R在肌动蛋白细胞骨架调控、mTOR、FoxO、p53等肌肉发育相关信号通路中显著富集;鸡miR-133a-3p仅在心脏、胸肌、腿肌中有表达,在胸肌中表达量显著高于心脏、腿肌,是肌肉组织特异性表达miRNA,随着周龄的增长,miR-133a-3p在胸肌中的表达量呈先升后降再至平稳的规律,且在3周龄达到表达量峰值;IGF1R在胸肌中的mRNA表达量随着周龄(W0~W6)的增长呈先降再升的规律,与miR-133a-3p表达量的变化规律相反,说明它很可能是miR-133a-3p发挥肌肉生长发育相关调控作用的重要靶基因。
参考文献:
[1]Fu J J,Liu J,Zou X,et al. Transcriptome analysis of mRNA and miRNA in the development of LeiZhou goat muscles[J]. Scientific Reports,2024,14:9858.
[2]Oikawa S,Akimoto T. Functional analysis of microRNAs in skeletal muscle[J]. Methods in Molecular Biology,2023,2640:339-349.
[3]Horak M,Novak J,Bienertova-Vasku J. Muscle-specific microRNAs in skeletal muscle development[J]. Developmental Biology,2016,410(1):1-13.
[4]Chen J F,Mandel E M,Thomson J M,et al. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J]. Nature Genetics,2006,38:228-233.
[5]Shintani-Ishida K,Tsurumi R,Ikegaya H. Decrease in the expression of muscle-specific miRNAs,miR-133a and miR-1,in myoblasts with replicative senescence[J]. PLoS One,2023,18(1):e0280527.
[6]Schanda J E,Heher P,Weigl M,et al. Muscle-specific micro-ribonucleic acids miR-1-3p,miR-133a-3p,and miR-133b reflect muscle regeneration after single-dose zoledronic acid following rotator cuff repair in a rodent chronic defect model[J]. The American Journal of Sports Medicine,2022,50(12):3355-3367.
[7]Wang Y J,Ma J D,Qiu W L,et al. Guanidinoacetic acid regulates myogenic differentiation and muscle growth through miR-133a-3p and miR-1a-3p co-mediated akt/mTOR/S6K signaling pathway[J]. International Journal of Molecular Sciences,2018,19(9):2837.
[8]Zhan S Y,Zhang Y,Yang C T,et al. LncR-133a suppresses myoblast differentiation by sponging miR-133a-3p to activate the FGFR1/ERK1/2 signaling pathway in goats[J]. Genes,2022,13(5):818.
[9]李 燕. miR-133a互作LncRNA调控牛骨骼肌卫星细胞增殖分化的机制研究[D]. 天津:天津农学院,2019.
[10]Telles G D,Libardi C A,Conceio M S,et al. Time course of skeletal muscle miRNA expression after resistance,high-intensity interval,and concurrent exercise[J]. Medicine and Science in Sports and Exercise,2021,53(8):1708-1718.
[11]Duran B O D S,Dal-Pai-Silva M,Garcia de la Serrana D. Rainbow trout slow myoblast cell culture as a model to study slow skeletal muscle,and the characterization of mir-133 and mir-499 families as a case study[J]. The Journal of Experimental Biology,2020,223(Pt 2):jeb216390.
[12]Li J,Chen C W,Zhao R P,et al. Transcriptome analysis of mRNAs,lncRNAs,and miRNAs in the skeletal muscle of Tibetan chickens at different developmental stages[J]. Frontiers in Physiology,2023,14:1225349.
[13]陈 敏. gga-miRNA-454和gga-miRNA-301b对鸡成肌细胞增殖与分化的作用研究[D]. 雅安:四川农业大学,2019.
[14]Jebessa E,Ouyang H J,Abdalla B A,et al. Characterization of miRNA and their target gene during chicken embryo skeletal muscle development[J]. Oncotarget,2017,9(25):17309-17324.
[15]Long K R,Feng S Y,Ma J D,et al. Small non-coding RNA transcriptome of four high-altitude vertebrates and their low-altitude relatives[J]. Scientific Data,2019,6:192.
[16]Wu P F,He M L,Zhang X C,et al. miRNA-seq analysis in skeletal muscle of chicken and function exploration of miR-24-3p[J]. Poultry Science,2022,101(11):102120.
[17]贾富民,贾羽晴,夏晶晶,等. 鸡肌肉发育相关miR-133a-5p分析和关键靶基因筛选[J]. 中国农业大学学报,2023,28(8):172-182.
[18]Huo W R,Weng K Q,Li Y,et al. Comparison of muscle fiber characteristics and glycolytic potential between slow-and fast-growing broilers[J]. Poultry Science,2022,101(3):101649.
[19]刘芳君,蓝吴涛,马悦悦,等. miRNA-148a-3p 的生物信息学分析及其在小鼠不同组织中的表达水平检测[J].畜牧兽医学报,2022,53(2):414-422.
[20]Blaine J,Dylewski J. Regulation of the actin cytoskeleton in podocytes[J]. Cells,2020,9(7):1700.
[21]Park J W,Lee J H,Han J S,et al. Muscle differentiation induced by p53 signaling pathway-related genes in myostatin-knockout quail myoblasts[J]. Molecular Biology Reports,2020,47(12):9531-9540.
[22]Xia S. Application of P53 mRNA in signal transduction mechanisms of skeletal muscle cells[J]. Pakistan Journal of Pharmaceutical Sciences,2021,34(Special 1):447-455.
[23]Tinline-Goodfellow C T,Lees M J,Hodson N. The skeletal muscle fiber periphery:a nexus of mTOR-related anabolism[J]. Sports Medicine and Health Science,2022,5(1):10-19.
[24]郑莉芳,陈佩杰,肖卫华. 骨骼肌质量控制信号通路[J]. 生理学报,2019,71(4):671-679.
[25]Chen K,Gao P,Li Z C,et al. Forkhead box O signaling pathway in skeletal muscle atrophy[J]. The American Journal of Pathology,2022,192(12):1648-1657.
[26]Matheny R W Jr,Carrigan C T,Abdalla M N,et al. RNA transcript expression of IGF-I/PI3K pathway components in regenerating skeletal muscle is sensitive to initial injury intensity[J]. Growth Hormone amp; IGF Research,2017,32:14-21.
[27]Lee J S,Choi K J,Lim M J,et al. Proto-oncogenic H-Ras,K-Ras,and N-Ras are involved in muscle differentiation via phosphatidylinositol 3-kinase[J]. Cell Research,2010,20(8):919-934.
[28]Zhou H L,Lin S,Hu Y D,et al. miR-125a-5p and miR-7 inhibits the proliferation,migration and invasion of vascular smooth muscle cell by targeting EGFR[J]. Molecular Medicine Reports,2021,24(4):708.
[29]Wu W C,Xu Z Y,Zhang L,et al. Muscle-specific deletion of Prkaa1 enhances skeletal muscle lipid accumulation in mice fed a high-fat diet[J]. Journal of Physiology and Biochemistry,2018,74(2):195-205.
[30]Philippou A,Barton E R. Optimizing IGF-I for skeletal muscle therapeutics[J]. Growth Hormone amp; IGF Research,2014,24(5):157-163.
[31]Geng H W,Song Q L,Cheng Y Y,et al. MicroRNA 322 aggravates dexamethasone-induced muscle atrophy by targeting IGF1R and INSR[J]. International Journal of Molecular Sciences,2020,21(3):1111.
[32]Shen X M,Tang J,Jiang R,et al. CircRILPL1 promotes muscle proliferation and differentiation via binding miR-145 to activate IGF1R/PI3K/AKT pathway[J]. Cell Death amp; Disease,2021,12:142.

