新生儿Netherton综合征1例
朱燕 蒋思远 张蓉 曹云 张淑莲
(国家儿童医学中心/复旦大学附属儿科医院新生儿科,上海 201102)
1 前言
Netherton 综合征(Netherton syndrome,NS),又称迂回线状鱼鳞病,是一种罕见的常染色体隐性遗传病,SPINK5基因是其致病基因[1]。SPINK5基因变异导致表皮角质包膜终末分化异常及脂质代谢异常,研究报道的144个患病家族中,约有80种突变类型[2]。NS在1958年由Netherton[3]首次报道,在活产新生儿中的发病率约为1/200 000,病变主要累及皮肤、毛发和免疫系统,具有三大临床特征:先天鱼鳞病样红皮病、竹节样毛发、特应性体质。重症感染和高渗性失水是患儿死亡的主要原因。
2 病例介绍
现病史:患儿,男,生后6 d,因生后呼吸困难伴全身脱屑样皮疹6 d 转入我院。患儿系第2 胎第1产,胎龄37+1周,出生体重2 830 g,因“胎膜早破11 h”剖宫产娩出,羊水、脐带、胎盘未见异常。生后1 min 及5 min Apgar 评分均9 分,体格检查见全身散在红色皮疹伴脱屑。生后数分钟出现气促、呻吟、吸气三凹征阳性,立即予气管插管、有创机械通气、抗感染等治疗。患儿皮肤相继出现红斑、融合成片,伴有明显渗出和结痂,予硝酸咪康唑乳膏、金霉素眼膏、皮肤屏障保护剂等护理皮肤。生后6 d,因无法撤离有创机械通气、皮肤状态无好转,转入我科。患儿父母非近亲结婚,父亲身体健康,母亲有妊娠糖尿病,饮食控制血糖正常;否认家族遗传性疾病或相关皮肤疾病史。既往第1胎系意外怀孕人工流产。
入院体格检查:患儿机械通气下,体温36.6℃,心率110 次/min,呼吸75 次/min,血压76/52 mmHg,体重2 690 g。全身皮肤轻度黄染,散在红斑伴脱屑,见图1。双肺送气音对称,可闻及痰鸣音。心律齐,心音有力,可闻及Ⅱ级收缩期杂音。腹软,肝脾肋下未扪及,肠鸣音正常,四肢肌力、肌张力正常。
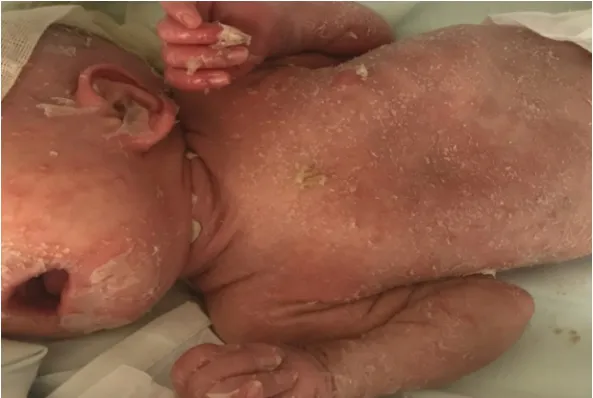
图1 患儿入院时皮疹形态 全身散在红斑伴脱屑,手部可见手套样表皮剥脱。
辅助检查:C 反应蛋白48 mg/L(参考值:<8 mg/L),血红蛋白97 g/L(参考值:99~196 g/L),嗜酸性粒细胞百分比25%(参考值:0.8%~11%),血清钠167 mmol/L(参考值:135~150 mmol/L),IgE 83 KU/L(参考值:<100 KU/L)。胸部X线片提示肺炎、局部实变。痰培养检出肺炎克雷伯菌。纤维支气管镜检查示支气管黏膜炎性改变,右下肺叶基底节段气管中度软化。血培养、尿培养、宫内感染、免疫功能、血和尿串联质谱、心脏超声、头颅磁共振成像检查等均未见异常。二代测序检测出SPINK5基因存在纯合突变c.2260A>T(p.Lys754X)(NM_006846)。该突变导致其编码的上皮鳞状表型相关抑制子(lympho-epithelial kazal-typerelated inhibitor,LEKTI)结构发生改变(图2)。
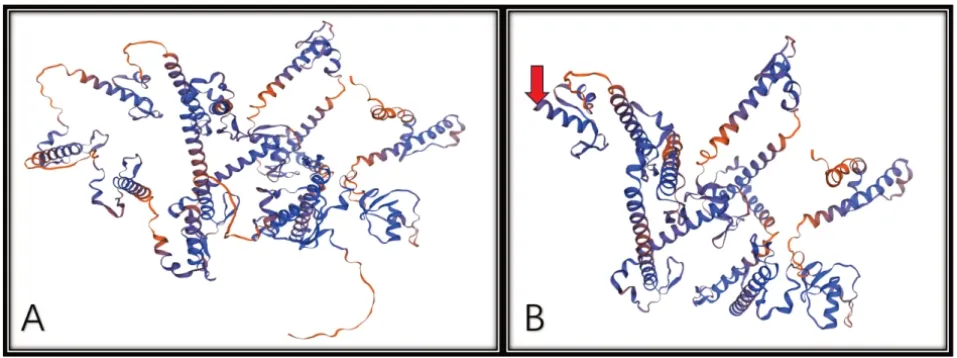
图2 患儿基因变异后的蛋白结构预测 A:正常LEKTI 蛋白结构;B:瑞士模型(swissmodel.expasy.org)预测本例患儿基因变异后蛋白结构,红色箭头为肽链提前终止端。
3 多学科诊疗
3.1 新生儿重症监护病房初诊
该患儿以呼吸困难、全身脱屑样皮疹为主要表现入院。呼吸衰竭及皮肤病变是否能用“一元论”来解释,还是两个独立的疾病表现?全身重症感染、免疫缺陷类疾病、代谢性疾病等都可能导致患儿出现多脏器功能受损。结合患儿发病时间早、病情重、多脏器受累、炎症指标高等,考虑新生儿重症感染、新生儿葡萄球菌烫伤样综合征(staphylococcal scalded skin syndrome,SSSS)可能性大。治疗上在抗感染、呼吸支持的同时积极寻找相关病原学及潜在病因。
3.2 呼吸科会诊
患儿生后呼吸困难,入院胸部X线片提示肺炎伴右肺不张,痰培养检出肺炎克雷伯菌,考虑肺部严重感染引起呼吸衰竭,根据药敏试验结果抗感染治疗。然而抗感染治疗效果欠佳,右肺仍有局灶实变不张,行支气管镜检查及肺泡灌洗术,术中发现右下叶基底段气管软化、右下叶基底段开口处黏膜溃疡。肺泡灌洗后继续抗感染治疗,胸部X线片好转,肺实变不张消失,呼吸好转,逐步撤离呼吸机并停氧。
3.3 皮肤科会诊
患儿疾病早期炎症指标升高、皮肤红斑伴脱屑,考虑新生儿SSSS,需抗感染的同时予以皮肤护理。患儿表现为周期性脱皮、躯干离心性脱皮、手足呈典型手套袜套样表皮剥脱,伴头皮脂溢性皮炎,给予乳膏基质(脱屑处)、尿素护肤,调整环境温度、湿度,植物油溶解脂溢斑块及黄色结痂,治疗后皮肤状态曾有短暂改善,但皮疹、脱屑仍有反复,且未出现过水疱和大疱性皮损。皮疹与血象中炎症指标相关,皮疹越严重,C反应蛋白及嗜酸性粒细胞越高。再次评估后考虑患儿为先天性鱼鳞病伴有婴儿湿疹,建议完善皮肤病相关基因检测,最终二代测序检出SPINK5基因存在纯合突变,明确诊断为新生儿NS。该病为常染色体隐性遗传鱼鳞病,临床有三大特征:先天性鱼鳞病样红皮病、竹节样毛发(通常发生在1 岁后,光镜下明确)、特应性体质(荨麻疹、哮喘、血管性水肿、特应性皮炎、花粉症、嗜酸性粒细胞增多症、高血IgE 水平等)。这三项体征临床上一般不同时出现,其中最具特征的是迂回线状皮损,与该患儿临床高度符合。新生儿NS 并无特效治疗手段,对症支持治疗为主[4]。局部皮肤护理是该类疾病的一线治疗,包括润滑、减轻角化过度、抗炎和抗增殖,降低感染风险[5]。全身性治疗包括维持水电解质平衡、补充营养物质、抗感染、免疫支持、免疫调节类药物的使用(生物制剂抗白细胞介素-17、抗IgE、抗肿瘤坏死因子、抗白细胞介素-4)、噬菌体疗法、基因治疗等。静脉注射免疫球蛋白的定期使用,能改善免疫降低感染风险[6]。另外对于大月龄患儿,单抗类药物的使用能降低皮肤中胸腺基质淋巴细胞生成素、白细胞介素-6和白细胞介素-8的表达,并能显著延长皮肤病变的改善时间,但其安全及有效性有待进一步研究[7]。
3.4 营养科会诊
患儿入院后普通配方奶足量喂养下体重下降,并出现慢性腹泻、嗜酸性粒细胞升高,考虑存在因过敏导致的营养吸收障碍,故调整为深度水解蛋白配方奶喂养。同时患儿存在因皮损而导致的脱水、电解质紊乱、蛋白丢失过多等,调整总液量至每天165 mL/kg、热卡110 kcal/kg(按出生体重计算)及增加蛋白补充,补充锌及维生素B。保证患儿基础代谢、体格增长的同时,促进患儿皮肤生长及修复。每日监测体重,记录尿量、排便等情况,及时调整液体、电解质、热卡的摄入。
3.5 分子诊断中心会诊
新生儿疑难危重症中基因遗传病占比不可忽视。我院二代测序包含最常见的数千种新生儿基因遗传疾病,可帮助临床快速诊断、精准治疗、评估预后。新生儿特应性皮炎若出现以下特点时,需尽早完善基因相关皮肤病的检测:(1)全身广泛及早发的皮疹;(2)反复难治性感染(真菌、疱疹病毒等);(3)骨骼、结缔组织、面部、毛发异常;(4)慢性反复腹泻、内分泌疾病等[8]。本例患儿起病早,全身广泛皮疹,伴有难以控制的肺部、皮肤感染、慢性腹泻等情况,符合基因相关皮肤病的预测。相比新生儿皮肤活检,基因检测创伤性小,亦能发现疾病遗传模式。本例患儿通过二代测序检测出SPINK5基因纯合突变:c.2260A>T(p.Lys754X)。该位点在人类基因突变数据库中报道6篇,为明确的致病变异位点,赖氨酸突变为终止密码子,导致SPINK5基因编码的LEKTI 蛋白截断性表达,表型为NS。LEKTI 缺乏导致表皮角质包膜终末分化异常及脂质代谢异常,角质层屏障形成障碍,临床表现为鳞屑、表皮剥脱,屏障的损伤又引起过敏原和微生物的渗透。SPINK5基因共有33个外显子,突变发生位置越靠近上游,LEKTI蛋白表达越少,表型越重[2]。本例患儿基因突变在第24 外显子,建议父母完成基因验证,如致病变异来自父母,再次怀孕时运用辅助生殖技术,胚胎植入前进行基因检测,有效避免患病新生儿的出生[9]。
3.6 新生儿重症监护病房诊疗总结
患儿以呼吸困难、脱屑样皮疹入院,体格检查示全身红斑伴脱屑,血炎症指标高,胸部X线片提示肺炎伴肺不张,首先考虑重症感染、新生儿SSSS可能。皮肤护理同时予以抗感染、肺泡灌洗、静脉注射免疫球蛋白,呼吸困难改善后停止呼吸支持,但皮疹无明显好转。结合患儿治疗过程中鱼鳞病样皮疹,反复炎症指标、嗜酸性粒细胞高,高渗性脱水,慢性腹泻,体重下降等表型,符合基因相关皮肤病预测,最终二代测序确诊患儿为NS。新生儿期起病的皮疹鉴别诊断思路见图3。

图3 新生儿皮疹的诊断步骤
4 治疗经过及转归
患儿入院时考虑重症感染、新生儿SSSS,予抗感染、静脉注射免疫球蛋白、皮肤护理及对症支持等综合治疗;治疗过程中患儿出现体重下降、慢性腹泻、高渗性脱水,调整为深度水解蛋白配方奶喂养,增加能量、蛋白及液体摄入,补充微量元素及维生素,保证基础代谢、体格增长,同时促进患儿皮肤生长及修复。二代测序检测明确诊断患儿为NS。患儿生后2个月因家长个人意愿,自动出院且拒绝进一步皮肤组织活检及遗传咨询,父母的基因验证未能完成。患儿出院体重2.32 kg,未吸氧,呼吸平稳,全身皮肤仍有红疹脱屑。后续联系家属,告知出院后短期内患儿死亡。
5 小结
SPINK5基因纯合突变所致的新生儿NS在新生儿的高危问题主要有:皮肤损害引起的低体温、不显性失水、高渗性脱水、严重感染、生长发育迟缓,其中严重感染和高渗性脱水是患儿死亡的主要原因。NS 的治疗以对症为主,局部皮肤护理为一线,全身治疗为辅。传统治疗对本例患儿效果不佳。
作者贡献声明:朱燕负责撰写文章、病例采集与分析;蒋思远、张蓉、曹云负责病例分析指导;张淑莲负责文章指导与修改。
志谢:感谢复旦大学附属儿科医院皮肤科、遗传分子诊断中心、呼吸科、营养科的同事们。
利益冲突声明:所有作者声明无利益冲突。

