超声造影预测局部晚期宫颈癌同步放化疗早期疗效的临床价值
郭 磊 周洪珍 刘德梅 张 涛 李秀敏 王金霞 杨宗利
宫颈癌是常见的妇科恶性肿瘤,其发病率及死亡率均位居全球女性恶性肿瘤第4 位[1]。本病早期多无明显临床表现,多数患者确诊后已属于局部晚期宫颈癌(locally advanced cervical cancer,LACC)。国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准[2]广义上定义LACC 为处于ⅠB3~ⅣA 期的宫颈癌[3-4]。同步放化疗(concurrent chemoradiotherapy,CCRT)是一种治疗LACC 的有效方法,但并发症发生率较高,且其疗效与患者长期生存率密切相关,因此准确预测其疗效对临床调整后续治疗方案至关重要[5]。超声造影(contrast-enhanced ultrasound,CEUS)是一种安全、实时、高效的影像学检查手段,目前已有应用于宫颈癌化疗疗效评价方面的相关报道[6-7],但应用CEUS预测LACC患者CCRT早期疗效的研究较少见。基于此,本研究探讨了CEUS 在预测LACC 患者CCRT 早期疗效中的临床价值,报道如下。
资料与方法
一、研究对象
选取2021 年1 月至2022 年12 月于临沂市肿瘤医院收治的LACC 患者65 例,年龄34~75 岁,平均(56.68±10.02)岁。其中鳞癌60 例,腺癌5 例;2018 FIGO分期[3]ⅡB期10例,ⅢA期2例,ⅢB期34例,ⅢC期1 例,ⅢC1 期10 例,ⅢC2 期5 例,ⅣA 期3 例。纳入标准:①均经病理学检查确诊,FIGO分期为ⅡB~ⅣA期;②均接受化疗联合放疗(体外调强放疗+后装治疗)治疗;③患者心智健康,无沟通和交流障碍。排除标准:①FIGO 分期<ⅡB 期,可进行手术治疗;②对超声造影剂过敏;③合并右向左分流的心脏疾病、重度肺动脉高压(肺动脉压>90 mmHg,1 mmHg=0.133 kPa)及其他严重心脑血管疾病、未得到有效控制的高血压、成人呼吸窘迫综合征;④合并肝肾功能障碍或神经系统疾病;⑤处于妊娠期或哺乳期。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.CEUS 检查:所有患者均于治疗前1 周内及体外放疗结束后分别进行CEUS检查。使用GE Logiq E8彩色多普勒超声诊断仪,C1-6凸阵探头,频率1.0~6.0 MHz;造影剂使用SonoVue(意大利Bracco 公司),按照说明书配置使用。嘱患者适度充盈膀胱,取仰卧位,首先行常规超声检查,记录病灶的基本特征,包括瘤体大小、形态、内部回声及血流分布等,测量瘤体最大径,计算肿瘤消退率,公式为:肿瘤消退率=(治疗前瘤体最大径-体外放疗结束后瘤体最大径)/治疗前瘤体最大径×100%。然后切换至CEUS 模式,经上臂肘静脉快速团注2.4 ml 造影剂混悬液,随后推注5.0 ml 生理盐水快速冲管,同时开启计时器,实时观察病灶内造影剂灌注情况,并持续储存至少3 min 动态图像。选取病灶感兴趣区,绘制时间-强度曲线(TIC),获得达峰时间(TP)、梯度(Grad)、曲线下面积(Area)及峰值强度(PI)。本研究由两名具有10 年以上工作经验的超声医师独立分析TIC 获得定量参数,取两名医师测量值的平均值进行后续分析。
2.CCRT 方法:①放疗使用美国Varian Clinac iX直线加速器及相应配套系统6MV-X 线,体外放射总剂量约45.0~50.4 Gy(25~28 次),体外放疗剂量约32.0 Gy(18 次),增加后装放疗,每周1 次,总剂量35.0 Gy(7 次);②化疗采用静脉滴注顺铂(山东凤凰制药股份有限公司,国药准字:H20056422),剂量30 mg/m2,每周1 次,连续治疗4~6周。
3.疗效评估及分组:体外放疗结束后,依据实体瘤疗效评价标准[8],结合妇科检查、CEUS 及MRI 检查结果综合评估CCRT 早期疗效并进行分组:瘤体完全消失及瘤体最大径缩小≥30%的患者归为敏感组(53 例);瘤体最大径缩小<30%及瘤体最大径增大的患者归为不敏感组(12例)。
三、统计学处理
应用SPSS 25.0 统计软件,采用Shapiro-Wilk 检验分析计量资料的正态性,符合正态分布者以表示,采用t检验;不符合正态分布者以M(Q1,Q3)表示,采用Mann-WhitneyU检验。采用Spearman 相关分析法分析CEUS参数与肿瘤消退率的相关性。二元Logistic回归分析筛选预测LACC 患者CCRT 早期疗效的影响因素。绘制受试者工作特征(ROC)曲线分析其预测效能。采用组内相关系数(ICC)评价两名超声医师测值的一致性,ICC<0.40 为一致性差,0.40~0.75 为一致性良好,>0.75 为一致性非常好。P<0.05 为差异有统计学意义。
结 果
本研究65例LACC患者治疗前和体外放疗结束后瘤体最大径分别为(60.7±14.6)mm、(31.2±16.9)mm,肿瘤消退率为(49.2±23.2)%。
一、两组治疗前及体外放疗结束后CEUS 参数比较
1.组间比较:敏感组治疗前Grad、PI 均低于不敏感组,差异均有统计学意义(均P<0.05);敏感组体外放疗结束后Grad、Area 及PI 均低于不敏感组,TP 高于不敏感组,差异均有统计学意义(均P<0.001)。见表1和图1,2。
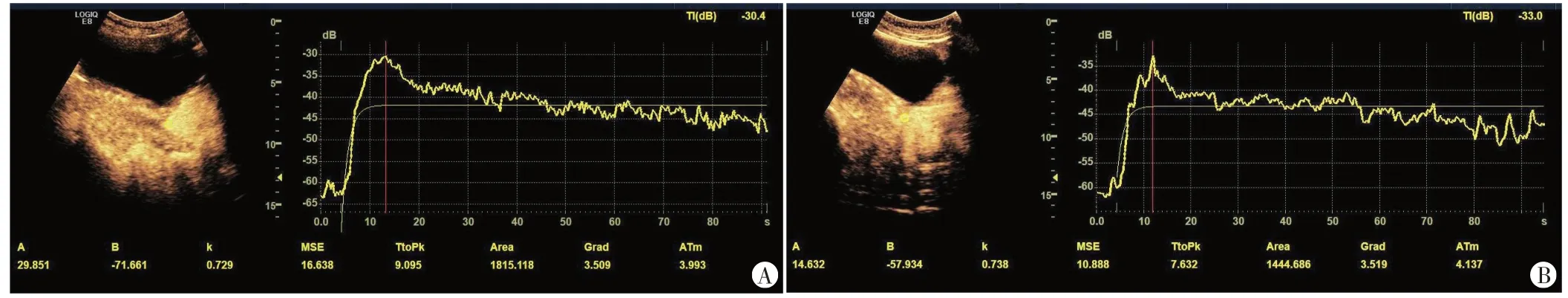
图2 不敏感组一患者(48岁)治疗前及体外放疗结束后CEUS图及TIC图
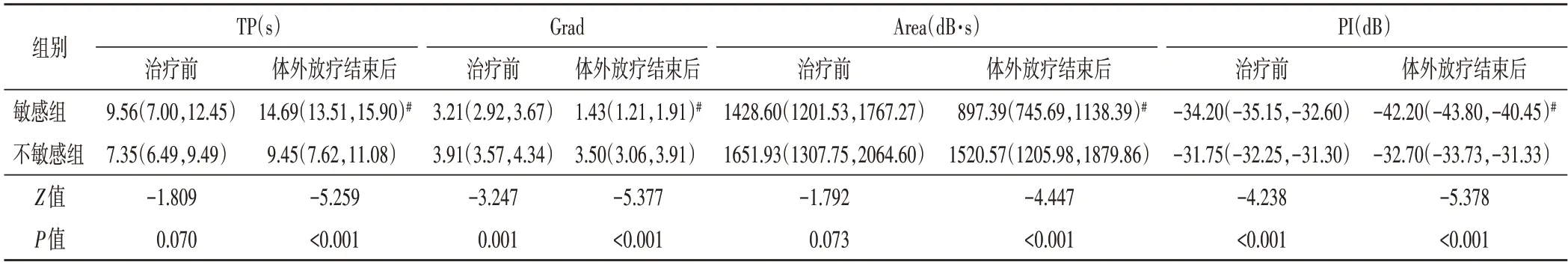
表1 两组治疗前及体外放疗结束后CEUS参数比较[M(Q1,Q3)]
2.组内比较:敏感组体外放疗结束后Grad、Area及PI 均较治疗前降低,TP 较治疗前升高,差异均有统计学意义(均P<0.05);不敏感组治疗前与体外放疗结束TP、Grad、Area 及PI 比较差异均无统计学意义。见表1和图1,2。
二、CEUS参数与肿瘤消退率的相关性分析
治疗前Grad、PI 均与肿瘤消退率呈负相关(r=-0.602、-0.499,均P<0.05);体外放疗结束后Grad、PI均与肿瘤消退率呈负相关(r=-0.859、-0.913,均P<0.05)。
三、二元Logistic回归分析
以治疗前Grad 及PI 为自变量,体外放疗结束后CCRT 早期疗效为因变量(敏感=1,不敏感=0),纳入二元Logistic 回归分析,结果显示治疗前Grad 及PI 均为预测LACC 患者CCRT 早期疗效的独立影响因素(均P<0.05)。见表2。
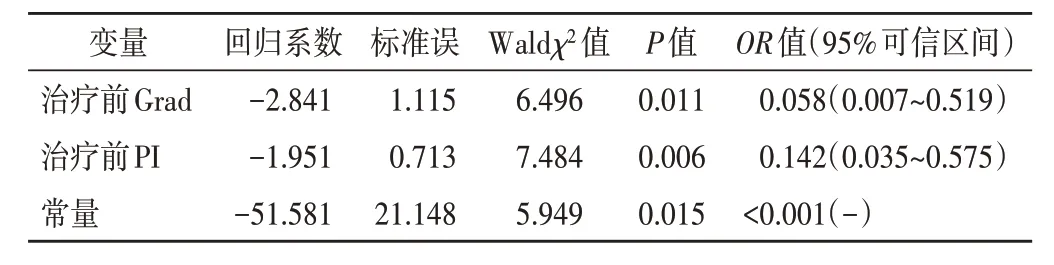
表2 二元Logistic回归分析
四、ROC曲线分析
ROC 曲线分析显示,治疗前Grad 及PI 分别以3.44、-32.55 dB 为截断值,其预测LACC 患者CCRT 早期疗效的曲线下面积分别为0.802、0.894,诊断灵敏度分别为67.9%、77.4%,特异度分别为91.7%、100%。见图3。
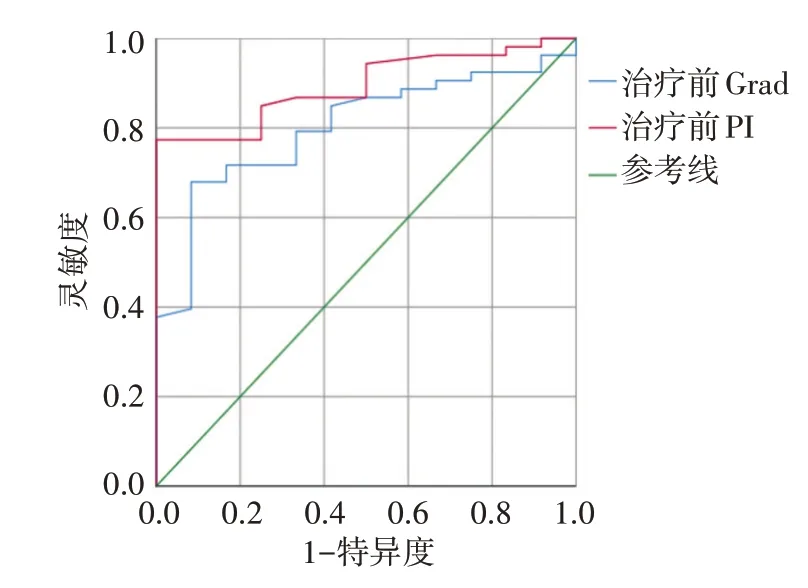
图3 治疗前Grad及PI预测LACC患者CCRT早期疗效的ROC曲线图
五、一致性分析
两名超声医师间治疗前及体外放疗结束后各CEUS参数的一致性均非常好(均ICC>0.75)。见表3。

表3 两名超声医师间治疗前及体外放疗结束后各CEUS参数的ICC及其95%可信区间结果
讨 论
LACC 定义为局限于子宫颈或仅累及盆腔局部、最大径>4 cm 的宫颈癌,具有体积大、局部控制困难、手术难度较大、术后易复发或转移等特点,这是一个里程碑式的功能性定义,对确定治疗方案具有重要的意义[3-4]。目前临床LACC 患者的常规治疗方案为CCRT,然而仍有部分患者的治疗效果欠佳[9]。宫颈癌的预后因素包括瘤体大小、组织学分型、病理分级、FIGO 分期、淋巴结转移状态等,但这些指标并不足以准确预测治疗反应或预后,临床需无创生物标志物在治疗早期提供更详细的肿瘤特征,从而更准确地预测疗效[10]。MRI 已被广泛应用于预测宫颈癌治疗疗效[11-12],但其检查时间长、价高、有禁忌症及造影剂过敏发生率较高,而CEUS 相对操作简便,具有价廉、禁忌症较少、造影剂不良反应发生率低等优势,目前已应用于宫颈癌化疗的疗效评价[6-7]。本研究旨在探讨CEUS 在预测LACC 患者CCRT 早期疗效中的临床价值。
本研究结果显示,敏感组治疗前Grad、PI 均低于不敏感组,差异均有统计学意义(均P<0.05),且二者与肿瘤消退率均呈负相关(r=-0.602、-0.499,均P<0.05),表明治疗前Grad 及PI 较低的LACC 患者对治疗的敏感度更高,肿瘤消退率也越高。Grad 为造影剂从进入至达到峰值强度的梯度,其值越高提示造影剂进入病灶的平均灌注速度越快[13];PI 在一定程度上反映了肿瘤生物学活性,代表了肿瘤组织内新生血管的数量[14],其值越大提示肿瘤生物学活性越高,新生血管数量越多。当Grad 及PI 较低时,肿瘤灌注速度低、血管含量低,对治疗反应更敏感。Wiggins等[15]研究结果显示高血管化宫颈肿瘤的预后较差,表明血管化程度高的肿瘤较血管化程度低的肿瘤更具侵袭性,对治疗反应更差;Ueda等[16]研究发现宫颈癌患者对新辅助化疗的治疗反应与瘤内微血管密度呈负相关(r=-0.724,P<0.01),本研究结果与其基本一致。此外,本研究敏感组体外放疗结束后Grad、Area 及PI 均较治疗前降低,TP 较治疗前升高(均P<0.05),且上述参数与不敏感组体外放疗结束后比较差异均有统计学意义(均P<0.05),提示对治疗越敏感的患者其CEUS 参数变化越明显。研究[7,17]认为Area及PI降低提示肿瘤内血管数量减少,其值降低越明显则提示肿瘤抑制效果越好,本研究结论与其一致。CEUS 可从形态学及功能学分别反映病灶情况,可实时、连续观察病灶组织血流灌注,结合TIC 进行定性及定量分析,评估病灶组织微循环和微血管情况,为临床提供丰富的诊断信息[18],也为CEUS 预测LACC 患者CCRT 早期疗效提供了可靠依据。此外,还为有MRI 检查禁忌症或对MRI造影剂过敏的LACC 患者提供一种新的评估手段,丰富了临床医师评估方法的选择。
本研究二元Logistic 回归分析显示,治疗前Grad及PI 均为预测LACC 患者CCRT 早期疗效的独立影响因素(均P<0.05),即治疗前Grad 及PI 越低,则LACC患者CCRT 早期疗效越好,提示临床上可以依据治疗前Grad及PI为不同患者制定个性化治疗方案,如对治疗前Grad 及PI 较高的患者加强治疗,对治疗前Grad及PI较低的患者减少不必要的治疗,这为最终改善治疗结果提供了可能。本研究ROC 曲线分析显示,治疗前Grad、PI 预测LACC 患者CCRT 早期疗效的曲线下面积分别为0.802、0.894,且一致性分析显示各CEUS定量参数在观察者间的一致性均非常好(均ICC>0.75),表明CEUS参数可重复性高,在预测LACC患者CCRT早期疗效方面有较高的预测效能。
综上所述,应用CEUS 预测LACC 患者CCRT 早期疗效有一定的临床价值。但CEUS 依赖于血管成像,血管较少的肿瘤显像效果差,不能反映其微循环特征及真实情况,预测疗效时偏差较大,且本研究样本量较少,纳入的影响因素也较少,有待今后扩大样本量进行更深入的研究。

