脾脏联合胰尾切除在上皮性卵巢癌肿瘤细胞减灭术中的临床观察
刘艺璇 闫倩倩 陈雨莲 周 颖△ 江 榕△
(1复旦大学附属中山医院妇科肿瘤科 上海 200032; 2中国科学技术大学附属第一医院(安徽省立医院)妇产科/公共科研平台 合肥 230001)
卵巢癌居妇科恶性肿瘤死亡率首位,70%以上的卵巢癌患者确诊时已属晚期,即国际妇产科联盟(FIGO)分期ⅢC~Ⅳ期。卵巢癌肿瘤细胞减灭手术联合以铂为基础的化疗是卵巢癌的标准治疗方法,研究表明最大限度的减瘤手术可显著改善患者生存[1-2]。晚期卵巢癌常伴上腹部转移,上腹部手术已被广泛采用,因涉及上腹部多器官系统,手术技术及术后并发症的管理是卵巢癌减瘤手术的难点与挑战[3]。
脾脏位于腹腔左上限相对较低的位置,当患者处于仰卧位时,腹水中的卵巢癌细胞可能会植入该部位,出现脾门、脾包膜的种植转移,偶见胰尾处转移。脾门处的转移病灶有时难以与周围的脾脏和胰腺组织完全分离,为达到满意的肿瘤细胞减灭术效果,在初次或再次卵巢癌肿瘤细胞减灭术中需行脾脏切除,必要时需联合胰尾切除。然而,该类手术的研究病例数少,术后并发症及死亡率数据有限,需更多的临床数据来评估手术的获益和风险。本研究纳入国内两家医院脾脏联合胰尾切除的临床资料,探讨卵巢癌初次和再次肿瘤细胞减灭术中脾脏联合胰尾切除的安全性和疗效,以及术后胰瘘并发症的管理。
资 料 和 方 法
一般资料2017 年8 月至2022 年9 月于复旦大学附属中山医院接受了肿瘤细胞减灭术的ⅢC~Ⅳ期初治及复发的上皮性卵巢癌(epithelial ovarian cancer,EOC)患者,其中14 例患者接受了脾脏联合胰尾切除术;同期就诊于中国科学技术大学附属第一医院(安徽省立医院)妇产科的3 例EOC 患者在初治肿瘤细胞减灭术(cytoreductive surgery,CRS)中接受脾脏联合胰尾切除术。本研究获得复旦大学附属中山医院伦理委员会(批件号:B2020-248R)和中国科学技术大学附属第一医院(安徽省立医院)伦理委员会(批件号:2022-KY045)批准,因本研究为回顾性研究,知情同意书予以豁免。患者数据信息包括病情和治疗信息,由专人统一录入和整理,后续对患者进行生存随访。所有病理切片均经2 位病理医师分别复核,以确认卵巢癌是否侵犯胰腺及脾脏。
手术方式(1)切除大网膜:分离粘连于横结肠的大网膜,沿横结肠上方打开网膜囊,沿胃网膜血管弓下缘切除切除大网膜,显露脾脏;(2)游离脾脏:松解与脾脏相连的脾肾韧带、脾膈韧带、脾结肠韧带、脾胃韧带,结扎胃短血管,于胰腺后方分离脾血管并结扎;(3)切断胰尾组织,包埋缝合胰腺残端;(4)脾窝放置负压引流管1 根。
术后处理术后常规预防感染、抗凝治疗,必要时应用生长抑素,观察并记录患者有无腹痛、发热等症状,注意引流液颜色性状及引流量变化,监测血常规、炎症指标,隔天检测引流液淀粉酶等指标。怀疑有胰瘘的患者行上腹部超声或CT 检查,术后脾窝引流液减少且排除胰瘘后予以拔除引流管。
术后胰瘘的定义和分级术后胰瘘(postoperative pancreatic fistula,POPF)是胰腺手术最常见和最危险的并发症。根据2016 版国际胰瘘研究小组(International Study Group on Pancreatic Fistula,ISGPF)的诊断和分级标准[4],POPF 定义为:术后3 天以后,引流液淀粉酶含量大于血清淀粉酶正常值上限的3 倍,且与临床治疗预后相关。A级胰瘘:即生化漏(biochemical leak,BL),与临床进程无关,但可依靠实验室检测获知的一个胰瘘前状态。B 级胰瘘:强调需要和临床相关并影响术后进程,包括持续引流3 周以上;出现临床相关胰瘘治疗措施改变;使用经皮或内镜穿刺引流;采取针对出血的介入治疗;发生除器官衰竭外的感染征象。一旦由于胰瘘感染等原因而发生单个或多个器官功能障碍,B 级胰瘘进展为C 级,B 级和C 级胰瘘又称为 临 床 相 关 术 后 胰 瘘(clinically relevant postoperative pancreatic fistula,CR-POPF)。
结 果
患者临床特征本研究共纳入两家医院的17例EOC 患者,中位年龄为57(34~72)岁,3 例患者接受初次肿瘤细胞减灭术(primary debulking surgery,PDS),10 例患者在紫杉醇+卡铂辅助化疗后接受中间型肿瘤细胞减灭手术(interval debulking surgery,IDS),4 例为复发卵巢癌行再次肿瘤细胞减灭术(secondary cytoreductive surgery,SCR)。13 例初治患者包括FIGO 分期ⅢC 期4 例和ⅣB 期9 例,初治组术前血清糖类抗原125(CA125)中位值为192.0(15.6~2373.0)U/mL,复发组CA125 中位值为112.8(10.0~308.0)U/mL。本研究所有患者的美国东部肿瘤协作组(ECOG)评分均≤1 分,美国麻醉医师协会(ASA)分级≤2 级。所有患者术前接受PET/CT 或CT 增强影像学检查,64.7%(11/17)的患者术前影像提示脾门转移病灶(图1)。15 例患者病理类型为高级别浆液性癌(high grade serous ovarian carcinoma,HGSOC),1 例为HGSOC 伴部分卵巢透明细胞癌(ovarian clear cell carcinoma,OCCC),1 例为低级别浆液性癌(low grade serous ovarian carcinoma,LGSOC),详见表1。
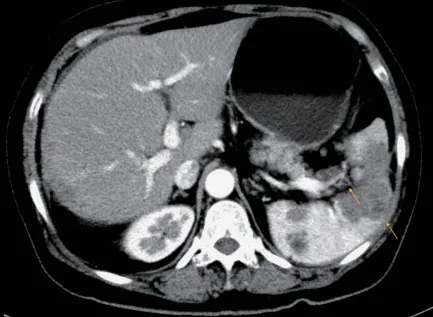
图1 术前CT 示卵巢癌脾门和脾脏转移病灶Fig 1 Preoperative CT scan showed metastatic lesions in the splenic hilum and spleen of ovarian cancer
手术相关指标13 例初治手术患者均采用梅奥卵巢癌手术复杂程度评分(surgical complexity score,SCS)[5],中位分数为10(4~15)分,≤3 分(低分组)0 例,4~7 分(中分组)2 例,≥8 分(高分组)11例。本研究中3 例患者术中联合行肠切除吻合术,4例患者联合肝段切除术,10 例患者行全层膈肌切除及胸腔探查术,5 例患者行腹主动脉旁淋巴结切除术。手术中探查:6 例患者发现胰尾转移肿瘤,所有患者均可见脾门转移病灶,2 例为数枚0.5~1 cm 脾门肿瘤,15 例为2~7 cm 脾门肿瘤,其中8 例患者为脾门伴脾包膜转移。为了完整切除肿瘤,9 例患者采用直线切割闭合器行胰尾切除后手工缝合加固,8 例患者采用手工切除。本组手术R0 切除率为76.5%(13/17),残留病灶<1 cm 的比例为88.2%(15/17),其中初治手术R0 切除率为76.9%(10/13),复发手术R0 切除率为75.0%(3/4)。未达到R0 切除的患者中,2 例因小肠壁多发肿瘤而无法切除,残留<0.5 cm,其中1 例发生术后B 级胰瘘;1 例因肝膈面肿瘤浸润程度严重,残留>1 cm;1 例因无法耐受更大手术仅上腹部达到R0 切除,残留>1 cm。本研究中82.4%(14/17)的患者术中接受输血,输血量为300~2 400 mL,术后58.8%(10/17)的患者转入重症监护室(1~2 天)。
术后并发症及管理本研究中23.5%(4/17)的患者术后发现生化漏(A 级胰瘘),17.6%(3/17)的患者发生B 级胰瘘,无C 级胰瘘,无围手术期死亡病例,临床相关胰瘘发生的临床特征分析详见表2。根据《 常见不良事件评价标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0 版》,8 例患者出现手术相关的CTCAE 2~3 级并发症,包括胰瘘7 例(4 例2 级、3 例3 级)、胸腔积液5 例(2 级)、急性肾功能不全2 例(2 级)、腹腔感染1 例(3 级)。

表2 临床相关胰瘘患者手术临床特征Tab 2 Surgery parameters of clinically relevant postoprative pancreatic fistula patients [Median (range) or n(%)]
所有患者术中脾窝放置负压引流管,16 例患者术后隔天或间隔2 天监测引流液淀粉酶,临床相关胰瘘组移除引流管时间为11(11~12)天,无临床相关胰瘘组移除时间为7(3~10)天。术后预防性应用生长抑素,监测引流液淀粉酶降至正常后拔除引流管,并停用生长抑素。所有生化漏患者均表现为术后引流液淀粉酶升高,无其他临床症状。临床相关胰瘘患者术后住院中位时间为14(11~15)天,无临床相关胰瘘组为10(6~18)天;临床相关胰瘘组术后恢复至化疗中位时间为21(19~37)天,无临床相关胰瘘组为15(13~29)天。
临床相关术后胰瘘病例分析3 例B 级胰瘘病例分析:(1) 1 例ⅣB 期患者行PDS 手术,术后第3天引流液淀粉酶达881.0 U/L,伴发热、引流液浑浊,腹腔积液细菌培养证实腹腔感染,予以抗感染、生长抑素治疗,术后11 天复查引流液淀粉酶指标正常;(2) 1 例患者PDS 术后第3 天引流液淀粉酶达17 919.0 U/L,术后第4 天CT 见左膈下包裹性积液遂行穿刺引流及药物治疗,术后第9 天好转;(3) 1 例复发患者行SCR 手术,术后第7 天引流液淀粉酶明显升高,伴发热、上腹痛,考虑原引流管堵塞予拔除,CT 引导下穿刺引流并放置新引流管,同时予生理盐水冲洗,充分引流及药物治疗后,术后第12 天好转。所有胰瘘患者均未出现与胰腺切除相关的糖耐量异常或严重的消化吸收功能障碍,也未出现与脾切除相关的血栓栓塞性疾病、免疫环境改变造成的严重感染。
术后随访随访截止到2023 年1 月20 日,本研究中位随访时间为14(4~64)个月,中位无进展生存期(progression free survival,PFS)为10(5~32)个月,随访中有8 例初治患者和1 例复发患者复发。3例患者死亡:1 例为一线铂类化疗肿瘤未控,总生存期(overall survival,OS)9 个月;1 例为SCR 术后肿瘤进展,OS 为12 个月;1 例初治组患者OS 为21 个月。2 例患者手术后随访至52 和64 个月,无进展生存。
讨 论
70%以上的卵巢癌患者确诊时已是晚期,超过一半的患者伴有上腹部转移,实施上腹部手术达到满意的肿瘤细胞减灭术已在临床上得到广泛认可[3,6]。Bristow 等[1]的Meta 分析结果显示,研究队列中实施最大限度的卵巢癌根治性肿瘤细胞减灭术的比例每提高10%,则患者的中位生存时间提高5.5%。胰腺属于腹膜外器官,且位于网膜囊内,卵巢癌中胰腺表面的种植转移并不常见,脾门处大网膜、脾包膜及胰尾是卵巢肿瘤易发生种植转移的部位,为了完全切除该区域的肿瘤以达到上腹部的R0切除,实施脾脏联合胰尾切除是必要的[7],本研究中R<1 cm 的比例为88.2%(15/17),R0 切除率在初治组和复发组分别为76.9%和75.0%。
在卵巢癌肿瘤细胞减灭术中,手术医师需权衡最大瘤体减灭效果与患者手术耐受能力及发生各类手术并发症的利弊[8],在患者能够耐受手术的情况下,卵巢癌侵犯脾脏、胰尾不应该成为获得满意肿瘤细胞减灭术的障碍。本研究中患者的中位年龄为57 岁(最大72 岁),ECOG 评分0~1 分,ASA 分级为1~2 级,10 例患者的内科合并症经评估术前控制良好,对于手术有良好的耐受能力,能较快从手术创伤中恢复。根据梅奥的卵巢癌初治手术复杂评分(SCS)标准,本研究初治组中位SCS 分数为10(4~15)分,手术复杂程度高分(≥8 分)比例为84.6%(11/13)。脾脏联合胰尾切除术常发生于复杂程度高的卵巢癌减瘤手术中,该类减瘤手术还具有手术时间长、术中出血量和体液丢失量大、需输血治疗等特点,58.8%(10/17)的患者术后转入外科重症监护室治疗,故实施该手术应充分考虑患者的安全及获益。对于术前影像提示脾门转移的患者,应充分考虑到术中行脾脏、胰尾切除的可能性。本研究中64.7%(11/17)的患者术前影像有提示,但仍有35.3%(6/17)的患者难以从术前影像中判断是否需行脾脏、胰尾切除,故术中还应仔细探查及辨认脾门及胰尾处肿瘤的情况。
卵巢癌上腹部手术中胰腺手术相关并发症发生率高[9],最常见的并发症为胰瘘[10],严重的胰瘘可能继发腹腔感染、出血性疾病、甚至多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),死亡风险高。与胰瘘相关的危险因素包括切除胰腺厚度、术中失血量、手术时间、伴脾切除术、未选择性结扎主胰管、开放性被动引流[11]。文献报道,手工切除与直线切割闭合器切除胰腺组织术后胰瘘发生无明显差异,残端加固缝合可减少胰瘘的发生[12]。术后放置负压引流管对胰液充分引流可减少临床相关胰瘘的发生,保证引流管的通畅引流也是治疗术后胰瘘的有效手段。术后监测引流液淀粉酶可作为胰瘘的诊断指标,Nishikimi 等[13]的回顾性研究数据表明,卵巢癌伴脾切除术后第3天引流液淀粉酶水平可以作为临床相关胰瘘的早期诊断指标,对于显著升高的患者须警惕胰瘘严重程度升级。除常规监测体液淀粉酶外,临床相关胰瘘患者可能表现为左上腹痛伴发热>38 ℃,对于有该类征象的患者应高度警惕,必要时行影像检查和穿刺引流,以免发生更严重的并发症,本研究中的2 例B 级胰瘘患者为再次穿刺充分引流后好转。本研究队列的患者手术距首次化疗的中位时间为17(13~37)天,其中1 例B 级胰瘘患者因合并腹腔感染导致术后化疗间隔时间延长至37 天,其余患者均在术后1 个月内完成首次化疗。术后化疗间隔时间的延长会影响总体治疗效果[14],本研究中大部分患者处于可接受范围内,但临床相关胰瘘的发生会延长该时间间隔,故尽早发现并及时控制术后并发症、促进患者尽快恢复非常重要。
妇科肿瘤领域关于胰尾切除的研究较少,且均为回顾性研究。随着手术医师对于上腹部手术技术经验的逐渐积累,过去20 年卵巢癌减瘤手术中脾脏联合胰尾切除术的病例不断积累,文献中报道的临床相关术后胰瘘多为B 级,经治疗后可痊愈,围手术期死亡率并没有显著增加,对于并发症胰瘘的早期识别及处理尤为重要,而充分的局部引流和保持引流通畅对术后并发症的管理至关重要[15]。受限于回顾性研究,病例数量和随访时间有限,目前的研究数据尚无法评估脾脏联合胰尾切除术对患者的生存获益。
脾脏联合胰尾切除术在卵巢癌手术中会增加并发症胰瘘的发生,术后应加强监测、尽早识别和及时处理。为获得满意的减瘤效果,在卵巢癌肿瘤细胞减灭术中可行脾脏联合胰尾切除术,同时警惕胰瘘这一并发症的发生。
作者贡献声明刘艺璇 文献调研和整理,数据收集、整理和统计,论文撰写和修订。闫倩倩数据收集、整理和统计。陈雨莲 可行性分析,数据分析。周颖 数据分析,研究指导,论文修订。江榕 研究设计和指导,论文构思和修订。
利益冲突声明所有作者均声明不存在利益冲突。

