基于二代测序技术的胰腺癌胚系变异携带情况及临床因素相关性分析
姜惠琴 张 丽 黄 斐 陈馨宁 郁 俐 沈敏娜 王蓓丽 潘柏申,3 郭 玮,3,4△
(1复旦大学附属中山医院检验科 上海 200032; 2上海市老年医学中心检验科 上海 201100;3复旦大学附属中山医院吴淞医院检验科 上海 200940; 4复旦大学附属中山医院厦门医院检验科 厦门 361015)
胰腺癌是全球最常见的恶性肿瘤之一,其发生与多种因素相关,约3%~10%的胰腺癌病例具有家族遗传史[1],10%~20%的胰腺癌患者携带肿瘤易感基因的胚系致病性变异[2]。BRCA1/2、PALB2、ATM、CDKN2A、STK11以及错配修复基因(MLH1、MSH2、PMS6、PMS2)的胚系变异被证实与遗传性胰腺癌的发病密切相关。此外,多种遗传性肿瘤综合征都会导致胰腺癌的发病风险显著增加,例如遗传性乳腺卵巢癌综合征、Lynch 综合征、Peutz-Jeghers 综合征和Li-Fraumeni综合征等[3]。
美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐所有确诊为胰腺癌的患者进行遗传肿瘤综合征相关的胚系基因检测[4]。美 国 胃 肠 病 学 会(American College of Gastroenterology,ACG)针对遗传性胃肠道肿瘤综合征的管理和基因检测的指南中提到,所有疑似家族性胰腺癌(familial pancreatic cancer,FPC)患者都应接受BRCA1/2、CDKN2A、PALB2和ATM基因检测[5]。
随着二代测序技术的不断发展,多基因检测在临床诊疗中的接受度越来越高。然而,目前对于受检者及检测基因的选择仍缺乏统一的标准,多基因检测在评估胰腺癌遗传风险中的价值仍需要进一步验证。本研究采用二代测序多基因检测方法,分析胰腺癌患者中胚系变异的携带率,并探索可能相关的临床病理因素,旨在为胰腺癌胚系基因检测的实施提供一定的参考价值。
资 料 和 方 法
一般资料本研究为单中心回顾性研究,经复旦大学附属中山医院伦理委员会批准(批准号:B2021-056)。筛选2021 年4 月至2022 年12 月就诊于复旦大学附属中山医院的胰腺癌患者,纳入标准:(1)临床确诊的胰腺癌患者;(2)接受肿瘤易感基因胚系检测。排除标准:临床信息不详者。采集患者的临床信息,包括性别、发病年龄、肿瘤类型、肿瘤个人史及肿瘤家族史。将具备肿瘤家族史或个人史或早发性胰腺癌患者定义为遗传高危组,不具备任一项因素的患者定义为遗传低危组。
方法使用EDTA 抗凝管采集患者外周血10 mL,提取白细胞样本基因组DNA。按标准进行文库构建及质控,随后采用Illumina Nextseq 550 (美国Illumina 公司)测序仪进行测序,共检测21 个肿瘤易感基因(表1),其中同源重组修复(homologous recombination repair,HRR)通路相关的基因有17 个:ATM、ATR、BARD1、BRCA1、BRCA2、BRIP1、CHEK1、CHEK2、FANCA、FANCL、MRE11、NBN、PALB2、RAD51B、RAD51C、RAD51D和RAD54L,其余4 个基因为CDH1、PTEN、STK11和TP53。测序数据与人类参考基因组hg19 版本进行比对。根据美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics,ACMG)指南将基因变异分为5 类:良性(benign,B)、可能良性(likely benign,LB)、意义不明(variant of uncertain significance,VUS)、可能致病(likely pathogenic,LP)和致病(pathogenic,P)。

表1 本研究中检测的21 个肿瘤易感基因列表Tab 1 List of 21 tumor susceptibility genes detected in this study
统计学方法所有统计分析均采用SPSS 19.0软件进行处理。分类资料采用χ2检验或Fisher 精确检测,P<0.05 为差异有统计学意义。
结 果
患者临床特征本研究共纳入271例胰腺癌患者,男性占59.0%,导管腺癌占95.9%。6.6%的患者发病年龄早于50 岁,3.3%具有肿瘤家族史(一级亲属罹患胰腺癌、乳腺癌、胃癌、结直肠癌、前列腺癌或卵巢癌),5.5%伴有其他肿瘤个人史(既往确诊乳腺癌、胃癌、结直肠癌、前列腺癌或卵巢癌)(表2)。

表2 271 例胰腺癌患者的临床病理特征Tab 2 Clinicopathological characteristics of 271 patients with pancreatic cancer[n(%)]
胰腺癌胚系变异检出率针对本研究检测的21 个肿瘤易感基因,共有17 例(6.3%)患者检出P/LP 变异,61 例(22.5%)患者检出VUS 变异。检测出P/LP 变异的基因包括ATM、BRCA2、BRIP1、CHEK2、FANCA、MRE11、PALB2、STK11,其中PALB2胚系变异的频数最多,其次为BRCA2和ATM(图1A)。若仅分析HRR 通路相关的17 个基因,则P/LP 与VUS 变异的检出率分别为5.9%与20.7%。在所有检测的基因中,ATM、BRCA1、BRCA2、PALB2、STK11、TP53这6 个基因是明确的遗传性胰腺癌相关基因,也是NCCN 指南推荐胰腺癌患者检测的基因[3]。本研究中,胰腺癌相关基因P/LP 与VUS 变异的检出率分别为4.8% 与10.3%(表3)。

图1 胰腺癌患者胚系P/LP 变异的分布Fig 1 Distribution of germline P/LP variants in pancreatic cancer patients
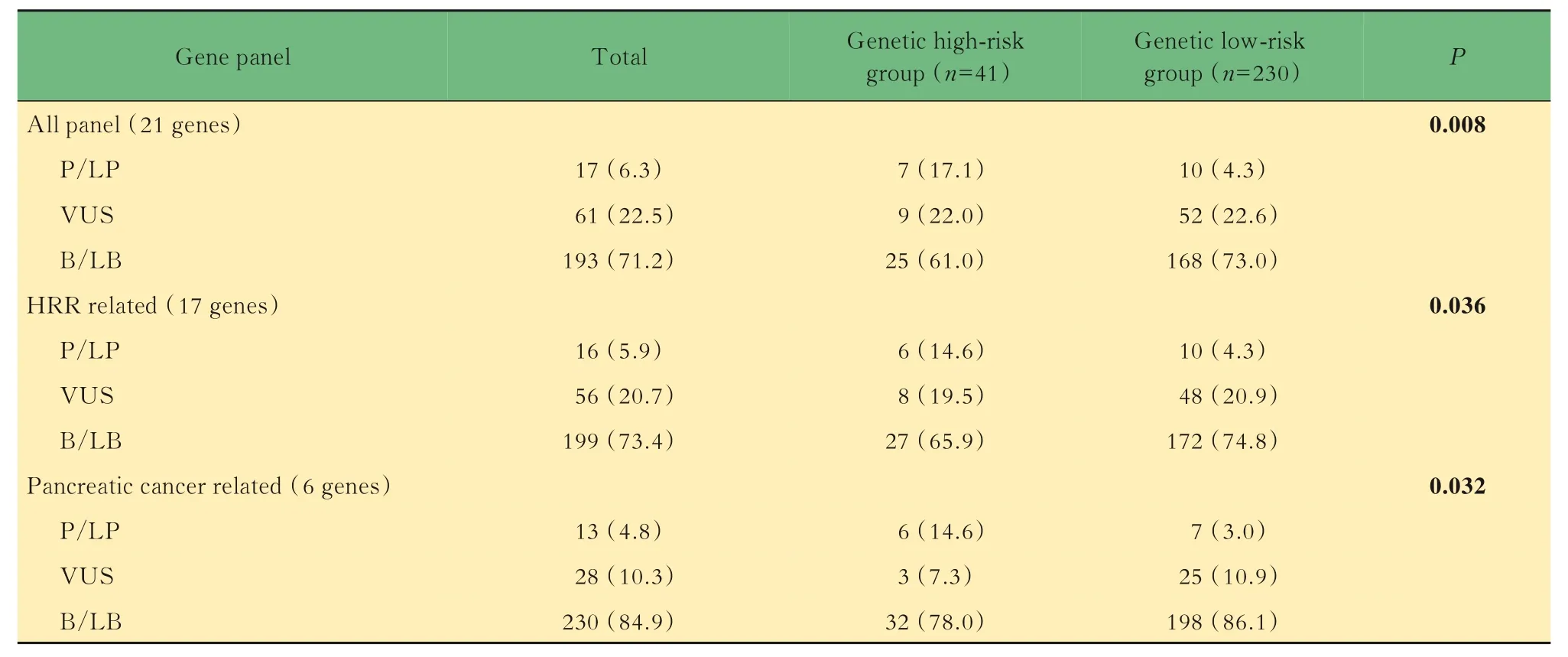
表3 胰腺癌患者中胚系变异的检出率Tab 3 The detection rate of germline mutations in pancreatic cancer patients [n(%)]
胚系变异相关危险因素分析进一步分析临床病理特征与胚系变异检出率之间的关系。发病年龄<50 岁、有肿瘤家族史或肿瘤个人史的患者中,P/LP 变异检出率稍高,但差异无统计学意义。遗传高危组P/LP 变异的检出率高于遗传低危组,而两组之间VUS 变异的检出率相近。根据分析基因数的不同,遗传高危组中P/LP 变异检出率为14.6%~17.1%,VUS 变异检出率为7.3%~22.0%;而在遗传低危组中P/LP 变异检出率仅为3.0%~4.3%,VUS 变异检出率为10.9%~22.6%(表3)。此外,遗传高危组与遗传低危组患者的胚系P/LP变异谱也存在差异。遗传高危组患者中,胚系BRCA2基因P/LP 变异的频率最高;而遗传低危组中,P/LP 变异频率最高的基因为PALB2(图1B、C)。
讨 论
随着研究的不断深入,胚系肿瘤易感基因检测的价值得到进一步认可。遗传性胰腺癌的发生与多种胚系基因的变异相关,包括BRCA1、BRCA2、PALB2、STK11等基因[3]。通过胚系检测,有利于筛选胰腺癌易感人群,给予个体化监测及预防措施。此外,胚系基因变异可改变胰腺癌患者的治疗决策。对于携带BRCA1/2胚系变异的患者,可从多腺苷二磷酸核糖聚合酶抑制剂以及铂类药物治疗中获益[4]。对于携带TP53胚系变异的患者,放疗可能会增加二次肿瘤发生的风险。与此同时,携带胚系变异的患者可能会出现多原发肿瘤,除了针对胰腺癌的诊疗,还需要排查第二原发肿瘤[3]。
既往研究[6-11]显示,胰腺癌患者中携带肿瘤易感基因胚系变异的比例为3.8%~20.7%。不同研究之间变异率的差异主要由于检测基因数及受检者纳入标准的不同而导致。本研究采用了包含21 个肿瘤易感基因的NGS 方法对中国胰腺癌患者进行检测,整体胚系变异的检出率为6.3%,与既往研究[12]结果相仿。值得注意的是,胚系变异主要集中于胰腺癌相关基因,扩大检测基因数量仅带来较小的检出率增加(表3)。
针对携带胚系变异的胰腺癌患者是否具备特殊的临床病理特征,目前仍无定论。既往研究[13]显示,携带BRCA1/2变异的胰腺癌患者发病年龄提前10 年左右。Varghese 等[14]的研究发现,<50 岁的年轻胰腺癌患者中胚系基因变异的检出率高达31.9%。然而也有研究[15-16]显示早发性胰腺癌(<50岁)患者中胚系变异的携带率与老年患者无显著差异。本研究中,早发性胰腺癌患者中胚系变异的检出率更高,但并未达到统计学差异(16.7%vs.5.5%,P=0.093)。
肿瘤家族史以及多发性肿瘤个人史往往是筛选遗传性肿瘤患者的重要临床因素。本研究发现具备肿瘤家族史或个人史的胰腺癌患者检出更高比例的胚系变异,但差异无统计学意义。既往3 项研究[8,17-18]显示,具备肿瘤家族史或个人史的胰腺癌患者中,检测出更高比例的胚系变异携带(11.0%~18.4%);而无特定肿瘤家族史或个人史的人群中检出率仅为2.5%~10.8%。值得注意的是,综合发病年龄、家族史及个人史,或许能够更好地筛选出携带胚系变异的胰腺癌患者。本研究中,遗传低危组患者的胚系P/LP 变异的检出率仅为4.3%,显著低于遗传高危组的17.1%(表3)。
随着二代测序技术的不断改进以及测序成本的逐级下降,遗传易感基因的检测在肿瘤临床诊疗中的应用越来越普及,多基因检测的模式也逐渐成为主流。然而,随着更多中低外显率基因以及临床意义尚不明确的基因被纳入检测,多基因检测在肿瘤分险评估中的价值仍需进一步验证。随着检测基因数的增加,VUS 检出率也明显增加。本研究中,当检测基因数从6 个增加到21 个时,VUS 检出率从10.3%增加至22.5%(表2)。这些额外检出的意义不明变异可能会给患者带来心理负担,甚至增加不必要的医学检查。建议医师给予患者充分的结果解释及遗传咨询,并且通过不断的数据积累及共享增加位点评估的临床证据。
目前关于胰腺癌胚系变异的数据大部分来自国外研究队列[6-10],仅1 项来自中国南京的队列研究[11]。该研究中,散发性胰腺癌患者携带胚系变异的比例为6.2%,与本研究结果相仿。然而,该研究并没有进一步分析肿瘤家族史及个人史等临床因素与胚系变异检出率的关系[11]。本研究通过二代测序多基因检测技术,不仅评估了胰腺癌患者中胚系变异的携带率,也探索了胚系变异相关的临床因素;丰富了中国人群胰腺癌的遗传数据,同时也为胰腺癌胚系检测的实施提供了一定的理论依据。随着肿瘤易感基因检测的广泛应用,胰腺癌患者的遗传因素将得到更为深入的剖析,未来仍需要更多大样本的研究来探索多基因测序带来的临床价值。
作者贡献声明姜惠琴,张丽 研究设计,论文撰写。黄斐,陈馨宁,郁俐,沈敏娜 样本检测,资料收集。王蓓丽,潘柏申 研究指导。郭玮 研究设计,论文修改和指导。
利益冲突声明所有作者均声明不存在利益冲突。

