Sestrin1参与调控小鼠肝脏细胞糖异生
郭艳芳,耿 超,解相宏,陈恩惠,郭泽宇,张明龙,刘晓军
中国医学科学院基础医学研究所 北京协和医学院基础学院 重大疾病共性机制研究全国重点实验室,北京 100005
糖尿病作为一类严重威胁人类身体健康的慢性代谢性疾病,一直受到人们的广泛关注。近年来,糖尿病患者不断增加,深入研究糖尿病的发病机制和治疗药物迫在眉睫。糖尿病的主要特征为血糖升高,主要由胰岛素分泌缺乏和/或胰岛素抵抗引起[1]。身体的主要糖异生部位就是肝脏,它是代谢过程的核心部分。沉默信息调节蛋白1(Sirtuin 1, SIRT1)是一种去乙酰化酶以及酵母SIR2蛋白的一种直系同源物,可直接将细胞代谢状态(通过NAD+)与染色质结构与基因的表达调控密切连接起来[2]。肝葡萄糖的产生主要是由肝糖异生和糖原分解所决定的,磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxy-lase,PEPCK)和葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6Pase)的激活影响着糖异生的发生,抑制G6Pase和PEPCK的表达,可以有效的减少体内肝葡萄糖的产生[3]。有研究发现,过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferators-activated receptors gamma co-activator 1α, PGC-1α)有效调控了肝糖异生的关键酶的功能及表达。应激诱导蛋白(Sestrin,SESN)家族包括SESN1、SESN2和SESN3,它们是一类进化高度保守的蛋白质,在体外,SESN表现出氧化还原酶的活性。有研究发现SESN2的缺失能加重葡萄糖耐受不良、肝脂肪变性和胰岛素抵抗,表明应激诱导的SESN蛋白家族,可能在调控以及维持葡萄糖和脂质代谢的稳态方面具有不可或缺的作用[4]。但SESN1在小鼠肝脏糖异生中的作用及调节机制还有待研究。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级8周龄的雄性C57BL/6J(中国医学科学院基础医学研究所实验动物中心)。
1.1.2 细胞:人肝癌细胞系HepG2(本实验室保存)。
1.1.3 质粒和腺病毒:SESN1-Flag表达质粒、PGC-1α-Flag表达质粒、pcDNA3.1质粒、pRL-TK质粒、报告基因质粒pGL3-Basic-PGC-1α启动子, 带GFP标签的腺病毒(Ad-GFP),对照干扰腺病毒(Ad-shCON),SIRT1干扰腺病毒(Ad-shSIRT1)(本实验室保存)。
1.1.4 主要试剂:SDS,Tris,甘氨酸(AMRESCO 公司);蛋白酶抑制剂,Trizol(Invitrogen公司);DMEM基础培养基,常规RPMI-1640细胞培养基以及胎牛血清(Gibco公司);PierceTMBCA Protein Assay Kit(Thermo Fisher Scientific公司);PEI;佛司可林(forskolin,Fsk)与地塞米松(dexamethasone,Dex);Dual-Luciferase® Reporter Assay System和SYBR Green Ⅰ Q-PCR kit(Promega公司);抗SIRT1抗体(Cell Signal Technologies);抗FLAG抗体(Sigma公司);抗乙酰赖氨酸抗体(MilliPore公司),抗GAPDH抗体(Abmart公司)。
1.2 方法
1.2.1 小鼠原代肝细胞的分离和培养:于6孔板接种C57BL/6J小鼠的原代肝细胞,培养至贴壁后分别感染对照干扰腺病毒(Ad-shCON),SIRT1干扰腺病毒(Ad-shSIRT1),感染24~48 h后收集细胞。具体实验方法见参考文献[5]。在6孔板中以(2~4)×104个/孔的数量接种HepG2细胞,培养至细胞汇合度为60%~70%后进行转染,对照组转染pcDNA3.1质粒,实验组同时转染SESN1-FLAG和PGC-1α-FLAG质粒,每组各设3个复孔,转染方式参照转染试剂说明书。针对Sirt1的shRNA(ShSIRT1)序列是GATGAAGTTGACCTCCTCA,对照shRNA(ShCON)序列是CTTACGCTGAGTACTTCGA。
1.2.2 双荧光素酶报告基因检测启动子活性:用荧光素酶报告质粒(200 ng)和pRL-TK(10~20 ng)将一定数量的表达载体共转染入HepG2细胞。培养24~48 h后,用Dual-Luciferase® Reporter Assay System商品化试剂盒检测荧光素酶的活性,根据对照组进行均一化处理。
1.2.3 RT-qPCR检测mRNA相对表达量:采用Trizol法从人肝癌细胞株或原代肝细胞中提取总RNA。用Super ScriptTM反转录酶将约2 μg的总RNA逆转为cDNA。在Bio-Rad CFX系统上使用SYBR Green Ⅰ Q-PCR试剂盒进行实时定量反转录聚合酶链式反应。所有基因表达数据均归一化为β-actin表达水平,最终得到mRNA的相对表达量。具体的引物序列见表1。
表1 RT-qPCR引物序列Table 1 Primer sequence of RT-qPCR
1.2.4 蛋白质乙酰化的测定:用真核转染试剂将所构建的表达载体导入HepG2细胞。细胞用含有蛋白酶抑制的RIPA裂解液(强)进行裂解,通过离心收集上清。Protein G琼脂糖珠用RIPA裂解液(强)预清洗,然后用抗FLAG一抗将蛋白旋转孵育2 h(4 ℃)。接着将细胞裂解液加入Protein G琼脂糖珠旋转孵育过夜(4 ℃)。第二天早上将琼脂糖珠洗涤6次,在缓冲液A(1% NP-40和0.1 mmol/L Na3VO4)中洗涤3次,在缓冲液B(0.01 mol/L Tris、pH 7.5、1 mmol/L EDTA、0.1 mol/L氯化钠和0.1 mmol/L Na3VO4)中洗涤3次。用1×SDS缓冲液洗脱磁珠中的抗原,100 ℃金属浴10 min后用常规的Western blot测定蛋白质表达量。
1.3 统计学分析

2 结果
2.1 肝组织中SESN1的表达受营养状态的控制。
禁食24 h和48 h都诱导了小鼠肝脏SESN1的mRNA表达水平增加(P<0.001),而重新喂养12 h则逆转了这一诱导效果(P<0.001) (图1A)。用Fsk和Dex共同处理模拟细胞中胰高血糖素和其他糖皮质激素的禁食作用可以诱导SESN1 mRNA表达水平的上调(P<0.001) (图1B)。
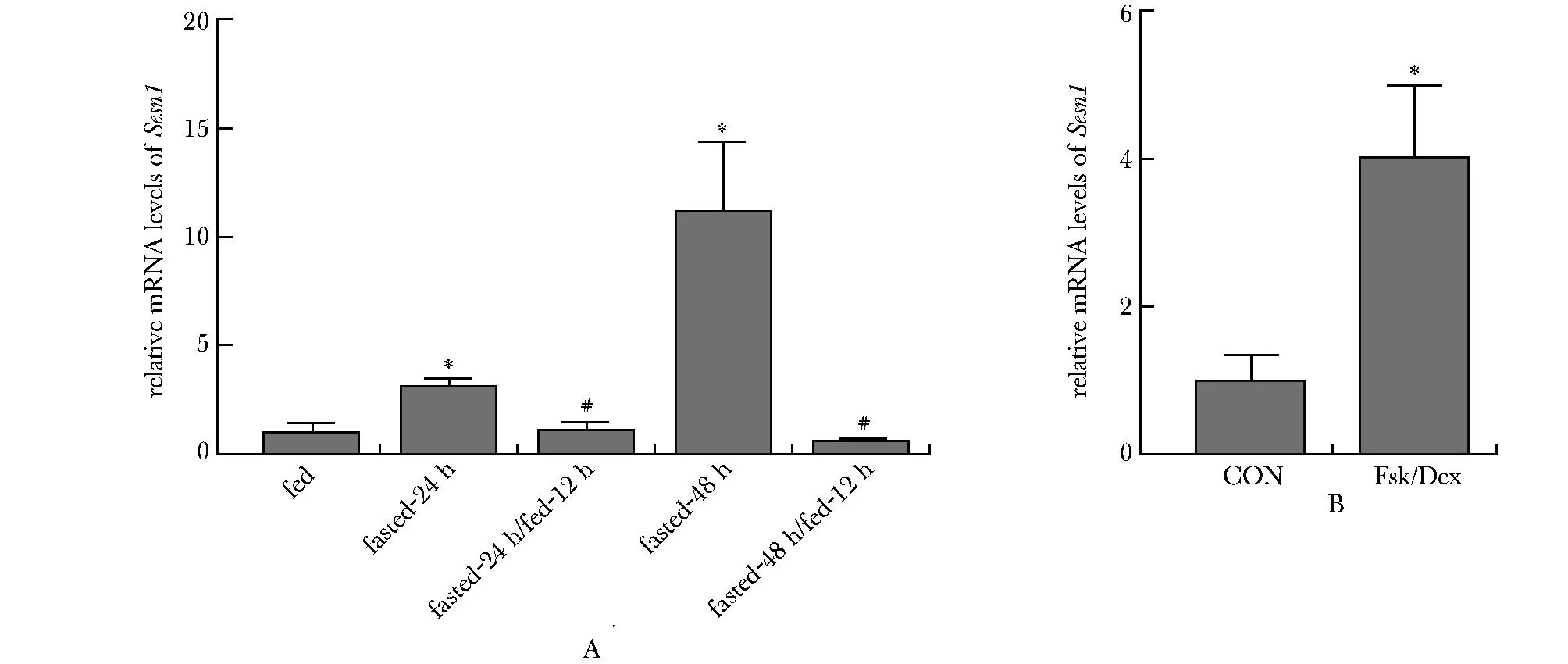
*P<0.001 compared with fed group;# P<0.001 compared with fasted-24 h.
2.2 SESN1提高原代肝细胞糖异生基因PGC-1α、PEPCK和G6Pase的表达水平
在小鼠原代肝细胞中,SESN1的过表达增加了PGC-1α及其靶基因,糖异生基因PEPCK和G6Pase的基因表达水平(P<0.001) (图2A)。过表达SESN1增强了PGC-1α的启动子活性(P<0.001),PGC-1α对其自身的启动子活性有作用(P<0.01) (图2B)。
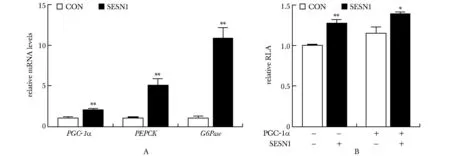
*P<0.01, **P<0.001 compared with CON group.
2.3 SESN1依赖SIRT1促进PGC-1α去乙酰化
SESN1的过表达降低了原代肝细胞中PGC-1α的乙酰化(图3A)。分别利用SIRT1家族抑制剂NAM和shRNA腺病毒干扰SIRT1表达,结果显示均拮抗了SESN1对PGC-1α的去乙酰化作用(图3B)。综上,SESN1促进PGC-1α的去乙酰化依赖于SIRT1。
2.4 SESN1能诱导PGC-1α及依赖SIRT1的糖异生相关基因的表达
当利用shRNA腺病毒下调SIRT1的表达时,SIRT1诱导的PGC-1α(P<0.05)、PEPCK(P<0.000 1)和G6Pase(P<0.000 1)表达也明显降低(图4)。
3 讨论
糖异生是生物体将多种非糖物质转变成葡萄糖或糖原的过程,对维持空腹状态下血糖正常水平具有重要意义[6]。在哺乳动物中,肝脏是机体糖脂代谢重要器官,是通过糖原分解或糖异生途径产生内源性葡萄糖主要场所。在某些应激情况下,肝脏糖异生过度激活可导致多种代谢性疾病的发生。
SESN 被认为是一种氧化应激中的关键抑制因子,越来越多的证据表明 SESN 与许多肝脏疾病有关。过往的研究表明,营养过剩造成哺乳动物雷帕霉素靶蛋白复合体(mammalian target of rapamycin complex,mTORC)和p70S6激酶(p70S6 kinase,p70S6K)的慢性激活,导致肥胖相关的代谢疾病,SESN作为一种应激诱导蛋白,能激活腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)并抑制mTORC1-S6K的活性,SESN2下调可加重肥胖诱导的mTORC1-S6K激活、糖耐量异常、胰岛素抵抗和肝骨病,所有这些都可被AMPK激活逆转[7]。此外,即使在没有营养过剩和肥胖的情况下,同时去除SESN2和SESN3也会引起肝脏mTORC1-S6K的激活和胰岛素抵抗,这些结果表明,应激诱导的SESN蛋白家族在控制哺乳动物的脂肪和葡萄糖代谢方面具有重要的动态平衡功能[8]。在本研究中,禁食不同时间的小鼠的肝脏和用FSK和Dex处理6 h的肝原代细胞中SESN1的mRNA表达水平均升高,说明SESN1在肝脏中的表达与糖异生潜能之间存在相关性。此外,有研究表明,PGC-1α在正常的肝细胞中能激活cAMP-PKA-CREB信号通路,可与肝细胞核因子-4α(HNF-4α)和叉头盒转录因子 O1(FOXO1)相互作用,从而诱导G6Pase和PEPCK1的表达,小鼠禁食和再喂养也诱导肝脏PGC-1α基因表达水平变化[9]。本研究中,过表达SESN1促进PGC-1α、PEPCK和G6Pase的基因表达水平并增强了PGC-1α的启动子活性,表明SESN1可能通过调控PGC-1α、PEPCK和G6Pase的表达影响肝脏糖异生。也有研究证实,在去乙酰化激活 SIRT1后,其可以通过上调PGC-1α的表达水平来保护肝组织[10]。在本研究中,SESN1的过表达降低了原代肝细胞中PGC-1α的乙酰化。分别利用Sirt家族抑制剂NAM和shRNA腺病毒干扰Sirt1表达,均拮抗了SESN1对PGC-1α的去乙酰化作用,说明SESN1依赖于Sirt1促进PGC-1α的去乙酰化。
综上所述, SESN1能通过诱导PGC-1α及糖异生相关基因PEPCK和G6Pase的表达来调控小鼠肝脏糖异生,可能与Sirt1的去乙酰化作用有关。本研究表明SESN1可能是糖代谢异常的重要新靶点,为未来糖尿病预防和临床诊疗提供新的思路。

