甲状腺微小乳头状癌颈部中央区淋巴结转移临床特征和危险因素分析*
汪满金,吴宝潮,王德志,汪海仪,袁小庆,田远广
244000 安徽 铜陵,铜陵市人民医院 甲状腺和乳腺外科(汪满金、吴宝潮、王德志、汪海仪),病理科(袁小庆);233000 安徽 蚌埠,蚌埠医学院 研究生院(田远广)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最为常见的甲状腺恶性肿瘤类型,临床上将肿瘤最大直径≤10 mm 的PTC 称为甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)[1]。近年来随着居民健康体检意识的提高和超声检查技术在甲状腺诊疗中的应用,PTMC的检出率及其在PTC 中所占比例均逐年增加[2]。虽然PTMC 恶性程度较低,预后也较好,但临床上术后病理诊断PTMC 有淋巴结转移者较为常见,尤其是中央区淋巴结(central compartment lymph node,CCLN)转移,是PTMC 具有侵袭性的重要临床特征,与肿瘤的复发和远处转移密切相关[3-4]。目前临床触诊和术前超声检查对CCLN 的漏诊率较高,且行业内对PTMC 手术时行预防性中央区淋巴结清扫(central lymph node dissection,CLND)的指征和范围仍存在争议[3]。因此,本研究旨在分析PTMC 颈部CCLN 转移率、临床病理特征及其影响因素,指导PTMC 患者选择合适的手术方式。
1 资料和方法
1.1 一般资料
回顾性选取铜陵市人民医院甲状腺和乳腺外科从2020 年1 月至2022 年12 月收住入院首诊符合入组条件的PTMC 患者共335 例。入组标准:①均为首次就诊,既往无颈部手术史;②术后病理证实为PTMC,肿瘤最大直径≤10 mm;③均行规范化手术治疗和CLND。排除标准:①术中病理报告良性病变而未行CLND 者;②PTMC 合并有其它病理类型肿瘤;③PTMC 合并有肿瘤直径>10 mm 的乳头状癌;④合并有全身严重基础疾病者或精神疾病患者;⑤既往有颈部或甲状腺手术或放疗治疗史;⑥术前彩超、侧颈淋巴结穿刺或术中探查等行侧颈淋巴结清扫病理证实有侧颈淋巴结转移者。本研究通过铜陵市人民医院伦理审批(审批号:2023005)。
1.2 数据收集与判断标准
收集每位入组病例的基本信息包括:年龄、性别、彩超报告、颈部CT 影像学报告、肿瘤的大小(最大径)、是否是双侧甲状腺腺叶肿瘤、单侧腺叶有无多灶肿瘤、肿瘤有无侵犯包膜、是否呈浸润性生长、有无并发桥本甲状腺炎、有无CCLN 转移或侧颈淋巴结转移、淋巴结转移个数、术式、术后是否有声音嘶哑或低钙血症等。
判断标准:年龄以45 岁为界;肿瘤大小以肿瘤最大径5 mm 为界;肿瘤数量>1 个确定为多灶性肿瘤;肿瘤有无侵犯包膜包括:病理证实有肿瘤突破甲状腺被膜;浸润性生长包括:腺体外侵犯带状肌或周围软组织,或侵犯气管、食管、喉返神经或椎前筋膜等;是否合并有桥本甲状腺炎以术后病理证实为准;根据CCLN 术后石蜡病理有无转移分为转移组和非转移组。
1.3 术后随访与治疗
术后注意观察患者有无饮水呛咳、手足面部麻木不适、声音嘶哑等症状,术后注意监测电解质和甲状旁腺素等,所有PTMC 患者口服左甲状腺素钠片行促甲状腺素抑制治疗,术后门诊第1、3、6、12 个月复查甲状腺功能、甲状腺球蛋白、甲状腺及颈部淋巴结彩超等检查,及时调整左甲状腺素钠片治疗剂量和监测有无局部或远处复发转移等。
1.4 统计学方法
所有数据通过SPSS 26.0 统计学分析,采用率或构成比表示计数资料,单因素分析用卡方(χ2)检验或Fisher 确切概率法,用多因素二元Logistic 回归模型分析发生颈部CCLN 转移风险的OR值和95%CI,采用ROC 曲线计算独立危险因素联合预测颈部CCLN 转移的预测价值,以P< 0.05 为差异有统计学意义。
2 结 果
2.1 患者基本信息及CCLN 转移率和术后并发症发生情况
本次调查研究结果显示,符合入组条件的PTMC共有335 例,男性61 例,女性274 例,年龄18~71 岁,中位年龄47.06 岁,平均年龄(47.06±10.24)岁。手术方式为单侧甲状腺腺叶及峡部切除+同侧CLND有268 例(80.0%),甲状腺全切术+单侧或双侧CLND有67 例(20.0%)。术后病理证实有颈部CCLN 转移者共106 例(占31.6%)。单侧腺叶多灶64 例(19.1%)、双侧腺叶癌灶67 例(20.0%)、肿瘤突破甲状腺包膜55 例(16.4%)、肿瘤呈浸润性生长44 例(13.1%)、合并有桥本甲状腺炎70 例(20.9%)。术后最常见的并发症是手足面部麻木不适和声音嘶哑,共有21 例患者出现术后并发症,其中暂时性声音嘶哑5 例(1.5%),随访3 个月内恢复,无永久性喉返神经损伤;术后有低钙血症出现手足面部麻木患者16 例(4.8%),均是行甲状腺全切术+单侧或双侧CLND 的病例,经静脉补钙和口服钙剂及骨化三醇治疗,术后3 个月内恢复,无永久性低钙血症病例。
2.2 各临床病理因素与颈部CCLN 转移单因素分析
颈部CCLN 发生转移与年龄≤45 岁、肿瘤直径>5 mm、双侧腺叶癌灶、单侧腺叶多灶、肿瘤突破甲状腺包膜和肿瘤呈浸润性生长等有关(P< 0.05;表1)。

表1 颈部CCLN 转移单因素分析Table 1.Univariate Analysis of Factors Affecting Central Cervical Lymph Node Metastasis
2.3 颈部CCLN 转移的多因素二元Logistic 分析
把单因素分析有统计差异各项因素(年龄、肿瘤最大直径、单/双侧、是否多灶、肿瘤是否突破包膜、是否呈浸润性生长)为自变量,以颈部CCLN转移为因变量(是=1,否=0)(表2),用逐步法筛选各个变量引入到多因素二元Logistic 回归模型(α= 0.05),最终进入Logistic 回归模型的指标有4个(表3),其中年龄≤45 岁、肿瘤最大直径>5 mm、双侧腺叶癌灶及肿瘤突破甲状腺包膜者是PTMC 患者发生颈部CCLN 转移的独立危险因素,未发现肿瘤是否多灶、肿瘤呈浸润性生长与颈部CCLN 转移有关。

表2 变量赋值解析Table 2.Variable Assignment
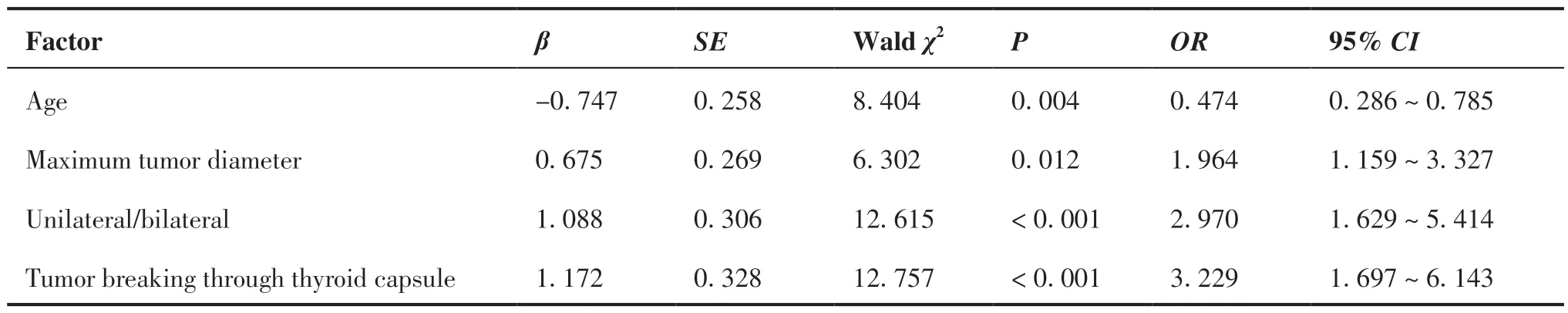
表3 颈部CCLN 转移多因素二元Logistic 分析Table 3.Multivariate Binary Logistic Analysis of Factors Affecting Central Cervical Lymph Node Metastasis
2.4 模型拟合优度检验
以上各独立危险因素联合预测颈部CCLN 转移的曲线下面积(area under the curve,AUC)为0.722,95%CI为(0.664,0.780),敏感度为0.660,特异度为0.638,约登指数为0.298,用Hosmer-Lemeshow拟合优度检验验证,P=0.250,该结果提示拟合优度较好(图 1)。
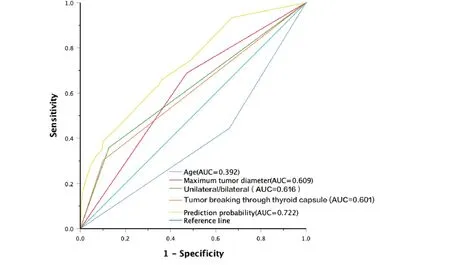
图1 独立危险因素联合预测颈部CCLN 转移的ROC 曲线Figure 1. ROC Curve of Independent Risk Factors Predicting Central Cervical Lymph Node Metastasis
3 讨 论
近年来PTC 的发病率逐年增高逐渐引起人们的密切关注,虽然大多数PTC 生长比较缓慢,患者的总体预后也较好,但颈部淋巴结出现转移较早[4-5],增加PTC 患者术后复发风险及降低生存率[6]。颈部CCLN 多为淋巴结转移的第一站,临床上经常出现查体及超声评估颈部淋巴结阴性(cN0)的患者行颈部CLND 的术后病理提示有淋巴结阳性。本次研究发现有颈部CCLN 转移者共106 例,发生率为31.6%,与褚永权等[7]的研究相似。虽然高分辨率超声检查已广泛应用于甲状腺及颈部淋巴结的筛查中,但由于甲状腺腺体的遮挡,气管旁和喉返神经周围及深部的淋巴结在超声检查下显示较困难,而且PTMC 的CCLN 通常直径较小,部分转移淋巴结缺少典型的转移超声图像改变、同时超声检查技术欠缺和超声检查医师的经验不同等,都使得超声诊断颈部淋巴结转移存在遗漏可能[8]。目前临床上缺乏直观指标术前来判断CCLN 转移的风险,因此,通过分析PTMC 患者CCLN 转移病例的临床特征和危险因素来筛选出高危患者,术前对颈部CCLN 转移危险因素的仔细评估,采取合适的治疗方案对改善患者的预后和预防复发转移至关重要。
目前关于cN0 的PTMC 患者预防性行CLND的指征和范围颇有争论,本研究对所有入组患者行单侧腺叶及峡部切除+同侧CLND,或行甲状腺全部切除+单侧/双侧CLND,术后出现暂时性声音嘶哑5 例(1.5%),有低钙血症出现手足面部麻木患者16 例(4.8%),术后3 个月内均恢复,未出现严重并发症。随着术者团队术中精细化解剖操作和手术经验的积累,术中在原切口下即刻可行颈部CLND,可尽可能减少再次手术时增加喉返神经及甲状旁腺被损伤的可能[9]。如条件许可下可协助使用神经检测仪和纳米碳甲状旁腺负显影技术减少喉返神经和甲状旁腺损伤的可能。
本研究单因素分析发现年龄≤45 岁、肿瘤直径>5 mm、双侧腺叶癌灶、单侧腺叶多灶、肿瘤突破甲状腺包膜和肿瘤呈浸润性生长等与PTMC 患者发生颈部CCLN 转移有关。本研究发现男性PTMC 患者有61 例(18.2%),发病率较低,但并未发现PTMC患者性别与CCLN 转移有关,与Yuan 等[10]研究相似,但邵长秀等[11]发现男性PTMC 患者发生CCLN转移率较高,这可能与研究样本例数较少有关。Liu等[12]分析966 例PTC 患者的临床特征,发现年龄≤45 岁是发生CCLN 转移的独立危险因素。本组研究也显示年龄≤45 岁的PTMC 患者发生CCLN转移率较高,提示年轻患者更容易出现淋巴结转移,这与儿童及青少年分化型甲状腺癌患者具有更高的淋巴结转移率、更多的远处转移[13]相符合。PTMC病灶的大小与淋巴结转移的关系较为明确,Zou等[14]认为直径5 mm 以上的甲状腺结节可能具有较高的侵袭性。本研究也发现>5 mm 的PTMC 患者CCLN 转移率显著多于≤5 mm 的患者(68.8%vs31.1%)。Feng 等[15]认为多灶性和双侧癌灶在PTC中具有更强的侵袭性特征,是复发风险的预测因素,复发风险随着肿瘤病灶数量的增加而增加。本研究单因素分析发现单侧腺叶多灶的PTMC 患者发生CCLN 转移较高,但经多因素非条件Logistic 回归分析单侧腺叶多灶并不能作为CCLN 转移的独立预测因素,这与Liu 等[16]对3 273 例PTC 患者的临床病理资料及CCLN 转移的危险因素总结的结果相似,这与甲状腺切除范围的差异有关,范围越广,获得额外多灶癌的机率越高。本研究经单因素和多因素分析均提示肿瘤突破甲状腺包膜是PTMC 出现CCLN 转移的概率较高,可作为独立的危险因素。与王亚军等[17]的研究结果相似。笔者术中发现肿瘤位于甲状腺边缘靠近包膜或者已经突破包膜,发生CCLN 转移者较多,可能因为在甲状腺内淋巴管网分布广泛,如肿瘤侵犯甲状腺包膜,增加CCLN 转移的机会[18]。如彩超显示肿瘤贴近甲状腺包膜处或是有包膜突起甚至连贯性缺失,手术应该采取更为积极的预防性CLND。本研究发现肿瘤位于腺体内的PTMC 患者的CCLN 转移率为28.2%,而肿瘤有腺体外侵犯的PTMC 患者CCLN 转移率高达54.5%。Liang 等[19]发现PTMC 患者的CCLN 转移与甲状腺外侵犯、多灶性有关。Ruiz Pardo 等[20]也证实PTMC 的多灶性和甲状腺肿瘤腺体外侵犯与淋巴结转移密切相关。对于术中探查发现肿瘤有腺体外侵犯者,建议行CLND[10]。本研究发现伴有桥本甲状腺炎的PTMC 患者约占20.9%,尚未发现是否伴有桥本甲状腺炎与CCLN 转移相关。
综上所述,结合术前甲状腺彩超和颈部增强CT检查结果,对不同的PTMC 患者而言,如合并年龄≤45 岁、肿瘤直径>5 mm、双侧腺叶癌灶及肿瘤突破甲状腺包膜者,以上独立危险因素联合预测颈部CCLN 转移的AUC 为0.722 >0.7,能够较好的预测PTMC 患者颈部CCLN 转移情况,临床上根据以上独立危险因素分析CCLN 转移的危险程度,采取预防性CLND,以减少肿瘤复发需再次手术的风险。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

