纳米银对小鼠H22 肝癌腹水瘤抑制作用的实验研究*
石皓,林倩,王毓兴,许玲,郑洋,俞红女
116000 辽宁 大连,大连大学附属新华医院 中心实验室(石皓、林倩、许玲,俞红女);571900 海口,澄迈县人民医院 重症医学科(王毓兴);116000 辽宁 大连,大连大学 医学院(郑洋)
腹水瘤是恶性肿瘤后期发生转移产生的常见并发症,确诊后患者的中位生存期仅有5.6 个月,反映了肿瘤的预后不良。产生癌性腹水的常见肿瘤类型包括肝癌、消化道肿瘤、乳腺癌以及卵巢癌等,其中50%以上会在肿瘤后期产生恶性腹水[1]。肿瘤后期的癌性腹水对大多数常见的化疗药物敏感性低,目前除了腹腔导管引流等治疗措施外,尚无良好的处理方式。然而这些手段也只能暂时缓解腹痛、腹胀、便秘及呼吸困难等症状,长期的效果并不理想,并且存在并发肠粘连、肠梗阻及腹腔感染的风险,影响生存时间及生存质量[2]。传统抗肿瘤药物治疗易产生耐药,同时伴随明显的药物副作用。因此,开发对腹水瘤及其原发肿瘤具有高效杀伤作用的药物,已成为当前亟需解决的难题。
金属纳米材料的应用是一种新兴的抗肿瘤手段,它克服了传统药物局部浓度低、非选择性弥散及副作用大等方面的缺陷。金属纳米材料自身带有磁性,可通过外界磁性设备对药物进行特异投送,较大的比表面积还有利于通过基团修饰提高药物的溶解度、增加肿瘤局部药物浓度及增强长期滞留效应等,对肿瘤细胞进行长时程、特异性杀伤。纳米材料的研究和使用,将为肿瘤疾病提供一种全新的诊疗方式[3-4]。作为研究热点之一,纳米银的抗菌作用已有一定研究[5],同时它还具有明显的抗肿瘤潜能[6],尤其是在乳腺癌及卵巢癌的研究中[7-8]。而对癌性腹水治疗作用的相关研究却鲜有报道,纳米银对癌性腹水疗效及机制的相关研究,将为后期合并恶性腹水的肿瘤耐药患者带来福音。
H22 肝癌腹水瘤模型是常用的癌性腹水研究模型,利用腹水瘤模型可观察药物对癌性腹水的疗效并研究其作用的分子机制。本实验旨在通过应用纳米银治疗昆明小鼠的H22 肝癌腹水瘤,探究纳米银对癌性腹水的疗效及其安全性。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及细胞株 SPF 级昆明小鼠,6~8周龄,体重18~22 g。购自辽宁长生生物技术股份有限公司,动物许可证编号:SCXK(辽)2020-0001。小鼠饲养于温度为20~25 ℃,湿度为40%~60 %的舒适环境中,自由饮水进食。实验经大连大学附属新华医院伦理委员会批准开展,并严格遵守实验动物伦理福利相关要求。H22 肝癌腹水瘤细胞购自上海中科院细胞库。
1.1.2 药品 纳米银(平均大小5 nm)由浙江三禾纳米科技有限公司提供,注射用顺铂(冻干型)购自齐鲁制药有限公司。
1.2 实验方法
1.2.1 细胞腹腔内传代 于昆明小鼠腹腔注射H22细胞悬液200 μL,1 周后处死小鼠并抽取腹水,离心(1 000 r/min, 5 min)收集细胞,再用生理盐水调整浓度至(1×106/mL),取200 μL 细胞悬液再次注射于小鼠腹腔。同样方式连续传代两次后,收集第三代细胞并调整至相应浓度,用于小鼠肝癌腹水瘤模型构建。1.2.2 小鼠H22 肝癌腹水瘤模型建立、分组及给药处理 将200 μL 的H22 细胞(1×106/mL)注射于昆明小鼠腹腔,建立小鼠肝癌腹水瘤模型。并将其随机分为模型组(等体积溶剂)、顺铂组(1 mg/kg)、纳米银低剂量组(0.5 mg/kg)、纳米银中剂量组(1 mg/kg)及纳米银高剂量组(2.5 mg/kg)5 组,每组8 只。24小时后,每天腹腔注射相应药物,连续给药12 天。
1.2.3 观察指标 每两天记录一次各组小鼠活动、饮食等一般状况,并测量其体重和腹围变化。终止用药后24 h,各组随机选取小鼠进行解剖,观察腹水生成情况。其余小鼠进行生存分析。
1.2.4 纳米银药物安全性分析 20 只健康昆明小鼠随机分为对照组(等体积溶剂)及纳米银高剂量组(2.5 mg/kg),每组10 只。每天腹腔注射给药,连续给药12 天。每2 天记录一次小鼠体重变化情况,终止用药后24 h 各组随机选取小鼠5 只,采用眼球摘除法采集小鼠血液样本,分别使用全自动血细胞分析仪、全自动生化分析仪检测其血常规指标及肝肾功能相关生化指标。其余小鼠进行生存分析。
1.3 统计学方法
应用统计学方法处理数据:应用SPSS 24.0 统计分析软件,对数据进行统计学分析,组间比较用LSD-t及SNK-t检验,多组间比较用方差分析,生存数据进行Kaplan-Meier 分析,数据以均数±标准差表示,P< 0.05 为差异具有统计学意义。
2 结 果
2.1 纳米银对小鼠腹水瘤的影响
2.1.1 一般状况 肝癌腹水瘤模型构建成功后,小鼠出现精神不佳、活动减少、进食减少、呼吸急促、腹部隆起、大便干结及肢体消瘦等情况。相较于模型组,顺铂组及纳米银高剂量组小鼠症状较轻且出现较晚。
2.1.2 体重变化 给药前各组小鼠体重无明显差异,第6 天起模型组小鼠体重明显增加。与模型组相比,顺铂组小鼠体重有降低趋势,纳米银高剂量组小鼠体重变化与顺铂组相比差异无统计学意义(P> 0.05;图1)。
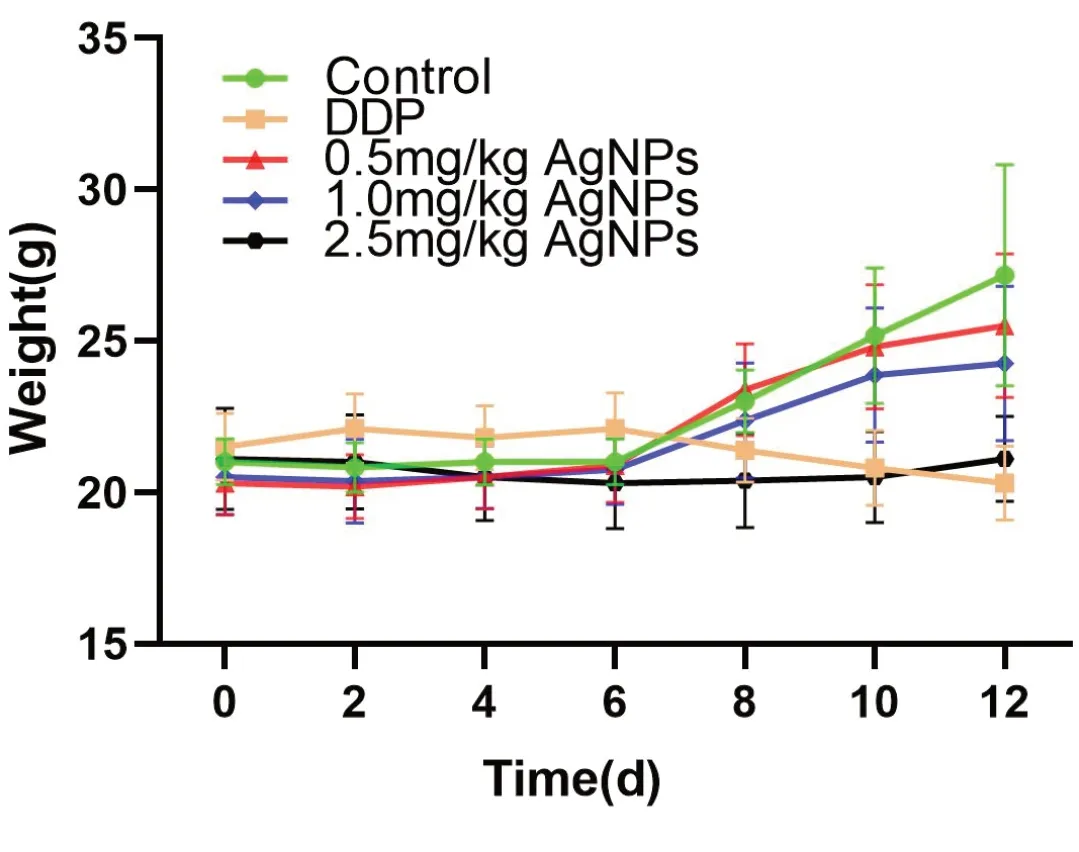
图1 给药期间各组小鼠体重变化(±s)Figure 1.Weight Variation in Each Group of Mice( ±s)
2.1.3 腹围变化及腹水生成情况 终止给药24 h后,各组随机选取小鼠解剖观察腹水生成情况,模型组小鼠腹腔可见大量腹水生成,纳米银组小鼠腹水量明显减少,呈剂量依赖性,纳米银高剂量组和顺铂组未见明显腹水生成(图2A)。与模型组相比,纳米银组小鼠腹围增加缓慢,纳米银高剂量组小鼠腹围变化与顺铂组相比差异无统计学意义(P> 0.05;图2B)。

图2 给药期间各组小鼠腹围变化及腹水生成情况Figure 2.Abdomen Circumference Variation and Ascites Formation in Each Group of Mice
2.1.4 生存分析 生存分析显示,与模型组小鼠相比,纳米银组小鼠生存期均有所延长,纳米银高剂量组生存与顺铂组相比差异无统计学意义(P> 0.05;图3)。

图3 各组小鼠生存分析Figure 3.Survival in Each Group of Mice
2.2 纳米银药物安全性分析
2.2.1 纳米银腹腔注射对健康小鼠体重及生存的影响 给药期间各组小鼠体重自然增长,纳米银高剂量组与对照组相比差异无统计学意义(P> 0.05;图4A)。生存分析显示,对照组及纳米银高剂量组小鼠均未出现死亡(图4B)。
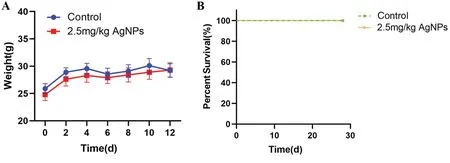
图4 纳米银腹腔注射对健康小鼠体重及生存的影响Figure 4.Effects of AgNPs Intraperitoneal Injection on Weight and Survive of Healthy Mice( ±s)
2.2.2 纳米银腹腔注射对健康小鼠血常规及生化的影响 终止给药24 h 后各组随机选取小鼠采血,检测血常规及生化各项指标。血常规结果显示,经腹腔注射给药后,纳米银高剂量组红细胞数量、血红蛋白浓度、血小板数量、白细胞数量、中性粒细胞百分比、淋巴细胞百分比及单核细胞百分比等各项指标与对照组相比均差异无统计学意义(P> 0.05;表1)。血生化结果显示,纳米银高剂量组小鼠血尿素氮、肌苷、白蛋白、谷丙转氨酶、谷草转氨酶及碱性磷酸酶值等各项生化指标与对照组相比均差异无统计学意义(P> 0.05;表2)。以上结果表明,纳米银腹腔注射对小鼠血常规及肝肾功能等无明显影响,2.5 mg/kg 腹腔注射为纳米银的安全治疗剂量。
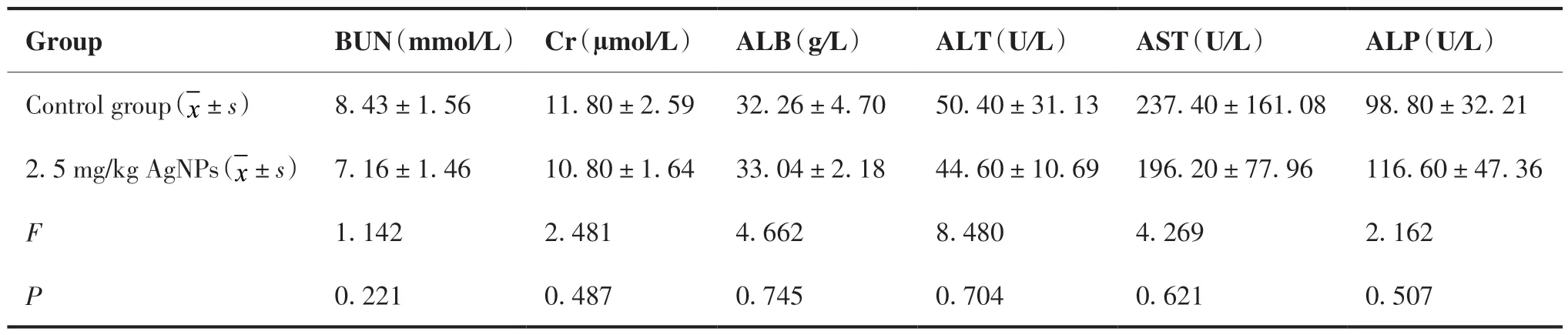
表2 纳米银腹腔注射对健康小鼠生化指标的影响Table 2.Effects of AgNPs Intraperitoneal Injection on Biochemical Indexes of Healthy Mice
3 讨 论
癌性腹水是多种恶性肿瘤后期的主要并发症之一,以腹痛及呼吸困难等为主要表现,最终因慢性消耗及恶病质而导致患者死亡[9]。本实验中模型组小鼠腹水生成后腹胀明显,进食减少,粪便干结,呼吸急促,精神不佳,活动减少,出现明显的肢体消瘦,同时体重、腹围明显增加,这与腹水瘤的进展明显相关。如前所述,作为恶性肿瘤后期发生腹腔转移的并发症,癌性腹水对放疗及多种化疗药物的敏感性明显降低且治疗副作用明显。因此,探索一种副作用小、敏感性高且不易耐药的新型抗肿瘤药物成为当前癌性腹水研究中的重中之重。
纳米银的抗菌作用已实现临床应用[5],此外,它还具有明显的抗肿瘤作用[6,10],有望成一种新型的抗肿瘤药物。本研究发现,与顺铂相比,纳米银可以有效抑制腹水瘤小鼠的腹水进展,缓解腹水瘤导致的腹胀、纳差、便秘及呼吸急促等症状,有效提高小鼠的生存质量并延长其生存时间。但其抗肿瘤的具体机制尚未明确,相关研究正不断完善。有研究表明,纳米银可通过诱导微核结构形成、染色体损伤及DNA 突变等抑制细胞周期及细胞增殖[10]。此外,它还能够通过损伤线粒体结构诱导氧化应激及活性氧的产生[11],损伤肿瘤细胞蛋白质和DNA[12],及增强肿瘤细胞自噬水平[13]等而诱导肿瘤细胞凋亡。并且,纳米银还可以通过调节细胞因子水平及促进细胞内活性氧的产生等激活免疫细胞并解除免疫微环境中肿瘤细胞对免疫细胞的抑制,增强免疫系统功能,对肿瘤实现特异性杀伤[14-15]。较高浓度下,纳米银还可导致细胞骨架和细胞膜的纳米结构破坏[16],引起细胞质渗漏、细胞器膜损伤、氧化应激损伤以及肿瘤蛋白质和DNA 结构破坏等,导致细胞坏死[17]。
纳米银使用中需要注意的是其重金属离子中毒的风险。有研究发现,静脉注射后,纳米银颗粒在肝、脾、肾及脑等器官中的分布呈剂量依赖性,且受材料本身大小、形状及表面电荷等理化性质等影响[18]。同时,通过在纳米银表面负载肿瘤特异性抗体或配体受体等化合物及乳糖等表面修饰,有助于提高其稳定性,增加肿瘤摄取率,有效靶向肿瘤以实现特异性杀伤,同时减少组织非特异性分布等所致的毒副作用[6]。还有研究者将纳米银作为靶向递送工具,利用纳米银负载凋亡诱导剂Raptinal,有效提升了早期肝细胞癌的治疗效果[19]。此外,优化给药方案,如调整给药方式(如腹腔注射)或联合用药等,也能够在降低毒副作用的基础上提高药物疗效。本研究采用腹腔注射给药的方式研究纳米银在肝癌腹水瘤治疗中的安全性,结果发现,与对照组相比,纳米银腹腔注射对小鼠血细胞水平、肝肾功能及体重等无明显影响,未见明显的毒副作用。
综上所述,我们的研究结果表明,纳米银可以有效抑制肝癌腹水瘤的生成以改善小鼠生存情况,同时避免了肿瘤化疗药物相关的体重减轻、白细胞减少及肝肾功能损害等不良反应,且未见明显毒副作用。本研究为纳米银在癌性腹水治疗中的潜在应用价值提供了一定的理论依据,但其发挥作用的具体机制仍有待阐明。深入探究纳米银对肝癌腹水瘤的作用机制,改良纳米银制备工艺并优化其给药方案,有望推动纳米银治疗肝癌腹水瘤等恶性肿瘤的临床研究工作进一步开展并最终发挥临床应用价值。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

