双重血浆分子吸附系统序贯半量血浆置换改善乙肝相关慢加急性肝衰竭患者的短期预后
吴承高 刘威 况林菊 刘强 熊伟 胡飘萍 张长林 乐爱平,
(南昌大学江西医学院南昌大学第一附属医院1.输血医学科;2.江西省输血医学重点实验室,江西 南昌 330006)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在慢性肝病基础上,短期内出现肝功能急性失代偿的临床综合征,主要特征为全身性炎症(systemic inflammatory response syndrome,SIRS)、器官衰竭和不良预后,病死率高达50%~90%[1-2]。与欧美等国家主要以药物、酗酒、手术创伤等引起的急性肝衰竭不同,我国80%以上肝衰竭是在慢性乙型肝炎(chronic hepatitis B,HBV)基础上发展而来的[3]。另据报道[4]我国有2 000~3 000 万人被诊断为慢性乙型肝炎,因此探讨乙肝相关慢加急性肝衰竭(HBV-ACLF)患者的有效治疗模式具有重要意义。
人工肝支持系统是治疗肝衰竭的有效方法之一,其通过1个体外的机械、理化和生物装置,清除体内各种有害物质,补充必需物质,改善内环境,暂时替代衰竭肝脏的部分功能,为肝细胞再生及肝功能恢复创造条件或等待机会进行肝移植[5,6]。人工肝支持系统分为非生物型、生物型和混合型3 种,非生物型人工肝已在临床广泛应用并被证明有一定疗效,主要包括血浆置换(plasma exchange,PE)、双重血浆分子吸附系统(double plasma molecular adsorption system,DPMAS)、分子吸附再循环系统(molecular absorbent recycling system,MARS)等。受限血浆供应紧张态势和对ACLF 病理生理的不断深入研究,目前DPMAS 序贯半量血浆置换(DPMAS+HPE)在临床上应用越来越广泛。DPMAS+HPE是利用中性大孔吸附树脂(HA330-Ⅱ)和离子交换树脂(BS330)2 个吸附柱连续吸附血浆,然后返回体内,并使用相对于PE 一半的血浆量进行血浆置换,不仅可以吸附胆红素、胆汁酸和中、大分子毒素并清除炎症介质,还可以补充凝血因子以减少出血风险。
现有研究[7-8]表明,PE 治疗能改善HBV-ACLF患者肝功能和提高短期生存率,但DPMAS+HPE治疗在改善HBV-ACLF 短期预后转归的疗效仍有待研究。本研究拟通过回顾性研究,比较单纯接受内科综合治疗和接受DPMAS+HPE 治疗的HBVACLF 患者肝功能改善情况及短期生存率差异,以探讨DPMAS+HPE对HBV-ACLF患者的治疗效果。
1.资料与方法
1.1 研究对象
本研究纳入的所有病例均来自队列研究(中国临床试验注册中心注册号:ChiCTR1800019690)。通过医院HIS 系统检索2015 年1 月1 日至2022 年12 月31 日在南昌大学第一附属医院治疗的HBVACLF住院患者。
1.1.1 病例纳入标准
1)HBV 感染(HBV 表面抗原阳性≥6 个月),肝功能异常史,伴或不伴肝硬化;2)符合《肝衰竭诊治指南(2018年版)》[9]慢加急性肝衰竭诊断标准。根据不同慢性肝病基础分为A 型、B 型、C 型;根据临床表现的严重程度,分为早期、中期和晚期,在未达到标准时为前期。
1.1.2 病例排除标准
1)合并有肝内外恶性肿瘤或严重慢性肝外疾病;2)年龄不满十八周岁或者八十周岁以上;3)住院期间或随访期限内行肝移植治疗;4)怀孕;5)HIV感染;6)实验室检测指标不全或失访。
1.2 数据收集
1.2.1 病例基本资料
从医院HIS 系统中检索入组病例的所有临床资料,包括人口统计学数据(年龄、性别)、患者肝硬化状态、ACLF分型、ACLF分期。
1.2.2 实验室检测指标
患者入院诊断ACLF 时的临床和实验室指标,治疗后资料选取出院前最近1次实验室指标,包括血红蛋白(Hb)、血小板计数(PLT)、白细胞(WBC)、中性粒细胞(NEU)、淋巴细胞(LYM)、血清钾(K+)、血清钠(Na+)、血清氯(Cl-)、血清钙(Ca2+)、凝血酶时间(TT)、凝血酶原时间(PT)、凝血酶原活动度(PTA)、活化部分凝血活酶时间(APTT)、纤维蛋白原(Fbg)、国际标准化比值(INR)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBil)、直接胆红素(DBil)、碱性磷酸酶(Alp)、总蛋白(TP)、白蛋白(Alb)、球蛋白(Glb)、白球比(A/G)、血肌酐(Cr)、血尿素氮(BUN)。
1.2.3 结局指标
终末期肝病模型(model for end-stage liver disease,MELD)评分按公式计算:MELD评分=[3.78×ln(TBil mg/dl)+11.20×ln(INR)+9.57×ln(Cr mg/dl)+6.43(胆汁性或酒精性为0,其他为1)]。随访时间为患者诊断HBV-ACLF 并开始治疗至治疗后30 d和90 d,结局事件为死亡。
1.3 治疗分组和治疗方案
1.3.1 治疗组
住院期间在内科综合治疗基础上接受1次DPMAS+HPE 的病例作为治疗组。DPMAS+HPE 具体操作方法:通过股静脉建立血管通路,外周循环通路预冲,肝素抗凝,术前盐酸异丙嗪25 mg肌注,并地塞米松5 mg静脉注射预防过敏。先采用血浆胆红素吸附器联合血液灌流器进行DPMAS 治疗,结束后序贯血浆置换,血浆置换量为1 500 mL,血浆血液流速120~150 mL/min,血浆分离速度25~33 mL/min。术后予以鱼精蛋白25 mg静脉推注。
1.3.2 对照组
住院期间单纯接受内科综合治疗的患者作为对照组。内科综合治疗[9]包括一般治疗、对症治疗和病因治疗,主要包括高热量饮食、肠内营养;纠正低蛋白血症、纠正水电解质和酸碱平衡、感染病例的抗感染治疗、限制蛋白质饮食;乳果糖、门冬氨酸鸟氨酸治疗肝性脑病、利尿剂和托伐普坦治疗腹水、维持动脉血压和限水治疗肝肾综合征以及肝肺综合征的氧疗。
1.4 统计学分析
计量资料以均数±标准差和中位数(四分位距)表示,比较用t检验或Mann-Whitney U 检验;计数资料以n(%)表示,比较采用χ2检验,当理论频数<5,改用Fisher 确切概率法。采用倾向性得分匹配(Propensity score matching,PSM)消除2组间的混杂偏倚:根据性别、年龄、ACLF 分型/分期、MELD 评分、Hb、PLT、血清钠(Na+)、PT、PTA、ALT、TBil、TP、Cr计算倾向性评分,采用最近邻1∶1匹配方案。采用多因素逻辑回归分析确定HBV-ACLF 患者的预后影响因素。Kaplan-Meier 生存曲线分析HBVACLF 患者30 d 和90 d 生存率。SPSS 24.0 软件(Chicago,USA)进行数据分析,GraphPad Prism软件8.0 版(San Diego,USA)用于绘图。P<0.05 为差异有统计学意义。
2 结果
2.1 病例基线资料
本研究共筛选3 635例诊断为重症肝炎或肝衰竭的病例,其中673例符合《肝衰竭诊治指南(2018年版)》ACLF诊断标准,排除非HBV感染病例(198例)和符合其他排除标准的病例(102 例),最终纳入373 例HBV-ACLF 病例,其中:A 型74 例、B 型235 例、C 型64 例;前期63 例、早期78 例、中期128例、晚期104例。如图1。
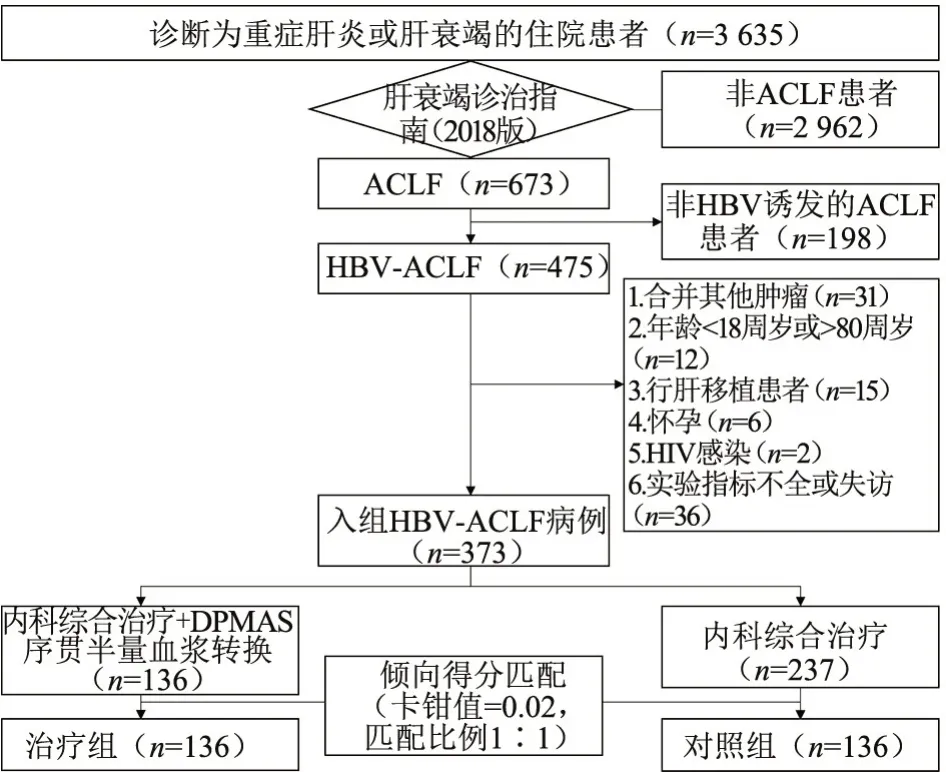
图1 病例筛选与分组流程图Figure 1 Flow chart of case screening and grouping
在373 名HBV-ACLF 患者中,305 名(81.77%)为男性;237 名HBV-ACLF 患者接受单纯内科综合治疗(对照组),136名患者在内科综合治疗基础上接受DPMAS+HPE 治疗(治疗组),见表1。2 组基线资料对比显示,ACLF分型、ACLF分期、Hb、AST、ALT、血清钠(Na+)、血清氯(Cl-)、APTT、Alb、INR、Cr、BUN存在显著差异(P<0.05)。经倾向得分匹配后,与对照组HBV-ACLF 患者比较,治疗组病例的AST 中位值较高(P<0.05),其他基线资料无显著性差异(P>0.05),见表1。

表1 HBV-ACLF患者临床基本资料Table 1 Clinical basic characteristics of HBV-ACLF patients
2.2 DPMAS+HPE 有效改善HBV-ACLF 患者肝功能
与对照组比较,治疗组经DPMAS+HPE治疗前后肝功能实验室指标:AST(P<0.01)和ALT(P<0.01)下降幅度显著大于对照组。此外,血清总蛋白(TP)治疗前后下降幅度明显大于对照组(P<0.05),见表2。
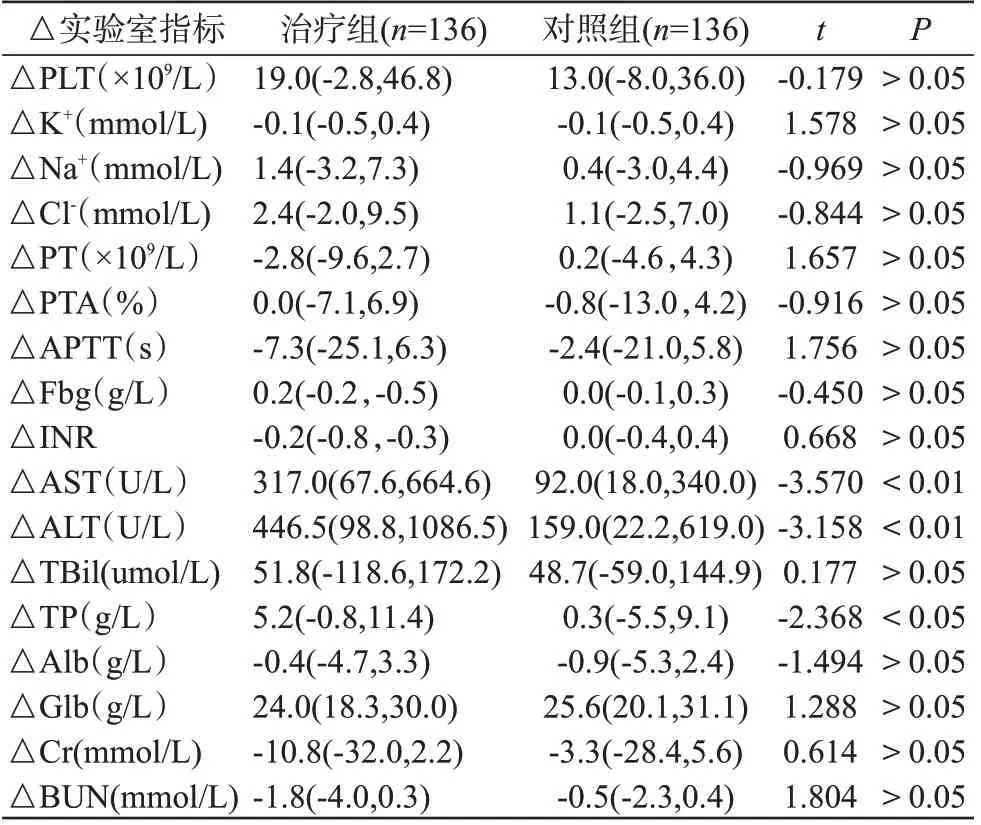
表2 HBV-ACLF患者治疗前后实验室指标改善情况Table 2 Improvement of laboratory indicators in HBVACLF patients after treatment
2.3 DPMAS+HPE是HBV-ACLF患者短期死亡的独立保护因素
多因素逻辑回归分析结果显示,ACLF 分期、MELD评分、ALT是30 d死亡的独立危险因素(OR=2.021,P<0.01;OR=0.973,P<0.05;OR=0.999,P<0.05),年龄、ACLF 分期是90 d 死亡的独立危险因素(OR=1.041,P<0.05;OR=1.893,P<0.05);DPMAS+HPE是患者短期预后的独立保护因素(30 d:OR=0.497,P<0.05;90 d:OR=0.436,P<0.05),见表3。
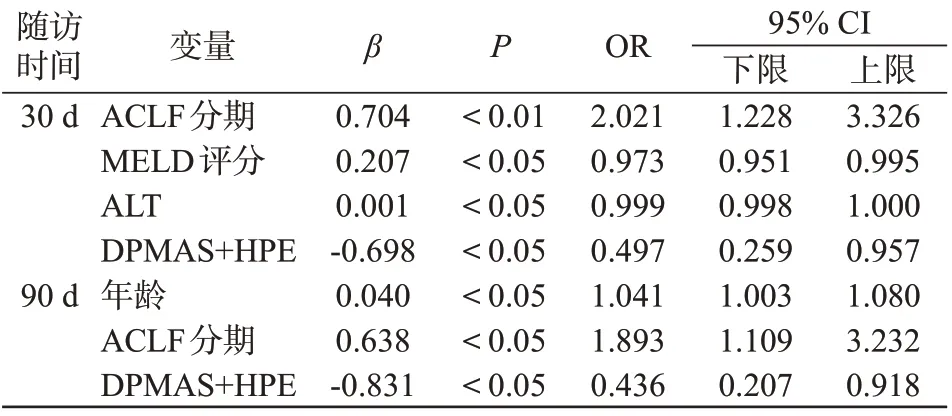
表3 HBV-ACLF患者30 d和90 d死亡影响因素Table 3 Influence factors on 30-day and 90-day mortality in HBV-ACLF patients
2.4 DPMAS+HPE 提高HBV-ACLF 患者短期生存率
Kaplan-Meier 生存分析显示:治疗组患者30 d累计生存率(50.71%,69/136)和90 d 累计生存率(30.15%,41/136)明显高于对照组30 d(44.12%,60/136)和90 d(22.79%,31/136),如图2。
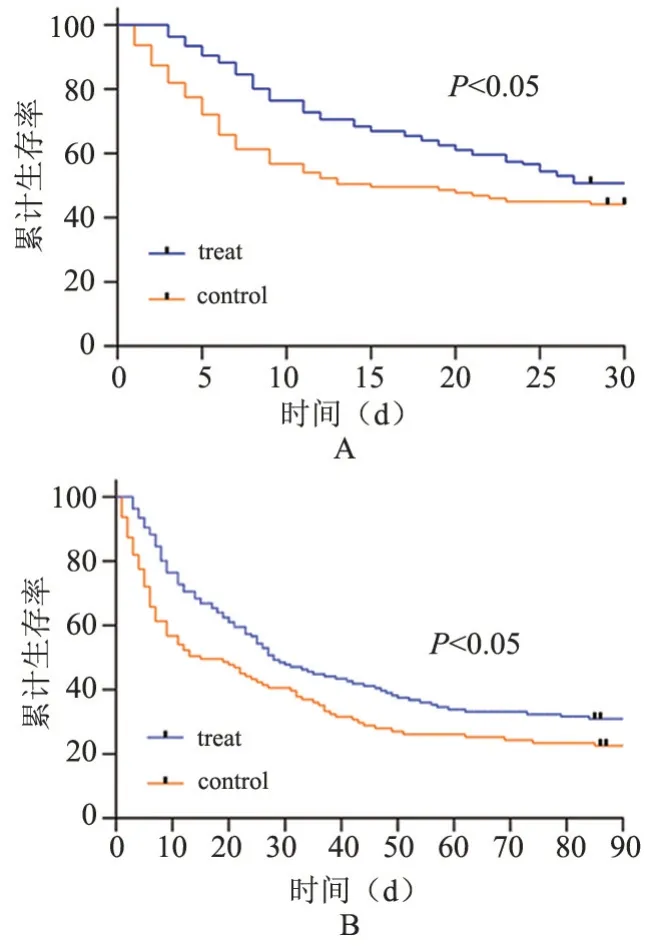
图2 治疗组和对照组患者生存曲线Figure 2 Survival curves of patients in the treatment and control groups
3 讨论
本研究对比了HBV-ACLF 患者住院治疗后实验室指标的变化,其中治疗组患者AST、ALT 下降幅度明显大于对照组,这与现有研究结论一致[10],提示DPMAS+HPE 能有效清除肝细胞损伤所释放的转氨酶。本研究结果显示,治疗组患者血清TP含量在接受DPMAS+HPE治疗后下降,下降幅度显著高于对照组,可能与DPMAS 在吸附胆红素的同时损耗白蛋白有关,国内外研究[11-12]也提示,DPMAS 可引起血浆白蛋白丢失及凝血酶原时间延长的不良反应。因此,当DPMAS 和PE 联用时,一般建议先行DPMAS 后序贯PE,可改善总蛋白减少和凝血紊乱的影响,减少并发症发生[13]。但本研究未观察到TBil、INR 明显下降,推测与本研究治疗组纳入的病例住院期间均只行1 次DPMAS+HPE 治疗有关。ACLF 患者因肝细胞损伤,其结合游离胆红素的能力下降,导致总胆红素不断积聚。国内1项多中心回顾性研究[14]结果也表明,以PE 为基础的人工肝治疗后,HBV-ACLF患者TBil有1个瞬时、显著的下降,但TBil 和INR 在没有后续PE 治疗的情况下会反弹到高水平。因此,在进行人工肝治疗之后建议监测TBil和INR等实验室指标,当其反弹时应适时再次进行人工肝治疗。
回归分析结果提示,ACLF 分期是HBV-ACLF患者30 d和90 d死亡的独立危险因素,分期越高患者生存率越低,这与现有研究结果一致[14]。ACLF中、晚期患者由于存在肝外器官衰竭和严重凝血功能障碍,常并发肝性脑病,尤其是晚期患者,因凝血功能明显异常和严重并发症死亡率高,人工肝治疗并发血流动力学紊乱和诱发肝性脑病的风险增加,应尽早进行肝移植治疗。
Larsen[7]对比了成分血浆分离吸附(frac-tional plasma separation and absorption,FPSA)、分子吸附再循环系统(MARS)和治疗性血浆置换(therapeutic plasma exchange,TPE)3 种人工肝模式,结果表明仅有TPE 能够提高ACLF 患者短期生存率。然而TPE 的血浆置换量1 次可达2 000~4 000 mL[15],血浆使用量大,血浆来源难以保障。本研究结果也显示DPMAS+HPE 是HBV-ACLF 患者30 d 和90 d死亡的独立保护因素。此外,相比内科综合治疗,DPMAS+HPE 能显著提高HBV-ACLF 患者30 d 和90 d 累计生存率。已有研究表明,DPMAS 序贯HPE的人工肝模式能充分发挥DPMAS对TBil的吸附作用,最大限度去除TBil[16],同时,PE能补充凝血因子,减少人工肝治疗过程中发生出血等不良反应[17],这可能是DPMAS+HPE 提高HBV-ACLF 患者短期生存率的主要因素。本研究观察到2 组患者治疗前后除ALT、AST 外,其他肝功能实验室指标下降幅度均无显著差异,但2组患者30 d和90 d累计生存率差异显著,提示DPMAS+HPE的人工肝模式在提高HBV-ACLF 患者短期生存率的疗效可能比实验室指标的改善更为显著[18]。
本研究病例数据来源于单中心,病例数量较少,在进行DPMAS+HPE对HBV-ACLF患者生存分析时,未将HBV-ACLF患者按照不同分期进行分层比较,以探讨HBV-ACLF 不同分期患者采用DPMAS+HPE 治疗的获益。另一方面,全身性炎症反应是HBV-ACLF的主要临床特征,1周内SIRS的发展是HBV-ACLF 患者预后的重要决定因素[19]。由于病例资料缺失值的存在,体现SIRS 的相关实验室指标如C-反应蛋白、白介素6 等未纳入观察,导致HBV-ACLF患者预后影响因素分析不够完善。以上不足将在进一步多中心大样本研究中予以完善。
综上所述,相比单纯内科综合治疗,DPMAS+HPE能提高HBV-ACLF患者短期生存率,其可作为1种有效治疗HBV-ACLF患者的人工肝模式。

