药用弹性体密封件中3种秋兰姆类硫化促进剂的定量分析与风险评估
夏双双,谢舒婷,陈 岚,王蓉佳,蔡 荣*
(1.上海理工大学 材料与化学学院,上海 200093;2.上海市食品药品包装材料测试所,上海 201203)
药用弹性体密封件具有密封性、化学稳定性好以及无生理毒性等优势,可以保护容器内制剂不受外部环境的影响。药用弹性体密封件的优良特性与其生产过程中加入的多种助剂(如增塑剂、填充剂、硫化促进剂、抗氧剂等)密不可分。秋兰姆类硫化促进剂是药用弹性体密封件生产过程中所添加的一类传统促进剂,具有提高硫化速率、降低硫化温度的作用[1]。动物毒理试验表明,秋兰姆类化合物会引起动物的肺部、心脏和其他器官畸变,且会对人体皮肤和黏膜产生刺激。根据文献报道,秋兰姆类硫化促进剂是一种过敏原,接触含秋兰姆类硫化促进剂的橡胶制品会使人产生皮炎、湿疹等症状[2-4]。与其他种类包装材料相比,药用弹性体密封件直接与制剂产品接触,容易产生浸出或吸附作用,从而影响制剂产品质量稳定性、安全性和有效性,因此需要对于药用弹性体密封件进行质量控制[5-6]。
关于秋兰姆类化合物含量的测定方法有气相色谱法、拉曼光谱法、高效液相色谱法和高效液相色谱-串联质谱法。气相色谱法是先将二硫化四甲基秋兰姆(TMTD)与盐酸反应生成CS2,继而采用气相色谱仪测定CS2的含量,但该方法易造成假阳性结果[7-8]。拉曼光谱法以有序介孔碳负载Au纳米颗粒作为基底,测定食品中TMTD的残留量,该方法的优点是分析时间短、灵敏度高,其不足是前处理复杂[9]。高效液相色谱法和高效液相色谱-串联质谱法也被广泛用于TMTD的检测[10-11]。上述方法更多是应用在果蔬和环境中TMTD残留量的测定,测定化合物较为单一。2018年我国食品药品监督管理局发布的《化学药品与弹性体密封件的相容性研究技术指导原则(试行)》将药品包装中的TMTD列为需重点关注的可提取物,但目前关于测定橡胶中多种秋兰姆类硫化促进剂含量的研究方法较少。鉴于此,本工作通过优化提取条件,提出了超高效液相色谱-串联质谱法同时测定药用弹性体密封件中TMTD、二硫化四乙基秋兰姆(TETD)和二硫化四丁基秋兰姆(TBTD)含量的方法,以期为药用弹性体密封件中秋兰姆类硫化促进剂含量的监控提供技术参考。此外,文献[12-13]报道含仲胺、叔胺结构的部分秋兰姆类硫化促进剂易与空气中或配合剂中的氮氧化合物反应生成可致癌的N-亚硝胺类化合物。针对这一情况,本工作模拟在酸性条件下,将上述3种秋兰姆类硫化促进剂与亚硝酸盐反应,分析反应产物中是否存在N-亚硝胺类化合物,从而对其进行风险评估。
1 试验部分
1.1 仪器与试剂
1290 InfinityⅡ型超高效液相色谱仪;6470型三重四极杆质谱仪;7890B型气相色谱仪,配热能分析器和Ellutia软件;XS205DU型电子分析天平;ME204型电子分析天平;SK5910LHC型超声波清洗机;Milli-Q型超纯水仪。
单标准储备溶液:取TMTD、TETD和TBTD对照品各10 mg,用甲醇溶解并定容至100 mL,配制成质量浓度均为100 mg·L-1的单标准储备溶液。
混合标准储备溶液:取TMTD、TBTD单标准储备溶液各3 mL及TETD单标准储备溶液2 mL,用甲醇稀释并定容至100 mL,混匀,配制成TETD质量浓度为2 mg·L-1,TMTD和TBTD质量浓度为3 mg·L-1的混合标准储备溶液。
混合标准溶液系列:取适量的混合标准储备溶液,用甲醇逐级稀释,配制成TETD质量浓度为4,10,40,100,200,300,400 μg·L-1,TMTD和TBTD质量浓度为6,15,60,150,300,450,600 μg·L-1的混合标准溶液系列,于4 ℃冰箱保存。
酸性亚硝酸钠溶液:取亚硝酸钠40 mg,用1 mol·L-1盐酸溶液溶解并定容至100 mL,配制成质量浓度为0.4 mg·mL-1的酸性亚硝酸钠溶液。
TMTD、TETD和TBTD对照品的纯度均大于98%;N-亚硝基-双异丙基胺(NDIPA)质量分数不小于98%;甲醇、二氯甲烷、乙腈均为色谱纯;氢氧化钠、氨水、甲酸、亚硝酸钠、盐酸均为分析纯;试验用水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
Eclipsepluse C18色谱柱(50 mm×3.0 mm,1.8 μm);柱温40 ℃;流动相A为0.1%(体积分数,下同)甲酸溶液,B为甲醇;流量0.25 mL·min-1;进样量2 μL。梯度洗脱程序:0~10 min时,A由20%升至100%,保持3 min;13~15 min,A由100%降至20%,保持5 min。
1.2.2 质谱条件
电喷雾离子(ESI)源,正离子(ESI+)模式;多反应监测(MRM)模式;喷雾压力310.26 kPa;干燥气温度300 ℃,干燥气流量5 L·min-1;鞘气温度300 ℃,鞘气流量11 L·min-1;毛细管电压4 000 V。其他质谱参数见表1,其中“*”代表定量离子。
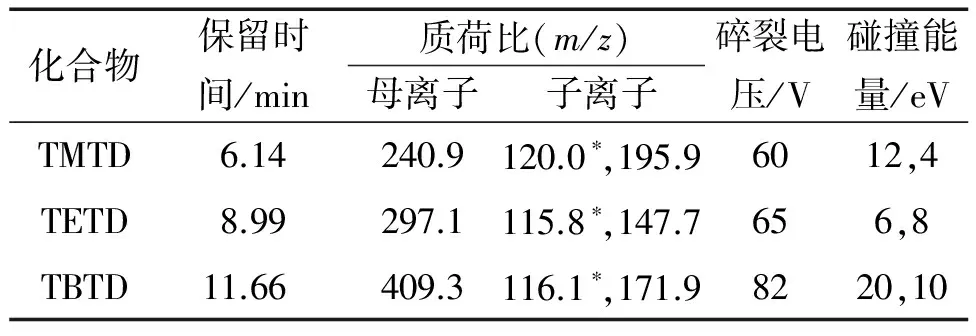
表1 质谱参数
1.3 试验方法
将样品剪成小碎块,称取1.00 g,置于顶空瓶中,加入甲醇10 mL,匝盖密封,于室温超声40 min。冷却至室温,用少量甲醇多次洗涤样品后,合并提取液和洗涤液,用甲醇定容至20 mL,混匀,经0.45 μm微孔滤膜过滤,滤液按照仪器工作条件进行测定。另取不含目标物的药用弹性体密封件,按照上述步骤制备空白提取液。
2 结果与讨论
2.1 色谱条件的选择
使用TETD质量浓度为100 μg·L-1,TMTD、TBTD质量浓度为150 μg·L-1的3种秋兰姆类硫化促进剂混合标准溶液进行测试,分别考察了甲醇-水、甲醇-0.1%甲酸溶液、乙腈-水和乙腈-0.1%甲酸溶液体系为流动相时对3种秋兰姆类硫化促进剂峰形和响应值的影响。结果表明:与水相比,采用0.1%甲酸溶液作为水相时,可减少拖尾现象,并且TMTD、TETD、TBTD的目标离子响应较强,这是由于秋兰姆类化合物含有氨基,呈弱碱性,在酸性条件下,经过ESI+模式充分电离后,形成带正电的目标离子;与乙腈相比,采用甲醇作为有机相时,3种秋兰姆类硫化促进剂响应值较高。因此,试验选择以甲醇-0.1%甲酸溶液体系作为流动相。
试验进一步考察了0.1%甲酸溶液和甲醇体积比分别为20…80,30…70,40…60,50…50时对3种秋兰姆类硫化促进剂峰形的影响。结果表明:相比于其他体积比,当以体积比20…80的0.1%甲酸溶液和甲醇的混合溶液洗脱时,目标物峰形较好。另外试验发现,采用该体积比等度洗脱时,TETD和TBTD的峰形较宽,且出峰时间较晚;换用梯度洗脱后,TETD和TBTD的峰形较好,TBTD保留时间由原来的37.82 min缩短至11.66 min,且其他2种秋兰姆类硫化促进剂的保留时间也稍有提前。因此,试验选择以甲醇-0.1%甲酸溶液体系作为流动相梯度洗脱分离3种秋兰姆类硫化促进剂,优化后的梯度洗脱程序见1.2节。
混合标准溶液的MRM色谱图见图1。
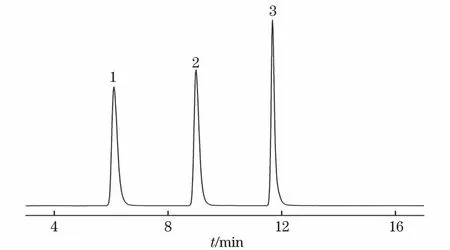
1-TMTD;2-TETD;3-TBTD图1 混合标准溶液的MRM色谱图Fig.1 MRM chromatogram of the mixed standard solution
2.2 质谱条件的选择
在ESI+和负离子(ESI-)模式下对质量浓度为1 mg·L-1的TMTD、TETD和TBTD单标准溶液分别进行全扫描,以选择合适的电离方式和分子离子峰。结果表明,TMTD、TETD和TBTD均更适合在ESI+模式下检测,这是由于3种秋兰姆类硫化促进剂的分子结构中均含有氮原子,易与H+结合,极性较强。在ESI+模式下对其进行一级质谱扫描,得到分子离子峰;然后再对分子离子进行二级质谱扫描,每组选择响应值较高且稳定的两个碎片离子分别作为定性离子和定量离子,并优化碎片离子的碎裂电压和碰撞能量,使碎片离子的响应值达到最高。最终优化的质谱参数见表1。
2.3 提取条件的选择
2.3.1 提取溶剂
由于目前关于药用包装弹性体密封件中秋兰姆类以及亚硝胺类化合物相容性研究较少,对提取溶剂的设计参考了相关指导原则[14-15]。提取溶剂通常具有与制剂相同或者相似的理化性质,重点考虑酸度、极性以及溶解度等。选择阴性胶塞作为空白基底,加入适量的混合标准溶液,分别考察了酸性提取溶剂(体积比800…200…1的水-甲醇-甲酸的混合溶液)、碱性提取溶剂(体积比800…200…1的水-甲醇-氨水的混合溶液)、乙腈(中性)、甲醇(强极性)和二氯甲烷(弱极性)对目标物回收率的影响,结果见图2。

1-二氯甲烷;2-酸性提取溶剂;3-碱性提取溶剂;4-乙腈;5-甲醇图2 提取溶剂对目标物回收率的影响Fig.2 Effect of the extraction solvent on the recoveries of targets
由图2可知:5种提取溶剂均可以提取3种目标物,且回收率均在80.0%以上;其中以甲醇提取的回收率相对更高。因此,试验选择以甲醇作为提取溶剂。
2.3.2 提取时间
超声可以加速样品中目标物的提取过程。选择阴性胶塞作为空白基底,加入适量的混合标准溶液,考察了提取时间分别为10,20,30,40,50 min时对目标物回收率的影响,结果见图3。

1-TMTD;2-TETD;3-TBTD图3 提取时间对目标物回收率的影响Fig.3 Effect of the extraction time on the recoveries of targets
由图3可知:3种目标物的回收率随着提取时间的延长逐渐升高;提取40 min时,回收率较高(95.0%左右);继续延长提取时间,虽然TMTD的回收率稍有上升,但TETD和TBTD的回收率有所降低,可能是超声时间过长,部分目标物被降解。因此,试验选择的提取时间为40 min。
进一步采用阳性胶塞样品对提取条件进行验证,即采用甲醇超声提取阳性胶塞样品两次,每次提取40 min。结果显示,第二次超声提取后,提取液中未检出目标物,表明以甲醇为提取溶剂超声40 min一次便可充分提取3种秋兰姆类硫化促进剂,该提取方法有效。
2.4 标准曲线、检出限和测定下限
按照仪器工作条件对混合标准溶液系列进行测定,以目标物的质量浓度为横坐标,对应的峰面积为纵坐标进行线性回归分析,线性参数见表2。
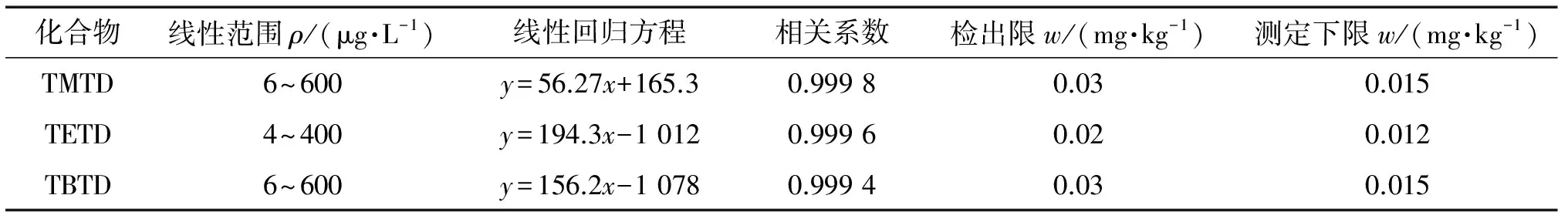
表2 线性参数、检出限和测定下限
在阴性样品中添加适量的混合标准溶液后,按照试验方法进样分析,分别以3倍和10倍信噪比(S/N)确定3种秋兰姆类硫化促进剂的检出限(3S/N)和测定下限(10S/N),结果见表2。
2.5 精密度和回收试验
按照试验方法对阴性样品进行3个浓度水平的加标回收试验,每个浓度水平平行测定6次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。

表3 精密度和回收试验结果(n=6)
由表3可知:3种秋兰姆类硫化促进剂的回收率为80.9%~103%,测定值的RSD为2.4%~6.3%,表明该方法具有较好的准确度和精密度,满足相关行业对秋兰姆类硫化促进剂的检测要求。
2.6 样品分析
按照试验方法对6批无菌注射剂用覆聚乙烯-四氟乙烯膜的丁基橡胶塞进行测定,其中有3批样品检测出TETD,检出量分别为2.55,2.00,1.86 mg·kg-1,TMTD和TBTD未检出,表明药用弹性体密封件中存在秋兰姆类硫化促进剂的残留污染。图4为某一批阳性样品的MRM色谱图。

图4 阳性样品的MRM色谱图Fig.4 MRM chromatogram of the positive sample
2.7 风险评估
取TMTD、TETD、TBTD单标准储备溶液各10 mL,各加入1 mL 0.4 mg·mL-1酸性亚硝酸钠溶液和9 mL水,混匀,于40 ℃水浴反应1 h,取出,冷却至室温,然后加入4 mL 1 mol·L-1氢氧化钠溶液,混匀,再加入10 mL含50 ng·mL-1NDIPA(内标)的二氯甲烷溶液,剧烈振荡1 min,静置分层,取下层溶液,按照本课题组提出的气相色谱-热能分析器测定N-亚硝胺类化合物含量的方法[16]进行分析,结果见图5(a)~(c);选取2.6节检出TETD的3批阳性样品,每批称取1.00 g小碎块,加入10 mL甲醇,超声提取40 min后,静置至室温,用少量甲醇多次洗涤样品后,合并提取液和洗涤液,用甲醇定容至20 mL,按照上述方法进行亚硝酸盐的反应试验,结果见图5(d)。
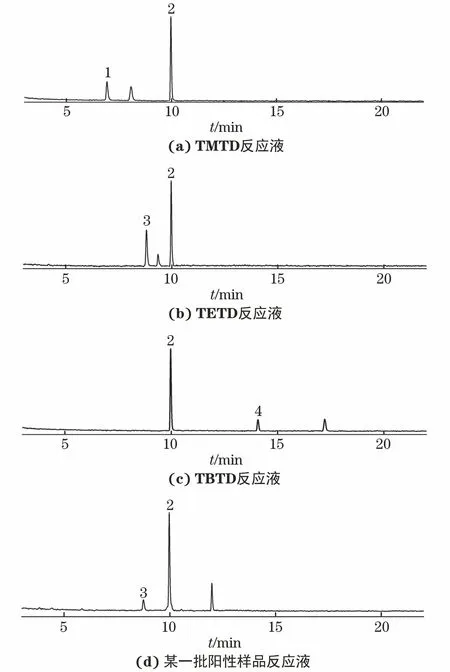
1-NDMA;2-NDIPA;3-NDEA;4-NDBA图5 N-亚硝胺类化合物的色谱图Fig.5 Chromatograms of N-nitrosamines
结果表明:TMTD反应液中检出N-亚硝基二甲胺(NDMA),检出量为11.03 μg·L-1;TETD反应液中检出N-亚硝基二乙胺(NDEA),检出量为19.76 μg·L-1;TBTD反应液中检出N-亚硝基二丁胺(NDBA),检出量为8.68 μg·L-1;3批阳性样品反应液中均检出NDEA,检出量分别为0.020 1,0.019 0,0.019 6 mg·kg-1。
国家标准GB/T 24153-2009《橡胶及弹性体材料N-亚硝基胺的测定》规定橡胶和弹性体材料中12种N-亚硝胺类化合物的质量分数不得超过0.5 mg·kg-1; 欧盟委员会93/11/EEC指令Com-missionDirective93/11/EECof15March1993ConcerningtheReleaseoftheN-NitrosaminesandN-NitrosatableSubstancesfromElastomerorRubberTeatsandSoothers规定了婴儿橡胶奶嘴及抚慰品中释放的N-亚硝胺类化合物的总质量分数应小于0.01 mg·kg-1,N-亚硝胺类化合物的残留量应小于0.1 mg·kg-1。因此,检出NDEA的3批药用弹性体密封件不符合法规规定,即为不合格产品。由此可见,含TMTD、TETD、TBTD的药用弹性体密封件产生N-亚硝胺类化合物的风险较高。建议企业在生产过程中应选用不产生N-亚硝胺类化合物的硫化促进剂,如二硫化四苄基秋兰姆、二硫化四异丁基秋兰姆来替代TMTD、TETD、TBTD。
本工作提出了超高效液相色谱-串联质谱法同时测定药用弹性体密封件中可生成N-亚硝胺类化合物的TMTD、TETD、TBTD等3种秋兰姆类硫化促进剂含量的方法,该方法前处理简单,灵敏度高,结果稳定、准确,适用于相关行业对高风险秋兰姆类硫化促进剂进行筛查测定。

