基于miR-155/TLR4/NF-κB信号轴探讨中医药治疗RA炎症的研究*
井维尧,杜小正△,方晓丽,张小娜,何文洁,刘 翠,袁 博
(1.甘肃中医药大学,兰州 730000;2.甘肃中医药大学附属医院,兰州 730000)
类风湿关节炎(rheumatoid arthritis, RA)是以关节滑膜炎症为主要病理特征的自身免疫疾病,发病具有进行性、致残性的特点,可并发多脏器侵害,严重危害人类健康[1]。RA全球发病率约为0.5%~1%,女性发病率高于男性[2]。其具体发病机制尚不明确,持续的滑膜炎症是导致RA病情发展的最主要因素。临床给予甲氨蝶呤、来氟米特、糖皮质激素等药物治疗可明显改善病情,延缓疾病进展,但长期用药不仅使患者产生耐受,也会对患者的循环系统、消化系统等造成损害[3]。中医药治疗RA具有一定的优势,而作用机制不明是目前限制中医药发展的难题。
Toll样受体(toll like receptor,TLR)4/核因子(nuclear factor,NF)-κB是RA炎症网络中经典的促炎通路之一,与血管翳、软骨破坏密切相关,该通路可激活下游信号转录白细胞介素(interleukin,IL)-1、IL-6[4]、基质金属蛋白酶(matrix metalloproteinase,MMP)-9[5]等炎症因子引发炎症级联反应及软骨破坏;并可上调B淋巴细胞瘤(B cell lymphoma, Bcl)-2、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)的表达增加成纤维样滑膜细胞(fibroblast like synoviocyte,FLS)的侵蚀和迁移能力,导致骨破坏加剧[6],同时还促进血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达[7],诱导血管翳生成。
小核糖核苷酸(microRNA,miR)-155可提升TLR4/NF-κB活性,且与RA炎症水平呈正相关[8]。研究表明,中医药治疗可通过调节miR-155水平[9]及TLR4/NF-κB通路活性[10]减轻RA炎症反应。整体调节、免疫调控是中医药的优势所在,通过miR-155调节免疫细胞分化及功能将是中医药今后的研究热点。故本文针对以上问题,较全面地总结了miR-155对免疫细胞的调控作用及调节TLR4/NF-κB活性促进RA炎症的关键机制,并基于该信号轴对中医药缓解RA炎症进行述评,为进一步研究提供思路。
1 miR-155可诱导免疫细胞分化,促使RA发病并增加炎症反应
miRNA约有22个核苷酸大小,由DNA转录剪切成初始miRNA后,再经Dicer酶剪切并解体而成。miRNA主要通过装配成RNA沉默复合体并通过碱基序列配对的方式结合mRNA的3 ’UTR区域来抑制mRNA的翻译。miR-155位于人类21号染色体B细胞非编码集合基因簇中的第3个外显子中,成熟的miR-155的单链序列为5 ’-UUAAUGCUAAUCGUGAUAGGGG-3 ’,miR-155广泛表达于免疫细胞中,可调控免疫细胞的发育、分化过程,与RA发病相关。
1.1 调节T细胞的分化及免疫耐受
Zhang等[11]研究发现miR-155可调控CD4+T细胞对调节性T细胞(regulatory T cell,Treg)介导的免疫抑制的敏感性,在Treg介导的免疫耐受过程发挥重要调节作用。此外,miR-155对于Th17细胞的分化也有明显调控作用,miR-155缺乏的CD4+T细胞中DNA结合蛋白Jarid2表达上调,Jarid2可招募多硫抑制复合物(polycomb repressive complex,Prc)2至染色质中并增加其与H3K27组蛋白的甲基化结合,进而抑制Th17的分化。miR-155亦可通过靶向JAK激酶(janus kinase,JAK)/信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)通路调节Treg/Th17的平衡,并增加IL-17的产生,促进RA炎症的发展[12]。相关转录因子与miRNA的相互作用是RA患者中Treg/Th17失衡的重要因素,miR-155与smad3、smad4、STAT3等转录因子均有密切关系,其表达的升高将抑制Treg分化,加重RA炎症反应[13]。miR-155高表达的CD4+T细胞则优先分化为Th1细胞,而Th1/Th2细胞的失衡也是介导RA的重要原因之一[14]。
1.2 诱导巨噬细胞分化
巨噬细胞(macrophages,Mø)1型有抗感染作用,但比例过高易引起炎症反应及免疫损伤。miR-155有诱导M1极化、抑制M2极化、促进巨噬细胞炎性反应的功能[15]。研究发现RA患者体内M1型细胞比例高于常人,并可通过诱导破骨细胞分化加重软骨破坏[16]。Jablonski等[17]发现,M1型巨噬细胞在脂多糖(lipopolysaccharide,LPS)联合干扰素(interferon,IFN)-γ刺激后,miR-155水平迅速上升并促使M1巨噬细胞分泌大量IL-1β、一氧化氮合酶(inducible NOS,iNOS)、肿瘤坏死因子(tumor necrosis factor,TNF)-α等炎症因子,而敲除miR-155后,M1对LPS联合IFN-γ刺激的反应能力下降了72%。骨关节炎研究发现,关节滑膜液中miR-155高表达可诱导M1的极化,并通过靶向半胱天冬氨酸蛋白酶(cysteine-aspartic acid protease,Caspase)-3减少巨噬细胞凋亡,加剧骨关节炎中的骨破坏进程[18]。
1.3 介导树突状细胞引发自身免疫反应
miR-155可通过靶向转录因子mafb促使单核细胞向树突状细胞(dendritic cells,DC)分化,使用miR-155拮抗剂可上调mafb表达,抑制DC细胞分化,miR-155同样是TNF-α诱导DC形成的关键[19]。DC细胞与T细胞的相互作用是自身免疫疾病产生的基础,Wehr等[20]发现,早期RA患者滑膜组织中DC细胞向T细胞发生聚集。而miR-155可抑制DC细胞内SH2结构域肌醇-5-磷酸酶(SH2 domain-containing inositol 5'-phosphatase,SHIP)1的表达水平,进而影响DC细胞的免疫耐受程度,并增加炎症因子的产生,而DC内高表达的miR-155可破坏体内自身免疫耐受水平并促进CD8介导的自身免疫反应[21-22]。
1.4 调节B细胞免疫能力
miR-155缺失的小鼠生发中心B细胞数量减少,免疫反应性以及免疫球蛋白抗体G1产生减少,导致免疫功能低下[23]。Alivernini等[24]发现,miR-155在RA患者滑膜组织B细胞中高表达,其通过抑制B细胞中转录因子PU.1的表达促使B细胞抗体分泌,可介导自身免疫反应,而抑制miR-155的表达可使PU.1表达上调,并抑制B细胞受体交联诱导的抗体产生。
临床研究显示miR-155与RA患者关节疼痛、肿胀程度及炎症因子IL-1β、IL-6、IL-17水平呈正相关[25]。实验表明,miR-155过表达的RA滑膜组织CD14+细胞可通过靶向抑制SHIP1的水平以上调TNF-α、IL-6、IL-1β、IL-8等促炎因子的表达,并且减少了IL-10等抑炎因子的分泌,使用miR-155抑制剂可显著减少TNF-α的产生,并可抑制LPS诱导的炎症反应,而miR-155缺乏的小鼠可抵抗胶原诱导的关节炎症,对自身免疫反应具有抑制性[21]。
2 TLR4/NF-κB是miR-155加重RA炎症反应的关键通路
TLR4/NF-κB通路是经典的RA炎症通路之一。而miR-155可通过靶向细胞因子信号传导抑制蛋白(suppressor of cytokine signaling, SOCS)1、SHIP1等细胞因子促进该通路激活,介导炎症反应。
2.1 miR-155靶向SOCS1增加TLR4/NF-κB通路活性
双荧光素酶报告基因检测发现miR-155可与SOCS1 3 ’UTR区域结合,实验发现高表达miR-155小鼠模型中SOCS1的蛋白水平显著下调,miR-155可靶向SOCS1来促进TLR/NF-κB的激活,增加了IL-6、TNF-α的产生并加重了小鼠肝脏缺血再灌注的炎症损伤[26]。SOCS1是JAK/STAT信号通路的经典抑制分子,具有抗炎的作用,而JAK/STAT作为细胞炎症通路之一,其磷酸化的过程可将丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)、磷脂酰肌醇-3-激酶(phosphatidyl inositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,PKB又称AKT)、TLR4/NF-κB等信号通路联系在一起,共同调节炎症过程。另外,LPS诱导免疫炎症主要由TLR4信号通路所介导,而研究证实SOCS1缺陷小鼠对LPS的耐受能力下降,并且敲除SOCS1的巨噬细胞在LPS刺激时会引起更多的核因子κB抑制蛋白(inhibitor of nuclear factor kappa-B,IκB)磷酸化[27]。相反,强制表达SOCS1可抵抗LPS诱导的NF-κB的核移位,SOCS1有抑制TLR4/NF-κB通路来减轻炎症反应的作用。相关研究发现SOCS1可与TLR4转导分子Toll/白介素-1受体(toll/interleukin-1 receptor,TIR)相结合,在TLR4信号通路激活过程中直接起到负调控的作用,转导分子白细胞介素-1受体相关激酶(interleukin-1 receptor associated kinase,IRAK)也是SOCS1的靶标之一,SOCS1通过SH2结构域与IRAK直接相联,可抑制IRAK的激活过程[28-29]。SOCS1还可靶向TLR4下游NF-κB P65以抑制其核转位,并且可通过泛素化作用介导p65的降解,减少炎症因子的转录[30]。综合研究提示SOCS1可抑制TLR4/NF-κB介导的炎症反应,而miR-155可靶向SOCS1减少其抑制作用。
2.2 miR-155靶向SHIP1促使NF-κB核移位
miR-155可调控慢性炎症的发展,使用miR-155海绵可减轻炎症反应以及NF-κB的活化,miR-155海绵的抗炎机制与其靶点SHIP1有关[31]。O'Connell等[32]发现,巨噬细胞在LPS刺激后SHIP1的表达增加,高表达SHIP1可以阻断TLR4与髓样分化因子(myeloid differentiation factor,Myd)88的转导并抑制多通路的激活以及IκB的降解。虽然SHIP1可阻断PI3K/AKT通路的活化来抑制炎症发展,且肿瘤坏死因子相关受体(tumor necrosis factor receptor associated factor,TRAF)6也可通过激活PI3K/AKT信号通路激活核因子κB激酶抑制剂(inhibitor of nuclear factor kappa-B kinase,IKK)引起P65核转移[33],但An[34]等人对LPS刺激的巨噬细胞使用PI3K通路抑制剂LY294002处理,其SHIP1高表达后仍可抑制巨噬细胞炎症因子产生,且PI3K抑制剂不能显著阻断SHIP1对NF-κB磷酸化的抑制作用,证明TLR4/NF-κB通路在SHIP1的抑炎作用中具有关键作用。
miR-155靶向SOCS1、SHIP1后,降低了两种炎症通路负向调控因子的转录,以此增加了TLR4/NF-κB通路活性,加重了RA炎症反应,见图1。
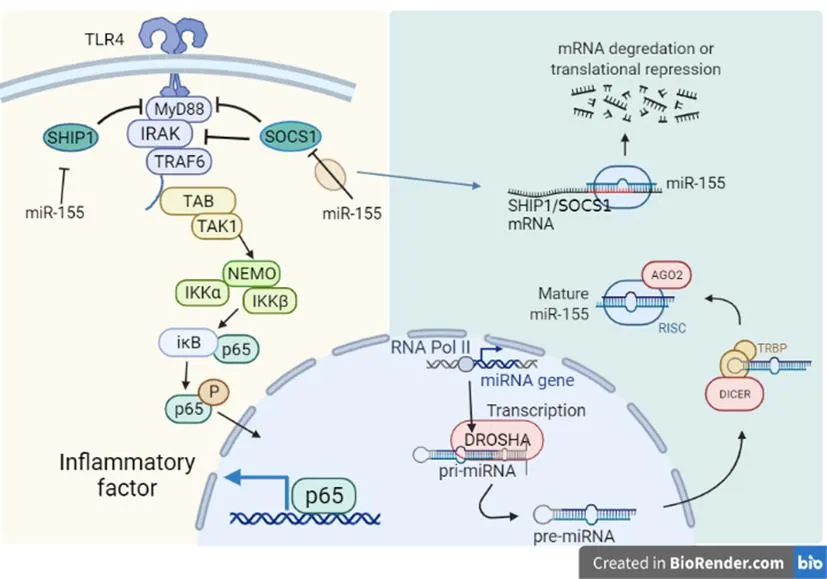
图1 miR-155抑制SHIP1、SOCS1促进TLR4/NF-κB的激活
3 miR-155/TLR4/NF-κB信号轴在中医药治疗RA中的重要作用
临床研究提示中药复方[35]、针灸[36]等治疗RA疗效明确,可延缓病情发展,减轻炎症反应。但中医药基础研究薄弱,是阻挠其发展的关键,明确中医药治疗RA的具体分子机制可为中医药的发展提供坚实的理论基础,同时有利于中医药成果的转化。
中药复方含有多种有效成分,在机体中共同作用,具有多靶点,整体调节的优势。而miRNA调控网络有类似于中药复方调节的特点,或可揭示复方治疗RA的关键机制。赵晶晶等[37]基于网络药理学探讨桃红四物汤治疗RA的内在机制,KEGG分析显示其作用机制与TLR及NF-κB通路密切相关,为经方研究提供了思路。韩隆胤等[38]研究显示,断藤益母汤可抑制LPS诱导的RA患者软骨细胞中IKK、IκBα及NF-κB蛋白的磷酸化,减少IL-6、MMP-9的产生,对软骨破坏起到保护作用。靖卫霞等[39]探究化瘀通络方对CIA大鼠滑膜炎症的改善作用,治疗结束后CIA大鼠滑膜病理评分及滑膜微血管记数均有明显下降,且血清中miR-155、IFN-γ、IL-2水平均有减少,并可增加IL-10、IL-4等抑炎因子的表达。柳庆坤等[40]探究复方追风透骨胶囊对RA大鼠的治疗机制,证实其可通过下调miR-155及转化生长因子(transforming growth factor,TGF)-β1的水平改善RA大鼠关节炎症及肿胀程度,但下游机制还需进一步探索。同时,王慧莲等[41]临床试验探究宣痹汤对RA患者的治疗作用,患者经治疗后红细胞沉降量(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)水平较前明显下降,且患者血清血栓素(thromboxane,TX)B2、血小板α-颗粒膜蛋白(α-granule membrane protein,GMP140)、TNF-α、IL-17、IKKβ、NF-κB p65、miR-155等水平均有明显下调,表明宣痹汤改善RA患者血液高凝状态的机制与下调miR-155/NF-κB通路有关。
研究发现,黄芪有效成分黄芪甲苷可抑制RA-FLS的增殖活力,并减少IL-6的产生,其机制与下调c-Jun氨基末端激酶(c-jun N-terminal kinase,JNK)通路有关[42],而JNK是TLR4/NF-κB通路中重要的蛋白激酶之一,在血管炎症的研究中,黄芪甲苷可通过抑制TLR4/NF-κB通路缓解炎症反应[43]。
针灸作为中医重要组成部分,临床治疗RA安全有效,Meta分析指出艾灸联合西药可明显改善患者症状,降低活动度[44]。实验研究证实艾灸干预RA家兔可降低孤核受体(retinoid relate dorphan receptor,ROR) γt 的mRNA表达,减少IL-17产生,可能对体内Th17/Treg平衡起到调节作用[45]。同样,使用艾灸干预佐剂性关节炎大鼠可减轻其后肢肿胀程度及滑膜的炎性浸润,并减少滑膜组织中IL-1、TNF-α的水平;还可减少MyD88、TLR4、NF-κB p65、IkBa mRNA的表达,表明TLR4/NF-κB通路在艾灸抑炎机制中有关键作用[46]。朱艳等[47]进一步实验指出,艾灸大鼠“足三里”“肾俞”等穴位不仅可降低TLR4/NF-κB通路的活性,还可下调miR-155的表达。临床应用针刺治疗RA则可降低患者RF、ESR、CRP水平[48],减轻患者疼痛及膝关节肿胀,针刺机制研究指出激活TLR4受体可能是针灸效应的关键启动过程[49]。还有研究表明电针干预CIA大鼠可下调TLR4/NF-κB通路活性,减轻炎症反应及足趾肿胀程度,而进一步从转录组学角度探究针刺治疗的分子机制或可为相关研究提供广阔的前景[50]。
4 结语与展望
miR-155可调节多种免疫细胞的分化及功能,高表达的miR-155能促进巨噬细胞M1极化、破坏Treg/Th17平衡、诱导B细胞产生自身抗体,故miR-155在诱导RA发病及促进炎症方面有关键作用。而miR-155通过抑制SOCS1及SHIP1的表达促进TLR4/NF-κB通路的激活,放大炎症反应则是滑膜炎症持续的关键因素。中医药治疗RA疗效显著,可减轻炎症反应,内在机制与miR-155/TLR4/NF-κB信号轴活性密切相关。本文通过综述中医药的研究发现,该信号轴在RA及中医药中的研究尚不完全,未来可从本信号轴调节免疫细胞分化角度进行探究。此外,NF-κB通路除介导炎症外还参与氧化应激反应及物质代谢过程,这些与RA均存在密切联系[51-52],但目前在该方面研究较少。综上,miR-155/TLR4/NF-κB信号轴具有较大的挖掘价值,可为中医药的基础研究提供新思路。

