黄百香果茎段组培快繁技术研究
刘洁云,张英俊,牟海飞,吴艳艳,黄伟华,田青兰,韦毅刚,温 放
(1 广西壮族自治区农业科学院,南宁,530007;2 广西壮族自治区/中国科学院广西植物研究所,广西桂林,541006)
百香果Passifloraedulis,又名鸡蛋果,是西番莲科西番莲属多年生常绿藤本植物,原产于美洲,现广泛种植于热带亚热带地区,在我国广西、广东、云南、贵州、福建和台湾等省(区)均有种植。百香果富含维生素及矿质元素,含有酚类、黄酮苷类、三萜类、生物碱等化学成分,具有神经保护作用、抗氧化、抗菌活性等功效[1-2]。百香果含有近百种香气成分,有“香料水果”“果汁之王”的美誉,果实多用于果汁、果酒等饮品的加工[3-4]。近年来随着我国消费者对百香果的认可,鲜食市场和加工市场对百香果的需求量持续攀升,推动百香果种植面积不断扩大。
当前生产上栽培面积较大的百香果根据果皮颜色可分为紫果类和黄果类。黄果类百香果又名黄百香果、黄果西番莲,根据果实大小可分为大果型和小果型。小果型黄百香果,俗称小黄金,单果质量80~120 g,果皮金黄色,果肉可溶性糖含量较高,口感香甜,深受消费者喜爱,在各地的栽培面积逐年扩增,生产上种苗需求量大。黄百香果种苗繁殖方式主要有种子播种、藤蔓扦插、接穗嫁接3种,组培快繁技术尚未大面积应用于生产。组织培养法可对植株进行脱毒,克服无性繁殖率低、繁殖速度慢等缺点,而且组织培养在室内进行,不受季节和气候等因素制约,具有便于集约化管理和工厂化生产的优点。近年来,已有学者对百香果组织培养进行研究,以黄百香果为研究材料的相对较少。Tran Hieu等[5]研究不同培养基对黄百香果茎段纵向薄细胞层不定芽诱导,以及瓶内嫁接苗继代增殖、生根的影响;赵家桔等[6]以黄金百香果茎尖为试材,从外植体消毒、初代培养、继代增殖、生根培养、炼苗移栽等5个方面研究适宜的组织培养方案;黄东梅等[7]以经水培扦插预处理的黄百香果幼嫩茎段作为外植体,筛选灭菌剂处理组合,以及芽诱导和生根培养基中的植物生长调节剂组合;董丽兰等[8]以紫果西番莲茎段、叶片、叶柄为外植体,进行愈伤组织诱导与分化,以及不定芽继代增殖、生根等研究,发现不同百香果种类、培养部位的适宜培养基配方存在差异。本试验以小果型黄百香果茎段为试材,筛选适宜的外植体消毒方案,以及初代培养、继代增殖、生根诱导培养基配方,为百香果组培苗繁育提供技术支撑。
1 材料与方法
1.1 材料
本团队自主选育的小果型黄百香果品系MB供试,在广西农业科学院生物技术研究所试验大棚内,将其扦插苗种植于直径20 cm、高17 cm的无纺布种植袋,用于外植体取材。
1.2 方法
1.2.1 茎段外植体消毒灭菌时间
取苗木茎尖至7~8节位的枝条,剪去叶片,在多菌灵500倍液中浸泡10 min,流水冲洗30 min;将枝条剪成长3~4 cm小段放置于广口瓶中,在超净工作台上用0.1%HgCl2(加吐温80 1~2滴)浸泡,浸泡时间分别设置2、4、6、8、10 min,处理后用无菌水冲洗4次;切除茎段两端0.2~0.3 cm,接入MS培养基中,每瓶接种茎段1个,每个处理20瓶,重复3次,培养20 d后统计污染率、褐化死亡率和成活率。
1.2.2 初代芽诱导培养
以MS+蔗糖30 g/L+琼脂5 g/L为基本培养基,分别添加不同浓度的6-苄氨基嘌呤(6-BA)、吲哚丁酸(IBA)、抗坏血酸,采用L16(43)正交试验设计(见表1)筛选适宜的初代培养基配方。选择成活率最高的消毒灭菌方案对茎段处理后,将茎段接入芽诱导初代培养基中,每瓶接种茎段1个,每个处理30瓶,重复3次,培养30 d后统计芽诱导率。
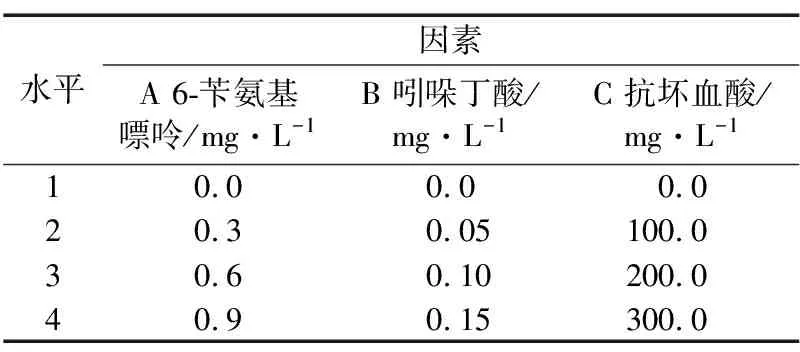
表1 黄百香果茎段初代芽诱导培养基筛选L16(43)正交试验设计
1.2.3 继代增殖培养
以MS+蔗糖30 g/L+琼脂5 g/L为基本培养基,6-苄氨基嘌呤浓度设置为0.1、0.2、0.3 mg/L,吲哚丁酸浓度设置为0、0.01、0.03、0.05 mg/L,两种植物生长调节剂组合处理,筛选出增殖倍数最高的培养基配方。在筛选配方中添加谷氨酸,浓度设置为0、10、20、30、40、50 mg/L。将初代培养诱导出的不定芽转接至继代增殖培养基中,每瓶接种芽6个,每个处理20瓶,重复3次,培养30 d后统计增殖倍数,观察继代苗生长情况。
1.2.4 生根培养及移栽
以1/2 MS+蔗糖30 g/L+琼脂5 g/L为基本培养基,采用吲哚-3-乙酸(IAA)、吲哚丁酸、萘乙酸(NAA)3种植物生长调节剂分别处理,浓度均设置为0、0.2、0.5 mg/L。将继代苗转接至生根培养基中,每瓶接种4株,每个处理20瓶,重复3次,培养40 d后观察根生长情况,统计生根率。将3种植物生长调节剂诱导生根效果较好的生根苗炼苗后,分别移栽至泥炭土∶珍珠岩为4∶1的育苗基质中,每个处理移栽20株,重复3次,统计各生根培养基的生根苗移栽成活率。
1.2.5 培养条件
培养基pH值均为5.8,培养室温度为(26±2) ℃,光照强度1 500~2 000 lx,光照时长12 h/d。
1.3 数据处理与分析
污染率(%)=污染茎段数/接种茎段数×100,褐化死亡率(%)=褐化死亡茎段数/接种茎段数×100,成活率(%)=100-污染率-褐化死亡率,芽诱导率(%)=出芽茎段数/成活茎段数×100,增殖倍数=新出茎段节数/接种茎段节数,生根率(%)=生根苗数/接种苗数×100,移栽成活率(%)=成活苗数/移栽苗数×100。采用Excel软件处理数据,采用DPS软件进行数据方差分析。
2 结果与分析
2.1 灭菌时间对茎段外植体的影响
由表2可知,随着0.1%HgCl2处理时间延长,茎段外植体的污染率降低,褐化死亡率升高,成活率呈先升高后降低趋势。HgCl2处理2 min的污染率最高,显著高于其他处理;处理10 min的污染率最低,但与处理6、8 min差异不显著。HgCl2处理2 min的褐化死亡率最低,与处理4、6 min差异不显著;处理10 min的褐化死亡率最高,显著高于其他处理。HgCl2处理2 min的茎段外植体成活率最低,显著低于其他处理;处理6 min的成活率最高,为66.67%,显著高于其他处理。可见,0.1%HgCl2处理6 min对茎段外植体的灭菌效果最佳。

表2 灭菌时间对黄百香果茎段外植体的影响
2.2 不同培养基配方对茎段芽诱导的影响
由表3和图1可知,不同培养基配方对黄百香果茎段芽诱导率存在较大影响。各因素的R值排序从高到低依次为A(60.33)>B(13.44)>C(11.10),说明6-苄氨基嘌呤浓度对茎段芽诱导率的影响最大,吲哚丁酸浓度次之,抗坏血酸浓度影响最小。根据不同因素的K值可知,最佳培养基配方为A2B3C3,但该培养基配方未出现在正交设计表中。表3中培养基配方A2B3C4的平均芽诱导率最高,为79.14%。可见,MS+6-苄氨基嘌呤0.3 mg/L+吲哚丁酸0.1 mg/L+抗坏血酸300 mg/L为本试验中黄百香果茎段芽诱导的最佳培养基配方。

图1 黄百香果茎段芽诱导、继代增殖最佳处理、组培生根苗移栽及不同植物生长调节剂处理生根情况
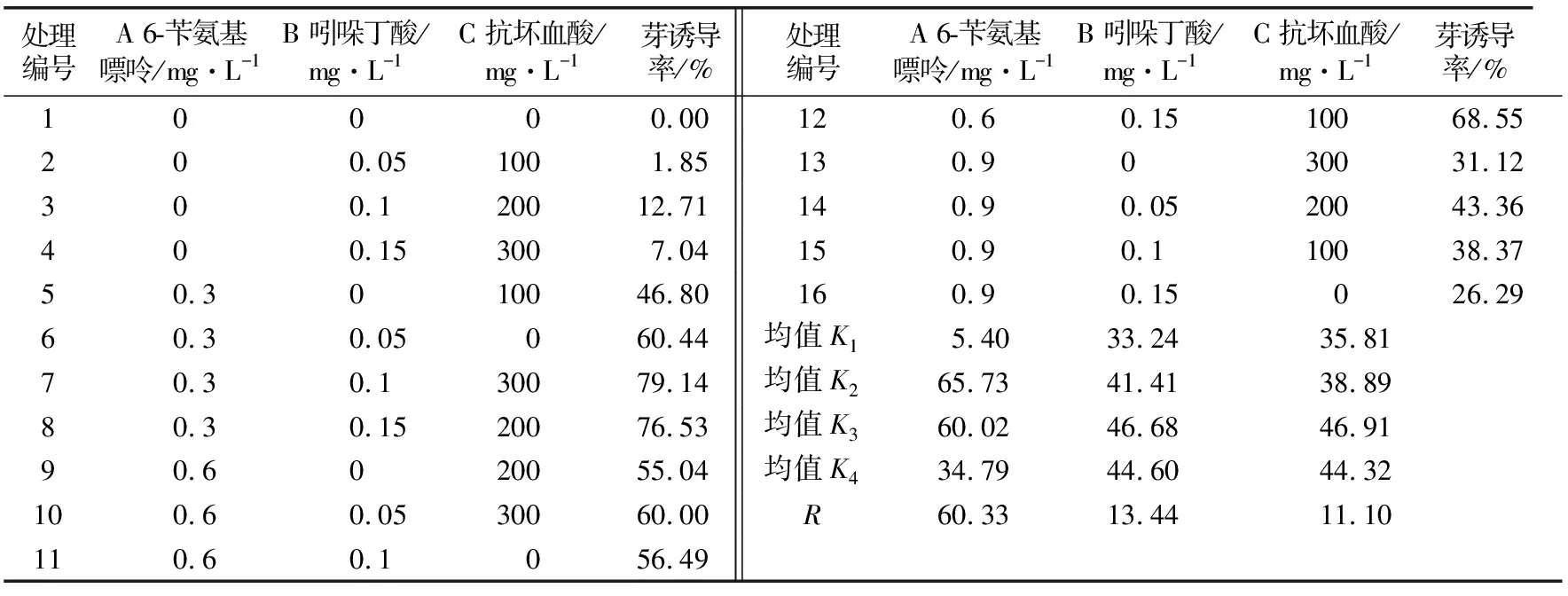
表3 不同培养基配方对黄百香果茎段芽诱导的影响
2.3 植物生长调节剂对组培苗继代增殖的影响
由表4和图1可知,6-苄氨基嘌呤和吲哚丁酸浓度均影响组培苗的继代增殖倍数。吲哚丁酸相同浓度情况下,增殖倍数随着6-苄氨基嘌呤浓度的升高呈先升高后降低的趋势。6-苄氨基嘌呤浓度为0.2 mg/L时,除吲哚丁酸 0 mg/L,其他3个处理的增殖倍数均显著高于6-苄氨基嘌呤0.1、0.3 mg/L的各处理。其中,6-苄氨基嘌呤0.2 mg/L+吲哚丁酸0.05 mg/L处理的增殖倍数最高,为2.82,显著高于其他处理。
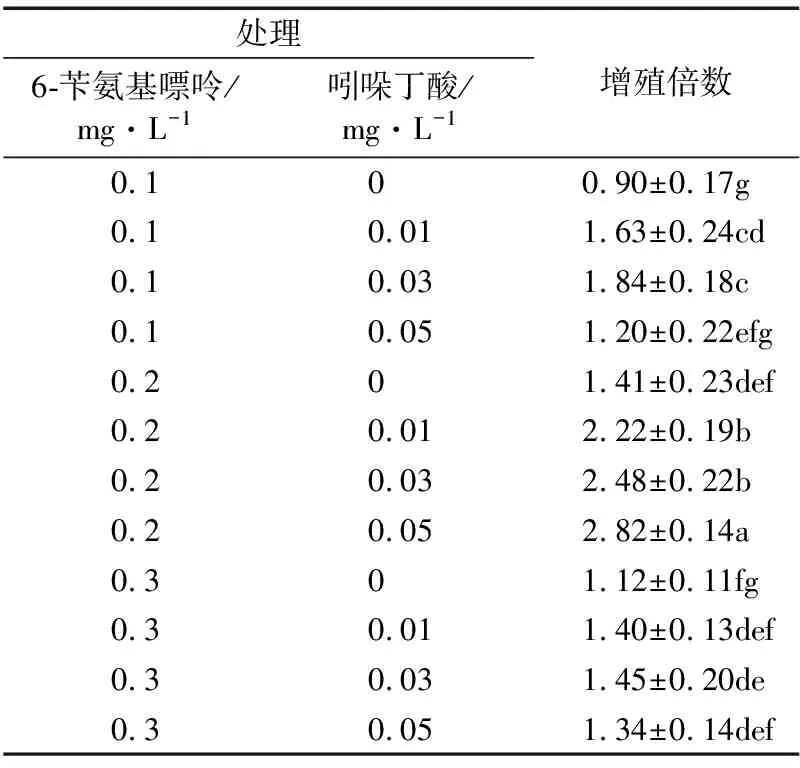
表4 两种植物生长调节剂对黄百香果组培苗继代增殖的影响
2.4 谷氨酸对组培苗继代增殖的影响
由表5可知,随着谷氨酸浓度升高,组培苗继代增殖倍数先升高后降低,组培苗的茎秆变粗壮,叶色由中绿色变为深绿色。谷氨酸20 mg/L时增殖倍数最高,为3.21,显著高于除谷氨酸30 mg/L的其他处理,组培苗茎秆粗壮,叶片深绿色。谷氨酸50 mg/L时增殖倍数最低,为2.68,部分叶片卷曲。可见,MS+6-苄氨基嘌呤0.2 mg/L+吲哚丁酸0.05 mg/L+谷氨酸20 mg/L为黄百香果组培苗继代增殖的最佳培养基。

表5 谷氨酸浓度对黄百香果组培苗继代增殖的影响
2.5 植物生长调节剂对组培苗生根和移栽成活率的影响
由表6和图1可知,添加3种植物生长调节剂的组培苗生根率、生根数均显著高于对照,不同植物生长调节剂对组培苗生根影响不同。吲哚-3-乙酸浓度为0.5、1.0 mg/L时,生根率显著高于0.2 mg/L处理,1.0 mg/L处理生根率达到100%;吲哚丁酸、萘乙酸浓度为0.5、1.0 mg/L时,生根率显著高于0.2 mg/L处理,均达到100%。萘乙酸浓度为0.5 mg/L时生根数显著高于其他处理,为6.29条;吲哚丁酸0.5、1.0 mg/L和萘乙酸1.0 mg/L的生根数差异不显著,仅次于萘乙酸 0.5 mg/L处理。可见,萘乙酸0.5 mg/L的生根率达100%,生根条数最多。

表6 不同植物生长调节剂对黄百香果组培苗生根和移栽成活率的影响
不同植物生长调节剂诱导的不定根形态差异较大。吲哚-3-乙酸0.2 mg/L处理的根细长,浓度提高到0.5、1.0 mg/L时根变粗,3个处理的不定根上的须根均较少;吲哚丁酸3个处理的不定根均表现为粗、长,其中0.5 mg/L处理的不定根上有大量须根;萘乙酸3个处理的不定根均表现为粗、短,且不定根上的须根较少。
生根培养基中不同植物生长调节剂影响组培生根苗的移栽成活率。吲哚-3-乙酸1.0 mg/L处理的组培生根苗移栽成活率显著高于0.5 mg/L处理,为71.67%;吲哚丁酸0.5 mg/L处理的移栽成活率显著高于其他处理,达到83.33%;萘乙酸两个处理的移栽成活率差异不显著。可见,采用MS+吲哚丁酸 0.5 mg/L的生根培养基有利于黄百香果组培生根苗移栽成活。
3 结论与讨论
污染和褐化是植物组织培养过程中的常见问题,特别在外植体消毒灭菌阶段较易发生。本试验中,0.1%HgCl2灭菌剂处理2、4 min时黄百香果茎段外植体的污染率较高,说明处理时间太短,灭菌不彻底。处理8、10 min时褐化死亡率较高,说明灭菌剂对外植体造成了一定伤害。6 min为本试验的最佳灭菌时间,成活率为66.67%。孙琪等[9]对西番莲茎段外植体消毒灭菌的处理方法为先70%酒精灭菌30 s,再0.1%HgCl2处理8 min。与本试验存在差异,这可能与茎段的老嫩、外植体长短等有关。本试验消毒灭菌处理步骤相对简单,0.1%HgCl2处理时间较短,可降低HgCl2对茎段外植体的毒害,减少褐化死亡率。
细胞分裂素在植物组织培养中具有促进细胞分裂、分化,诱导形成不定芽的作用。生长素与细胞分裂素配合使用可促进不定芽的萌发和生长[10]。抗坏血酸不仅对植物细胞生长与分裂、植物内源激素的生物合成等具有调节作用[11],还具有防止褐化的作用[12]。本试验细胞分裂素6-苄氨基嘌呤浓度对黄百香果茎段芽诱导影响最大,其次为生长素吲哚丁酸,抗坏血酸浓度对茎段芽诱导存在一定影响。陈春等[13]研究表明,诱导培养基中添加抗坏血酸1.0 g/L能显著抑制黄枝润楠外植体的褐化,同时促进外植体萌芽。在黄百香果初代培养基中添加抗坏血酸0.3 g/L,可提高茎段外植体芽诱导率。谷氨酸是一种氮源物质,适宜浓度的谷氨酸不仅能促进植物生长,还能提高植物抗逆性[14]。易霭琴等[15]在邓恩桉继代增殖培养基中添加谷氨酸20 mg/L,有利于组培苗生长。本试验中,黄百香果继代增殖培养基中添加谷氨酸20 mg/L时增殖倍数最高,且组培苗茎秆粗壮,叶片深绿。谷氨酸50 mg/L处理的黄百香果组培苗部分叶片卷曲,可能由于谷氨酸浓度过高,影响组培苗对培养基中营养物质及水分的吸收。
黄百香果组培生根培养基中添加相同浓度吲哚-3-乙酸的生根率及生根数低于吲哚丁酸、萘乙酸,这可能是由于吲哚-3-乙酸的稳定性差,在培养基中极易被氧化分解,从而影响生根诱导效果。3种植物生长调节剂诱导出的不定根形态存在差异,吲哚-3-乙酸诱导的不定根较长,萘乙酸诱导的不定根粗短,两种植物生长调节剂诱导的不定根上须根均少。吲哚丁酸0.5 mg/L诱导的不定根粗长,且有大量须根。萘乙酸0.5 mg/L处理的生根数显著高于其他生根配方,但该配方的组培生根苗的移栽成活率显著低于吲哚丁酸0.5 mg/L处理。这说明根形态影响黄百香果组培生根苗的移栽成活率,根粗、长且须根多有利于组培生根苗移栽成活。目前,不同生根培养基处理对百香果组培生根苗移栽成活率影响的研究较少。陈汉鑫等[16]研究认为,吲哚丁酸1 mg/L处理对百香果组培苗生根效果最佳,萘乙酸1.5 mg/L处理的组培生根苗移栽后容易烂根、死苗,结果与本试验相似。牛俊乐等[17]、朱雅静等[18]均认为同时添加萘乙酸和吲哚丁酸两种植物生长调节剂有利于紫百香果组培苗生根。本试验中生根培养基仅添加1种植物生长调节剂,下一步可研究两种植物生长调节剂联合使用对黄百香果组培苗生根及移栽的影响。

