果胶酶与半纤维素酶复合酶解制备费约果果汁的工艺优化
李远蓬,朱棚伟,何 慧,谢雨彤,翁 静,陈其阳,王 丹
(西南科技大学生命科学与工程学院,四川绵阳 621010)
费约果(Acca sellowiana(O.Berg)Burret)是一种桃金娘科南美稔属的多年生亚热带常绿灌木类植物,广泛种植于巴西、阿根廷、智利等国家[1]。近年来,费约果已被我国成功引进并在四川、上海、江苏等地种植。费约果果实富含维生素、矿物质、膳食纤维和酚类等成分,具有抗菌、抗癌、抗氧化等生物活性,在食品﹑药品﹑化妆品等诸多领域的应用前景广阔[2]。然而,费约果储存寿命短,在成熟期和采后贮藏过程中易受微生物影响,易腐败变质;因此,开展费约果深加工处理具有重要意义[3]。目前,已开发的费约果相应的加工产品包括酸奶、果汁、冰淇淋、馅饼、果酱和利口酒等。
果汁不仅能够保留水果中的原有风味、生物活性和营养物质,而且口感好,因此市场发展越来越迅速[4]。由于费约果果浆汁中含有酚类物质、果胶、半纤维素、淀粉衍生物、单宁及微生物等物质[5],在加工中若未除去,这些物质会使费约果果汁在加工及贮存过程中产生沉淀,造成费约果果实出汁率和可溶性固形物含量降低[6]。而高出汁率是果汁生产的一个重要目的[7],特别是对于价格昂贵且可食率较低的费约果。半纤维素和果胶是水果果实的主要成分[8],所以在果汁生产研究中常常采用半纤维素酶和果胶酶复合处理原汁[9-10]。酶解处理可以降低果胶、半纤维素分子,降低果汁的粘性和稠度[11],同时破坏果实细胞壁网络,从而提高果汁的出汁速率和澄清度等[12]。并且相比于其他方法更加方便、有效[13]。因酶解具有专一性、特异性、成本低、无有机残留等优点,所以现如今复合酶解果汁的现状相对成熟[14]。酶辅助提取因其具有高效、环境友好、易于操作等优点在食品工业中常被广泛应用,同时与未经处理的果汁相比,有效提高了可溶性固形物、提取率和抗氧化能力,可显著增加其商业价值[15]。在菠萝蜜和香蕉汁中,复合酶比单一酶处理更有效,这归因于不同类型酶的协同作用[16]。目前,关于单酶或复合酶对费约果及其果汁的相关研究还未见报道。
本实验以出汁率和可溶性固形物含量为主要指标,研究了复合酶(半纤维素酶和果胶酶)添加比例、添加量、酶解时间和酶解温度对费约果果汁出汁率和可溶性固形物的影响,并在单因素的基础上,对其进行四因素三水平的响应面优化试验,以确定复合酶提取费约果果汁的最佳工艺。本研究通过改变酶解条件,最大程度发挥酶的作用,旨在达到降低果汁粘度、改善外观和提高营养价值等的目的,为费约果果汁规模化生产提供理论依据和技术参数。
1 材料与方法
1.1 材料与仪器
费约果(Acca sellowiana(O.Berg)Burret)2022 年11 月初采摘自西南科技大学果园,商业成熟(可溶性固形物含量为10.5%~11.5%),挑选无损伤、无病害的果实用于实验;果胶酶(30000 U/mg)、半纤维素酶(20000 U/mg)诺维信公司;抗坏血酸(纯度>99%)、2,6-二氯酚靛钠(纯度>99%)、福林酚(纯度>98%)、无水碳酸钠(纯度>98%)、没食子酸(纯度>99%)麦克林公司。
UV752 紫外可见分光光度计 上海佑科仪器仪表有限公司;Centrifuge 5804/5804 R 高速离心机德国eppendorf;RHCX-350 唯能超声恒温水浴锅济宁荣汇超声波设备有限公司;BSA223S 型电子天平 赛多利斯科学仪器(北京)有限公司;HR2003 型匀浆机 飞利浦家庭电器有限公司;WYT-4 型手持糖量仪 上海精密仪器仪表有限公司。
1.2 实验方法
1.2.1 费约果果汁提取工艺 果汁的提取参考彭凌等[17]的方法,将干净的费约果去皮后,用HR2003 型匀浆机打浆(10000 r/min,1 min)得到费约果果浆,离心获得的果汁设置为对照组(CK),其出汁率为35.8%±0.5%;酶解后的果汁是将费约果果浆进行灭菌处理后,称取5 mL 果浆原料,进行单因素实验后,离心(5000 r/min,10 min)分离得到的澄清费约果果汁。
1.2.2 单因素实验
1.2.2.1 复合酶比例对出汁率和可溶性固形物(TSS)的影响 半纤维素酶与果胶酶的体积比例设定为3:1、2:1、1:1、1:2、1:3,加酶量为18 g/L,充分混匀后在55 ℃下酶解1 h,考察复合酶比例对出汁率和TSS 的影响[10]。设置三个重复。
1.2.2.2 复合酶添加量对出汁率和TSS 的影响 采用1.2.2.1 获得的最佳复合酶比例,复合酶添加量设定为6、12、18、24、30 g/L,充分混匀后在55 ℃下酶解1 h,考察复合酶添加量对出汁率和TSS 的影响。设置三个重复。
1.2.2.3 酶解时间对出汁率和TSS 的影响 根据上述结果设置最佳复合酶比例和添加量,在55 ℃下设置不同的酶解时间:30、60、90、120、150 min,考察酶解时间对出汁率和TSS 的影响。设置三个重复。
1.2.2.4 酶解温度对出汁率和TSS 的影响 根据上述结果设置最佳复合酶比例、复合酶添加量和酶解时间,建立不同的酶解温度:40、45、50、55、60 ℃,考察酶解温度对出汁率和TSS 的影响。设置三个重复。
1.2.3 响应面试验 在单因素实验的基础上,采用Box-Behnken 试验设计方案,以A:酶解时间(min)、B:酶解温度(℃)、C:加酶量(g/L)和D:酶解比例(半纤维素酶/果胶酶)四个因素为变量,果汁出汁率(R1)和TSS(R2)为响应值,响应面试验因素编码及水平如表1 所示。每组试验设置三个重复。
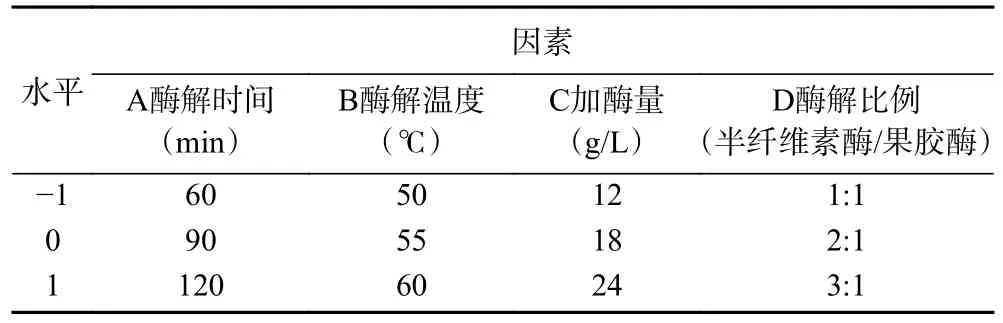
表1 Box-Behnken 设计试验因素及水平Table 1 Factors and levels of the Box-Behnken design
1.2.4 费约果果汁出汁率测定 果汁出汁率的计算参考杨辉等[18]的方法,按下式计算:
式中,m 为果肉总质量,g;M 为果实总质量,g;m1为果汁总质量,g;m2为打浆所用果肉总质量,g。
1.2.5 TSS 含量的测定 采用手持糖量仪进行测定。取一滴果汁均匀涂在干净的棱镜上,轻轻合上盖板使溶液遍布棱镜表面,对准光源或明亮处读取数据。平行操作三次。
1.2.6 费约果果汁透光率测定 取加酶处理和未加酶处理的原汁各5 mL,采用分光光度计法,以透光率为澄清度指标,蒸馏水为对照,测定波长300~1000 nm扫描(各波长间隔为50 nm)。
1.2.7 抗坏血酸(VC)含量测定 参考赵晓梅等[19]的方法,采用2,6-二氯酚靛酚进行滴定。准确吸取5 mL 费约果果汁原液后加入5 mL 草酸溶液(1%),用2,6-二氯酚靛酚染料进行滴定,待溶液至微红色且半分钟之内不褪色即为滴定终点,记录滴定液消耗量。平行操作三次。同时作空白对照,根据公式计算VC含量。
式中:V1为滴定样品提取液时消耗的染液溶液量,mL;V2为滴定空白时消耗的染料溶液量,mL;T 为1 mL 染料溶液相当于抗坏血酸的毫克数;W 为滴定时所取的滤液中含样品的量,g。
1.2.8 总酚含量测定 参考Sato 等[20]的方法,准确吸取0.4 mL 原汁并加入0.4 mL 福林酚试剂,充分震荡摇匀后静置3 min,再加入0.04 mL 饱和NaCO3溶液,用蒸馏水稀释定容到8 mL,经充分振荡后静置于暗处1 h 后,在700 nm 波长下测定其的吸光值。配制不同浓度没食子酸溶液,按上述方法测定700 nm处的总酚值,并绘制标准曲线:OD700=0.0023C标准品+0.0278,R2=0.9986。
1.3 数据处理
本实验每组数据平行测定三次。数据用“平均值±标准差”来表示;采用Excel 数据处理系统和SPSS 12.0 统计分析软件(IBM,美国)进行数据整理与分析;用Ducan’s multiple comparison 方法进行显著差异性分析,P<0.05 表示差异显著;用OriginPro 8.1 绘制数据图。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 不同复合酶添加比例对果汁出汁率和TSS 的影响 由图1 可以看出随着复合酶(半纤维素酶/果胶酶)添加比例的增加,果汁出汁率和TSS 均先上升后下降,当复合酶添加比例在2:1,二者均达到最大值,分别为73.33%、14.73%。这是因为果汁的出汁率归因于果胶的水解,而复合酶能破坏费约果中的果胶结构,导致果肉组织软化,使果汁释放出来[21]。此外,TSS 的提高与组织降解程度较高有关,复合酶促进糖、酸释放量增加[22]。但随着果胶酶比例的增多出汁率和TSS 反而下降,其原因可能是酶的进一步水解使得费约果中蛋白质类物质的析出变性沉降影响了出汁率和TSS[23]。综合出汁率和TSS 的变化,选取复合酶比例为2:1 进行后续试验。
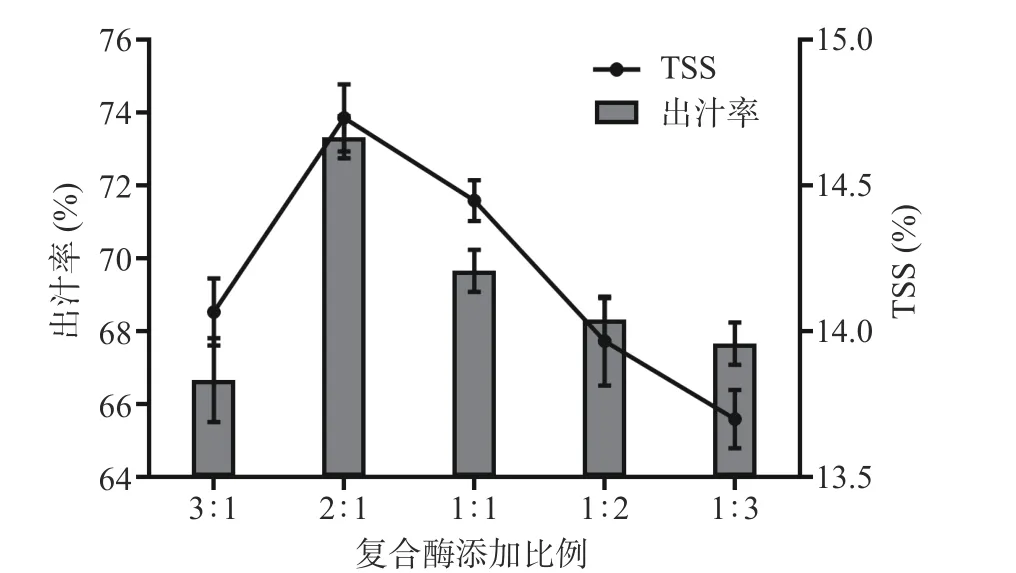
图1 复合酶添加比例对果汁出汁率和TSS 的影响Fig.1 Effect of compound enzyme addition ratio on juice yield and TSS
2.1.2 不同复合酶添加量对果汁出汁率和TSS 的影响 由图2 可以看出,在复合酶添加量为6~18 g/L的区间内,随着复合酶添加量增大,费约果果汁的出汁率、TSS 也随之增加,当复合酶添加量为18 g/L时,二者均达到最大值,分别为72.33%、14.53%。复合酶量的逐渐增加,酶促反应速度加快,果胶迅速溶解,果汁的出汁率[24]、可溶性固形物含量逐渐增加[25]。但当复合酶添加量大于18 g/L 后,出汁率呈现递减趋势,说明复合酶制剂与果胶类物质达到饱和,果汁浸出受阻,使得液泡内的果汁难以被释放出[26]。而TSS 趋于平缓,说明此时果汁溶液体系中存在大量被酶解的果胶质,由于其不断吸附累积沉淀,导致可溶性固形物溶出减少[27]。同时酶与底物具有一定的饱和度,当酶添加量过高时,会降低酶解速率,且高浓度的酶还会引起资源浪费,成本增加[28]。综合出汁率和TSS 的变化,选取复合酶添加量为18 g/L 进行后续试验。

图2 复合酶添加量对果汁出汁率和TSS 的影响Fig.2 Effect of compound enzyme supplemental level on juice yield and TSS
2.1.3 不同酶解时间对果汁出汁率和TSS 的影响由图3 可知,在30~90 min 内,随着酶解时间的延长,果肉细胞在复合酶作用不断被分裂,果胶组织也被水解,使得出汁率逐步提升,在90 min 时达到最大值为74.67%。而酶解时间的持续增加,其呈下降趋势,一方面因为酶解时间的延长导致部分酶失活,酶促反应终止;另一方面因为果汁中果肉细胞组织及果胶基本被分解[29]。在同一时间段内,复合酶持续水解,费约果内果胶物质被水解,TSS 持续溶出,呈上升趋势,最大值为13.17%。但是酶解超过90 min后,酶解反应趋于平衡TSS 不再溶出,达到饱和状态[30-31]。所以综合出汁率和TSS 的变化,选取酶解时间为90 min 进行后续试验。

图3 酶解时间对果汁出汁率和TSS 的影响Fig.3 Effect of enzymatic hydrolysis time on juice yield and TSS
2.1.4 不同酶解温度对果汁出汁率和TSS 的影响由图4 可知,在40~55 ℃内,由于温度的升高此时达到了复合酶的最适温度,酶解速率加快出汁率大幅提升,在55 ℃时达到最大值为72.33%。但其温度的持续上升,使得酶蛋白变性,复合酶失去活性,酶解速率降低,出汁效率大幅下降[22,32]。TSS 的温度变化范围同出汁率相似,随着温度的升高复合酶活性增大,酶促反应速率提高,TSS 溶出速率加快,在55 ℃时达到最大值为14.93%。但当温度超过55 ℃时,由于酶中氢键等非共价键因为高温的原因导致断裂,复合酶中蛋白质变性,复合酶失活,使得TSS 溶出受限呈现下降趋势[33]。综合出汁率和TSS 的变化,选取酶解温度55 ℃进行后续试验。

图4 酶解温度对果汁出汁率和TSS 的影响Fig.4 Effect of enzymatic hydrolysis temperature on juice yield and TSS
2.2 响应面试验结果分析
2.2.1 响应面试验结果 在单因素实验的基础上,根据Box-benhnken 试验设计原理进行响应面设计试验。试验结果见表2,并用Design-Expert10.0.1 对试验结果进行分析。
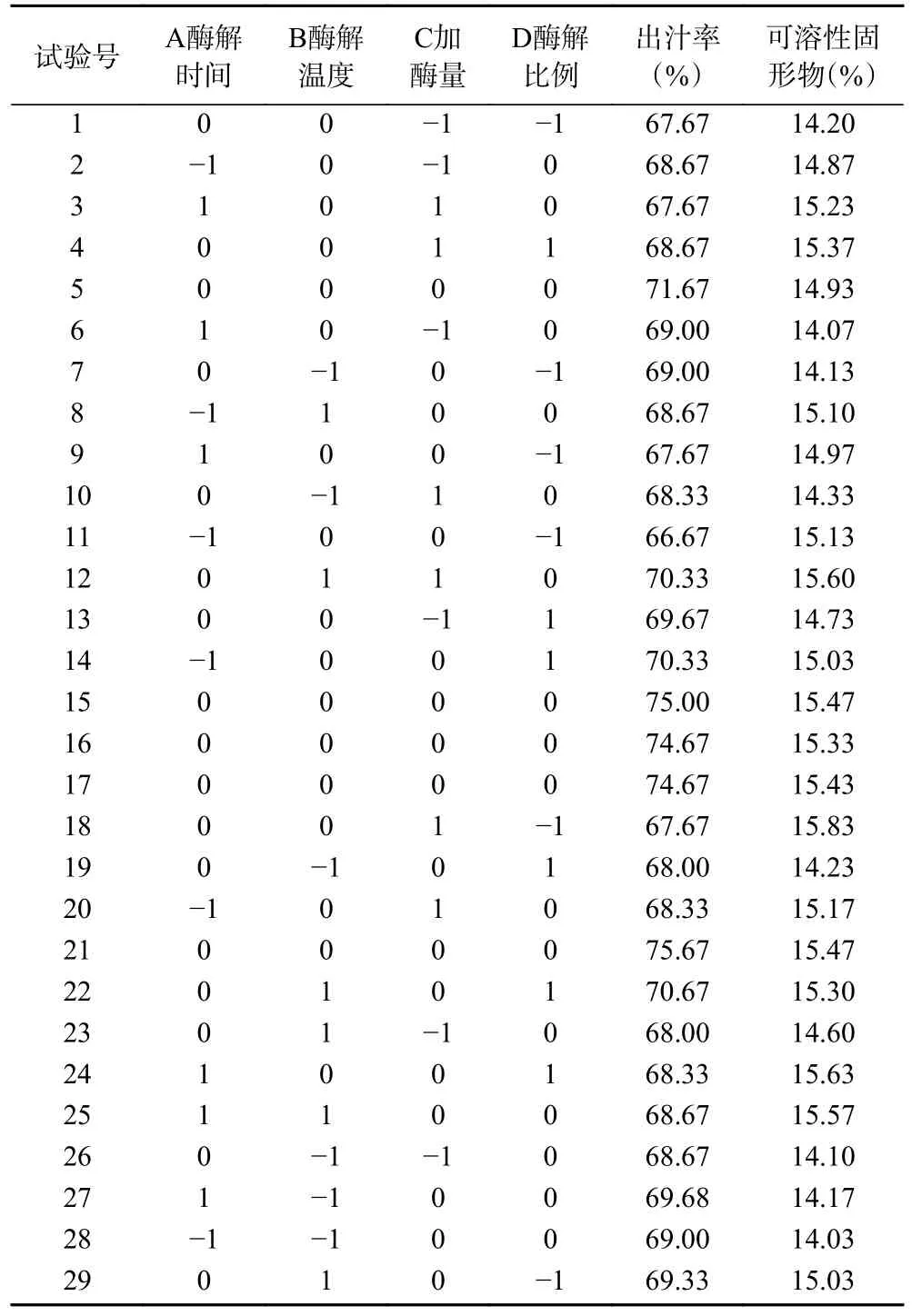
表2 Box-Behnken 设计方案及费约果果汁出汁率和可溶性固形物的测定结果Table 2 Box-Behnken design scheme and determination results of juice yield and soluble solids of feijoa fruit juice
2.2.2 出汁率和可溶性固形物模型方差分析及显著性检验 对表2 中以出汁率和可溶性固形物为响应值,通过Design-Expert10.0.1 软件对响应值与各因素的编码值进行回归拟合后,得到出汁率回归方程:Y1=0.74-5.56E-004A+2.50E-003B-5.56E-0.04C+6.39E-0.03D-1.67E-003AB-2.50E-0.03AC-7.50E-0.03AD+6.67E-0.03BC+5.83E-0.03BD-2.50E-0.03 CD-0.03A2-0.02B2-0.03C2-0.03D2
同理对表2 中以出汁率和可溶性固形物为响应值,通过Design-Expert10.0.1 软件对响应值与各因素的编码值进行回归拟合后,得到可溶性固形物回归方程:Y2=15.23+0.03A+0.52B+0.41C+0.08D+0.08 AB+0.22AC+0.19BC+0.19AD+0.04BD-0.25CD-0.14 A2-0.49B2-0.25C2-0.07D2
从表3 可以看出,所得的Y1和Y2回归方程为极显著(P<0.01),并且出汁率和TSS 失拟检验均不显著,分别为0.9462 和0.4555,说明两个回归模型区域理性化,所以用方程Y1和Y2拟合4 个因素与出汁率和TSS 之间的关系是可行的。其中出汁率模型的R2=0.8978 和TSS 模型的R2=0.9040,说明两个模型拟合度较好。出汁率和TSS 回归方程系数显著性检验表结果显示(表3)二次项(A2、B2、C2和D2)对果汁出汁率有极显著影响(P<0.01);线性项(B、C)和二次项(B2)对果汁TSS 有极显著影响(P<0.01),二次项(C2)对果汁TSS 有显著影响(P<0.05);对果汁出汁率和TSS 影响的交互项分析发现,所有因素的交互作用均不显著。综合以上分析得知:酶解温度和加酶量对TSS 影响较大。两个模型与实际情况拟合较好,可用于预测出汁率和可溶性固形物的变化情况。
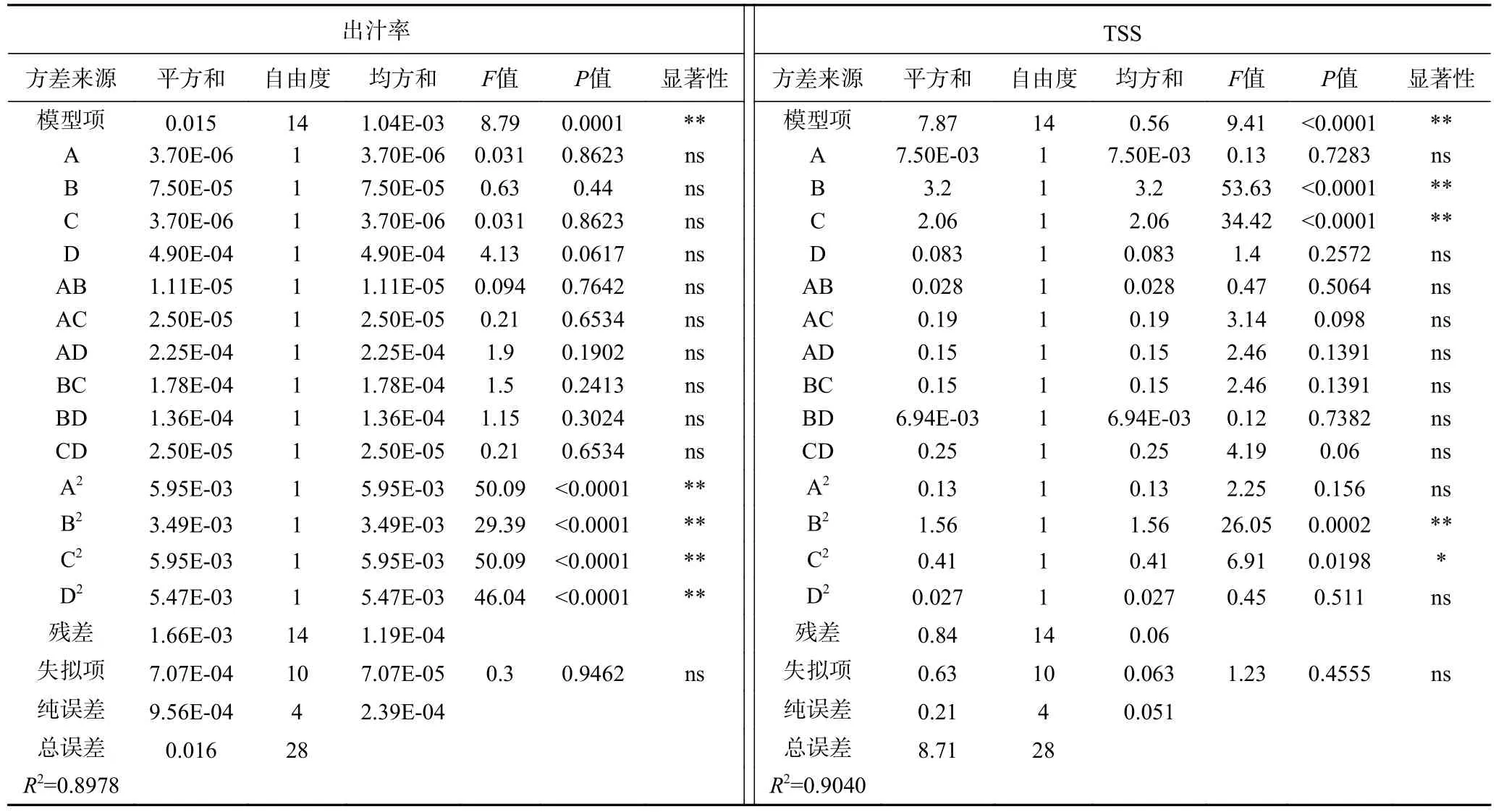
表3 出汁率和可溶性固形物回归方程系数显著性检验表Table 3 Test table for significance of regression equation coefficient of juice yield and TSS
2.2.3 响应面图分析 图5 和图6 为各因素(酶解时间、酶解温度、加酶量和加酶比例)交互作用对费约果果汁出汁率和TSS 的影响,曲线陡峭程度反映了操作条件对于响应值的影响。从图5C 可知,加酶比例和酶解时间的坡度较陡峭,说明两者相较其他交互因素对费约果果汁的出汁率影响更大;其次是加酶量和酶解温度(图5D)。从图6F 可以看出,加酶比例和加酶量交互作用对费约果果汁的TSS 具有较大的影响,而图6B 中酶解时间和加酶量的坡度也相对较陡峭。
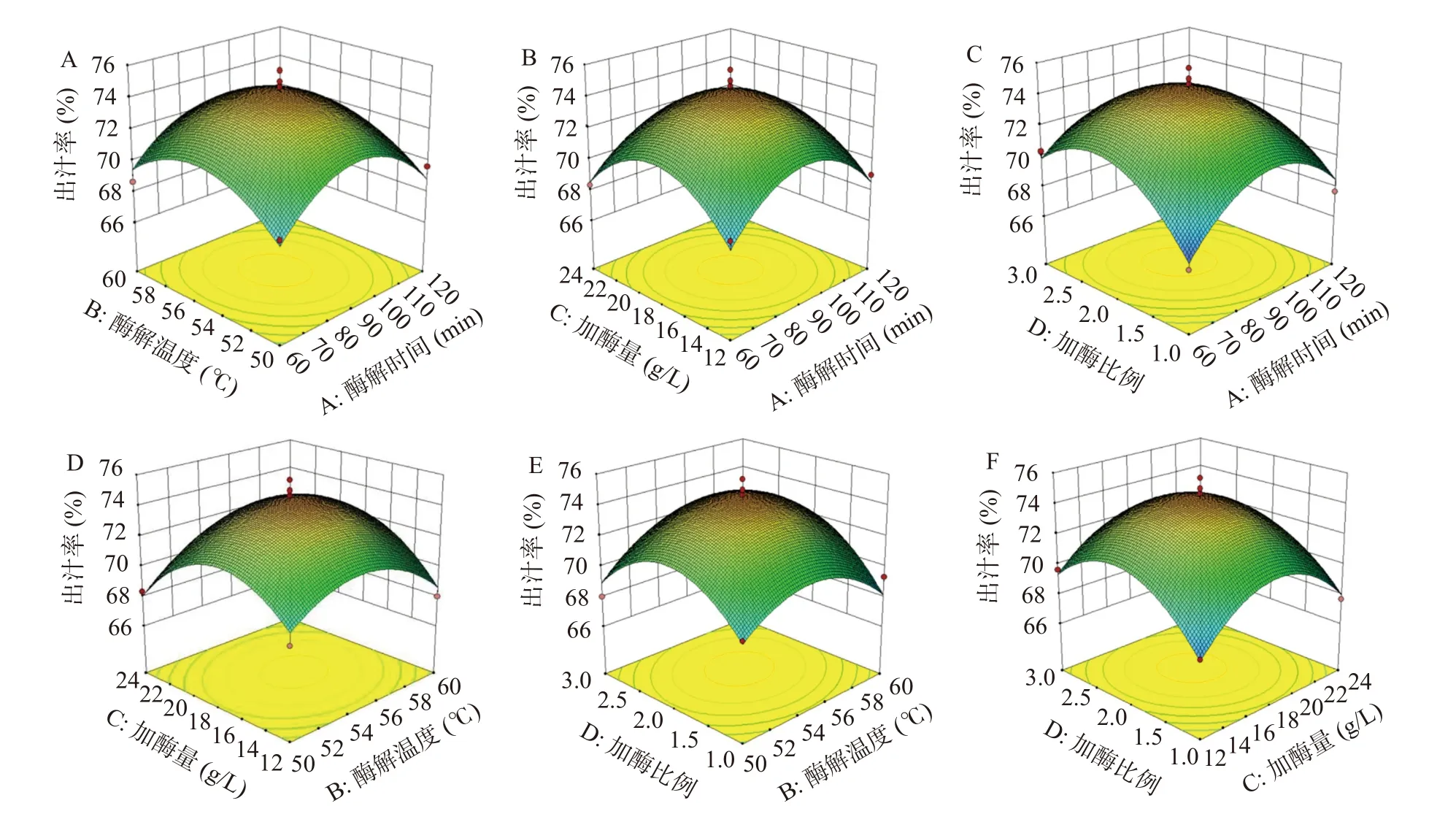
图5 四因素对果汁出汁率影响的响应面图Fig.5 Response surface diagram of influence of four factors on juice yield

图6 四因素对果汁可溶性固形物影响的响应面图Fig.6 Response surface diagram of influence of four factors on TSS
2.3 最佳工艺参数及验证
通过计算分析,得到的最终优化出的试验条件为:复合酶比例(半纤维素酶/果胶酶)为2.14:1、酶添加量为19.60 g/L、酶解时间为91.53 min、酶解温度为56.75 ℃,考虑实际生产条件,复合酶(半纤维素酶/果胶酶)比例2.14:1,酶添加量19.6 g/L、酶解时间92 min、酶解温度为56.8 ℃,模型预测果汁出汁率为74.99%、可溶性固形物含量为15.83%。在此基础上进行3 次验证实验,得到出汁率平均值为79.5%、可溶性固形物含量平均值为15.7%,与预测值接近。
2.4 指标测定
酶解后果汁的各项指标(澄清度、总酚含量和VC含量)与对照组相比显著增加(P<0.05)(图7)。有研究表明,枳壳中存在果胶,在加热状态下果胶大量溶出,提取液粘稠,增加了分离难度,加入果胶酶可以提高枳壳新橙皮苷和柚皮苷的得率,其原因可能是果胶酶可以降解细胞壁结构中的果胶多糖,增强细胞壁结合的多酚和类胡萝卜素等的释放[9,20],以上结果可以解释本研究中果胶酶和半纤维素酶的复合提取可以显著增加果汁的澄清度和总酚含量。相似的结果在葡萄酒发酵过程中也有报道,果胶酶有助于增强花青素等酚类化合物的释放,花青素有助于葡萄酒的风味和颜色强度,显著提高了葡萄酒的色泽、营养价值和陈化潜力[16]。

图7 酶解前后果汁透光率(A)、总酚(TPC)和VC比较(B)Fig.7 Comparison of juice translucency (A),total phenol(TPC) and VC (B) before and after enzymatic digestion
3 结论
本研究建立了酶法澄清费约果果汁的最佳工艺,其参数为酶添加量19.6 g/L、酶解时间92 min、酶解温度为56.8 ℃、加解比例(半纤维素酶/果胶酶)为2.14:1,出汁率和可溶性固形物分别为79.5%和15.7%。实验结果发现,酶解处理的果汁相比未处理的理化指标均显著提高,其中出汁率提高15%、TSS含量上升3%、总酚含量提高12.5 mg GAE/100 g、VC含量提高0.54 mg/100 g,并且透光率也明显提高。因此,运用复合酶酶解处理费约果果汁可以显著提升果汁的出汁率和营养价值,本研究为费约果果汁的高效生产提供了一定的理论基础。

