海藻酸钠-壳聚糖-茶末复合膜的制备及其对葡萄的保鲜效果
陈顺心,刘海波,朱静,徐楷博,徐亚强,陈龙,陈亚蓝
(信阳农林学院食品学院,河南信阳 464000)
随着食品行业的发展,人们要求食品更多地保证其天然性、绿色化。保鲜膜在食品保鲜中起到了非常重要的作用,可以有效阻止微生物的侵染,阻隔空气中的灰尘,延长食品保鲜期[1]。目前,市售保鲜膜材料以聚乙烯为主,存在降解速度慢、环境不友好等缺点。因此研制出可降解、生物安全、环境友好的成膜基材意义重大。
壳聚糖(chitosan,CS)及其衍生物[2-5]、海藻酸钠(sodium alginate,SA)[6-9]具有成膜性好、安全性高等特点,但单独使用存在膜液流动性差、韧性差等问题。研究表明,将成膜基材共混复合并添加功能性成分如茶多酚、茶多糖等[10-13],可以使膜的机械性能、理化性能、阻隔性能等得到改善。茶叶中茶多酚具有较强的抗氧化作用,可与多糖、蛋白等以共价键和非共价键结合,使其抗氧化作用增强[14-17]。晏晶等[18]利用茶多酚-壳聚糖复合膜对红葡萄进行保鲜,贮藏期显著延长。郝子娜等[19]制作出茶多酚-海藻酸钠可食复合涂膜对草鱼进行保鲜,有效地抑制了鱼肉的劣变,保鲜效果良好。
因此,为提高茶多酚复合膜的保鲜能力,使其得到广泛应用,本研究采用绿茶茶末、食品级壳聚糖及海藻酸钠制备可食性保鲜膜,运用单因素及正交试验确定海藻酸钠-壳聚糖-茶末复合膜的最佳配比,并对所制备的膜进行保鲜应用,旨在为茶末废弃物的综合利用和开发提供参考。
1 材料与方法
1.1 材料
信阳毛尖废弃茶末:河南省信阳市老岗茶园;新鲜带蒂葡萄:市售。
1.2 主要试剂和设备
壳聚糖、海藻酸钠(食品级):郑州亿之源化工产品有限公司;丙三醇、冰乙酸、无水氯化钙:天津市大茂化学试剂厂;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)(生物试剂):北京奥博星生物技术有限公司;钼酸铵:天津市北辰区方正试剂厂;草酸:天津市化学试剂三厂;乙二胺四乙酸二钠:天津市致远化学试剂有限公司;硫酸:开封市芳晶化学试剂有限公司;硝酸:天津市科密欧化学试剂有限公司;邻苯二酚、柠檬酸、偏磷酸:国药集团化学试剂有限公司;磷酸氢二钠、磷酸二氢钠:郑州派尼化学试剂厂;愈创木酚:天津市登峰化学试剂厂;过氧化氢:汕头市茂城利发化工有限公司。以上试剂除特殊说明外,均为分析纯试剂。
DZKW-0-2 电热恒温水浴锅:北京市永光明医疗仪器有限公司;A390 紫外可见分光光度:翱艺仪器(上海)有限公司;TG16 高速离心机:上海卢湘仪离心机仪器有限公司;WYT 型糖度计:成都豪创光电仪器有限公司;CP214 电子天平:奥豪斯仪器(上海)有限公司;JC101-2A 电热恒温鼓风干燥箱:上海跃进医疗器械厂;SHP 生化培养箱:北京中兴伟业世纪仪器有限公司;TMS-PRO 质构仪:北京盈盛恒泰科技有限责任公司;LDZM-80L-Ⅲ立式高压蒸汽灭菌器:上海申安医疗器械厂;WYA-2S 手持折光仪:上海申光仪器仪表有限公司。
1.3 试验方法
1.3.1 SA-CS-茶末复合膜的制备
复合膜的制备参照兰文婷等[8]的方法,并略作修改,工艺流程见图1。
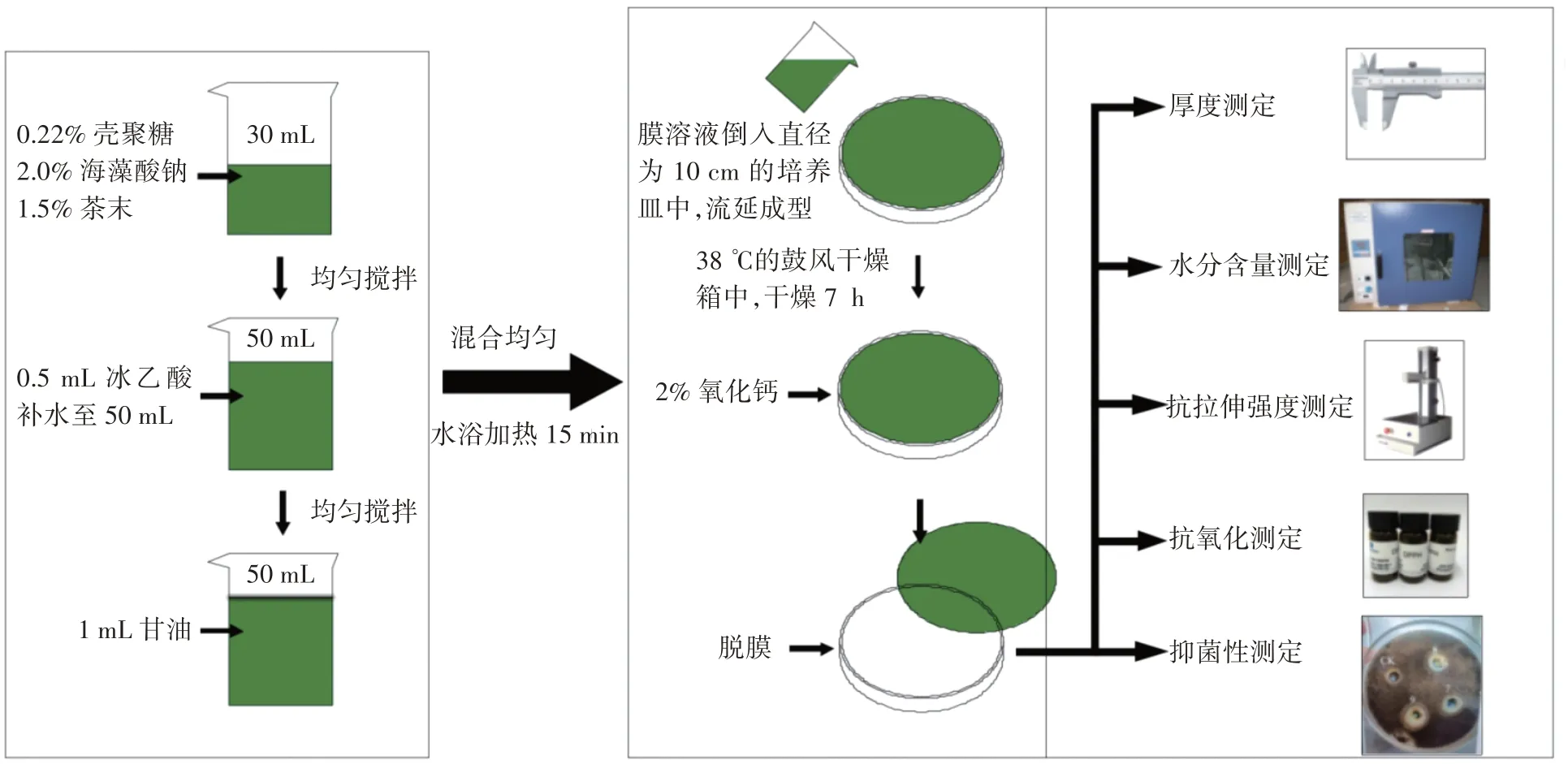
图1 SA-CS-茶末复合膜的制备Fig.1 Preparation of SA-CS-tea powder composite membrane
1.3.2 单因素和正交试验设计
以复合膜的水分含量、DPPH 自由基清除率、抑菌圈直径、厚度和抗拉伸强度为指标,选择茶末添加量、壳聚糖添加量、海藻酸钠添加量进行单因素试验,设置茶末添加量为0、0.5%、1.0%、1.5% 和2.0%;壳聚糖添加量为0.12%、0.20%、0.32%、0.48% 和0.60%;海藻酸钠添加量为0.5%、1.0%、1.5%、2.0%和2.5%。
在单因素试验基础上,进行L9(34)正交试验,确定SA-CS-茶末复合膜最佳添加量,因素水平设计见表1,由于单因素试验中海藻酸钠添加量采用0.5%间隔进行试验,结果不显著(p>0.05),因此正交试验间隔添加量设置为1.0%。
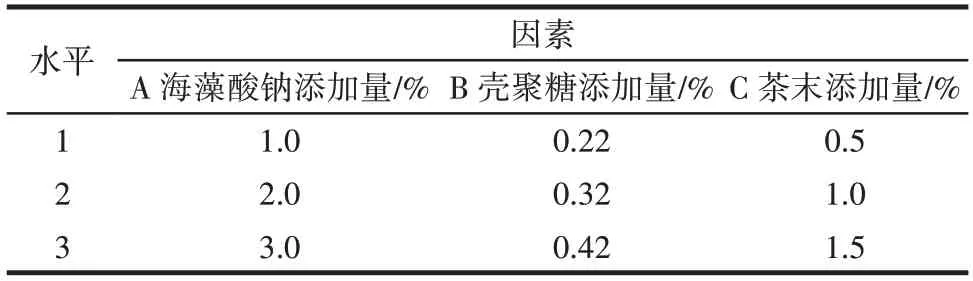
表1 L9(34)正交试验因素水平设计Table 1 L9(34)factors and levels of the orthogonal test
1.4 SA-CS-茶末复合膜性质测定
1.4.1 复合膜厚度测定
将SA-CS-茶末复合膜对折4 次即16 层,用精度为0.02 mm 的游标卡尺取3 个不同位置点测定,平均值为膜的厚度(mm)。
1.4.2 复合膜水分含量的测定
将复合膜剪成20 mm×20 mm 的正方形,称其质量记为M1(g),然后将其置于称量瓶中称质量记为M2(g),在105 ℃鼓风干燥至恒重,于干燥器中冷却至室温,称质量记为M3(g)[17],水分含量(h,%)计算公式如下。
1.4.3 复合膜机械性能的测定
采用质构仪测量膜的抗拉强度,复合膜的大小为10 mm×50 mm,探头测试条件:测试速度60 mm/min,起始力为0.1 N,拉伸距离为40 mm,抗拉伸强度σ(MPa)计算公式如下。
式中:p为最大负荷、断裂负荷、屈服负荷,N;b为试样宽度,mm;d为试样厚度,mm。
1.4.4 复合膜抗氧化的测定
参考汲雪宁[13]的方法测定DPPH 自由基清除率。准确称取3.94 mg DPPH 试剂于棕色容量瓶中用无水乙醇定容至50 mL,混合均匀,得到浓度为0.2 mmol/L DPPH 储备液,置于4 ℃冰箱备用。
准确称量复合膜12.50 mg 放入烧杯中,加10 mL水,90 ℃水浴加热30 min 溶解复合膜,冷却至常温,转移到25 mL 的容量瓶中,定容、摇匀,静置30 min。取2 mL 上清液加入2 mL DPPH 溶液,测定其吸光度记为Ai,取2 mL 上清液和2 mL 无水乙醇测定其吸光度记为Aj,取2 mL 蒸馏水加入2 mL DPPH 储备液测定其吸光度记为A0,分别重复3 次,DPPH 自由基清除率(X,%)计算公式如下。
1.4.5 复合膜抑菌性的测定
参照陈桂芸等[5]的方法测定复合膜抑菌性。以黑曲霉为指示菌,采用双层平板法测定复合膜溶液对黑曲霉的抑制作用。先倒入15 mL PDA,凝固后再倒入15 mL PDA,涂布0.46×106CFU/mL 的孢子液500 μL,待完全吸收后打孔(9 mm),加入500 μL 1.3.1 方法中制备的膜液,37 ℃培养48 h,测定抑菌圈直径(mm),以无菌蒸馏水为空白对照[3]。
1.5 葡萄新鲜度表征
1.5.1 保鲜试验预处理
准备4 个储藏瓶,放入121 ℃高压蒸汽灭菌锅中灭菌15 min,冷却至室温后再放入50 ℃烘箱中烘干备用。挑选成熟度、色度、大小一致的健康带蒂葡萄,用剪刀减去果蒂后分别在4 个储藏瓶中放入20 颗葡萄,记录质量(g)。将储藏瓶按储藏条件分为4 组:1)敞口;2)保鲜膜(厚度100 μm,耐热温度110 ℃);3)封口膜(厚度127 μm,耐热温度100 ℃);4)复合膜。其中后3 组再用封口膜包裹膜及瓶口,保证封闭状态,在室温下储藏0~16 d,每隔4 d 测定失重率、可溶性固形物含量等指标。
1.5.2 失重率
参考刘晨霞等[20]的方法,按照如下公式计算失重率(S,%),计算公式如下。
式中:A1为贮存前葡萄质量,g;A2为贮存后葡萄质量,g。
1.5.3 果实中可溶性固形物含量测定
可溶性固形物含量采用手持折光仪进行测量,随机取3 个葡萄为1 组,取平均值。
1.5.4 腐烂率
参考张婷渟等[21]的方法计算葡萄腐烂率(F,%),葡萄上出现斑点,菌丝均判定为腐烂果实。
F=M/N× 100
式中:M为腐烂的果粒;N为总果粒。
1.5.6 葡萄中VC含量的测定
参考李军[22]的钼蓝比色法测定VC含量。
1.5.7 多酚氧化酶和过氧化物酶活性测定
参考黄赫雁等[23]和李忠光等[24]的方法进行多酚氧化酶和过氧化物酶活性测定。
1.6 数据处理
所有试验设置3 个平行,结果以平均值±标准差表示。使用Excel 2019 分析数据及制图、SPSS 分析差异显著性。
2 结果与分析
2.1 单因素试验结果
2.1.1 茶末添加量
茶末添加量对复合膜性能的影响见表2。

表2 茶末添加量对复合膜性能的影响Table 2 Effect of tea powder concentration on property of composite membrane
由表2 可知,不同茶末添加量制得的复合膜水分含量均低于40%。复合膜具有一定吸水性,当复合膜水分含量超过一定水分含量,有利于微生物的生长繁殖,失去保鲜特性;低水分含量能抑制食品的化学变化和微生物生长繁殖。40%以下水分含量不利于绝大多数微生物的生长[25-26]。
茶末中富含茶多糖、茶多酚等功能成分,对复合膜DPPH 自由基清除率有一定影响。不同茶末添加量制得的复合膜DPPH 自由基清除率随茶末添加量的增加先上升后趋于平稳。当茶末添加量大于1.0% 时DPPH 自由基清除率无显著性变化。
随着茶末添加量的增加,复合膜的抑菌圈直径先增加后趋于平稳。当茶末添加量超过1.0%时,复合膜的抑菌圈直径变化趋于平稳。
随着茶末添加量的增加,复合膜厚度和抗拉伸强度均呈增加趋势,当茶末的添加量超过1.0%时,各指标增幅趋于稳定。
综上所述,综合考虑经济成本,SA-CS-茶末复合膜较为适宜茶末添加量为1.0%,因此选择茶末添加量0.5%、1.0%、1.5%进行正交优化试验。
2.1.2 海藻酸钠添加量
海藻酸钠添加量对复合膜性能的影响见表3。

表3 海藻酸钠添加量对复合膜性能的影响Table 3 Effect of sodium alginate concentration on property of composite membrane
由表3 可知,随着海藻酸钠添加量增加,水分含量呈下降趋势且均低于40%,不利于绝大多数微生物的生长;DPPH 自由基清除率基本不变,无显著性差异;海藻酸钠添加量为0.5%~1.0% 时,其机械性能较差。因此,选取海藻酸钠添加量的最佳范围为1.5%~2.5%;复合膜的抑菌圈直径随着海藻酸钠添加量增加逐渐增大,海藻酸钠添加量2.0% 和2.5% 抑菌圈直径较大,分别为15.32 mm 和16.71 mm,结合厚度、机械性能和水分含量的结果,海藻酸钠最佳添加量为2.0%。
综上所述,SA-CS-茶末复合膜较为适宜海藻酸钠添加量为2.0%,因此选择海藻酸钠添加量1.0%、2.0%、3.0%进行正交优化试验。
2.1.3 壳聚糖添加量
壳聚糖添加量对复合膜性能的影响见表4。

表4 壳聚糖添加量对复合膜性能的影响Table 4 Effect of chitosan concentration on property of composite membrane
由表4 可知,随着壳聚糖添加量增加,水分含量呈下降趋势且均低于40%,不利于绝大多数微生物的生长。当壳聚糖添加量为0.12%~0.20%时,其机械性能较差,壳聚糖添加量大于0.32%时,机械性能提升且趋于稳定。结合经济效益,壳聚糖最佳添加量为0.32%。通过差异性分析可知,壳聚糖添加量对DPPH 自由基清除率无较大影响。当壳聚糖添加量大于等于0.32%时,复合膜抑菌圈直径无明显变化,因此,壳聚糖最佳添加量为0.32%。当壳聚糖浓大于0.32% 时,复合膜的抗拉伸强度无显著性变化,但壳聚糖添加量为0.32% 时,抑菌效果较好,因此壳聚糖最佳添加量为0.32%。综上所述,选择壳聚糖添加量为0.22%、0.32%、0.42%进行正交优化试验。
2.2 SA-CS-茶末复合膜正交试验结果
2.2.1 DPPH 自由基清除率的正交试验
不同因素添加量对复合膜DPPH 自由基清除率的正交试验结果见表5。
由表5 可知,各因素对SA-CS-茶末复合膜DPPH自由基清除率的影响程度依次为C>A>B,即茶末添加量影响最大,其次为海藻酸钠添加量,壳聚糖添加量影响最小。正交试验中,DPPH 自由基清除率最强的为A2B1C2(96.56%)。由于正交试验优化得出的最优组合为A1B1C3,故需进行验证试验。通过验证,A1B1C3组合制得的SA-CS-茶末复合膜DPPH 自由基清除率为96.24%,低于正交9 组试验中最优结果,因此SA-CS-茶末复合膜对DPPH 自由基清除率最佳的工艺条件为A2B1C2。
2.2.2 复合膜厚度的正交试验
不同因素添加量对复合膜厚度的正交试验结果见表6。
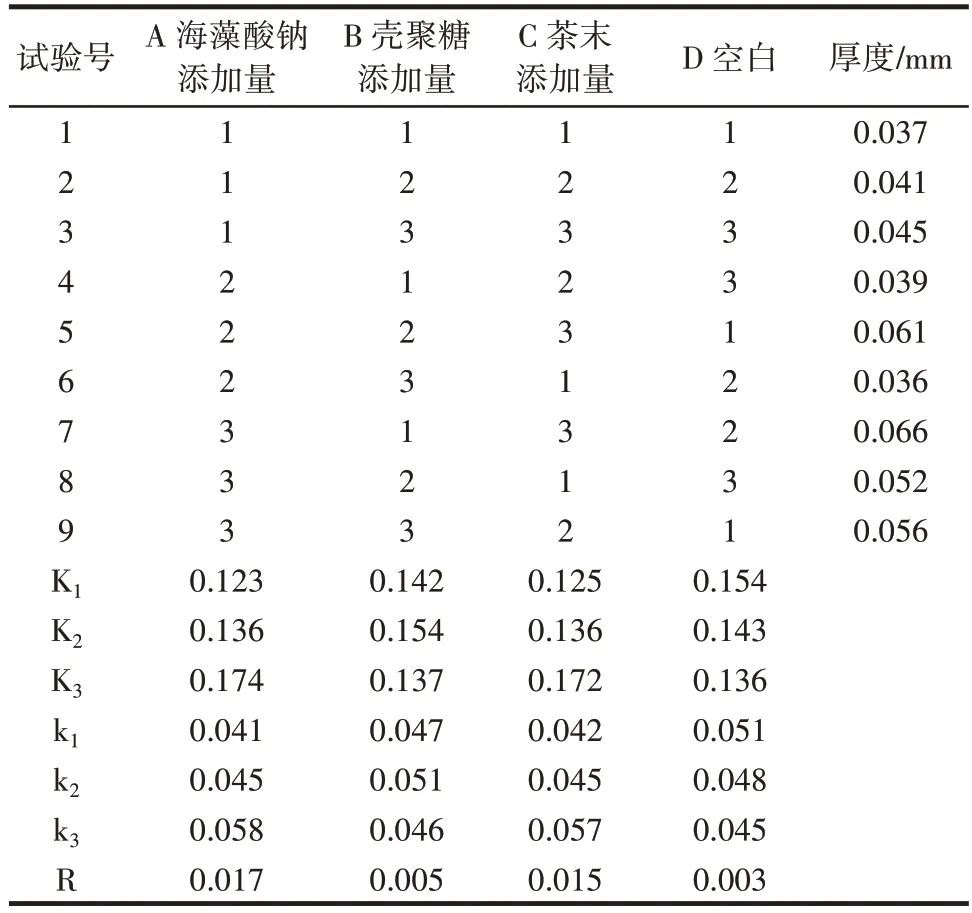
表6 复合膜厚度的正交试验结果Table 6 Orthogonal test of thickness of composite membrane
当壳聚糖和海藻酸钠添加量分别为0.22% 和1.0% 时制备的薄膜,膜成型效果较差,容易断裂。随着复合膜厚度增加,膜的机械性能、抗氧化性能和抑菌性均有所增加。所以,最大选择膜厚度为最佳结果。由表6 可知,各因素对SA-CS-茶末复合膜厚度的影响程度依次为A>C>B,海藻酸钠添加量影响最大,其次为茶末添加量,壳聚糖添加量影响最小。正交试验中,复合膜厚度最大的为A3B1C3(0.066 mm)。正交试验优化得出的最优组合为A3B2C3与A3B1C3结果不同,故需进行验证试验。通过验证,A3B2C3组合制得的SA-CS-茶末复合膜的厚度为0.070 mm,优于正交试验中A3B1C3,因此制作SA-CS-茶末复合膜过程中厚度最佳的工艺条件为A3B2C3。
2.2.3 复合膜抗拉伸强度的正交试验
不同因素添加量对复合膜抗拉伸强度的正交试验结果见表7。
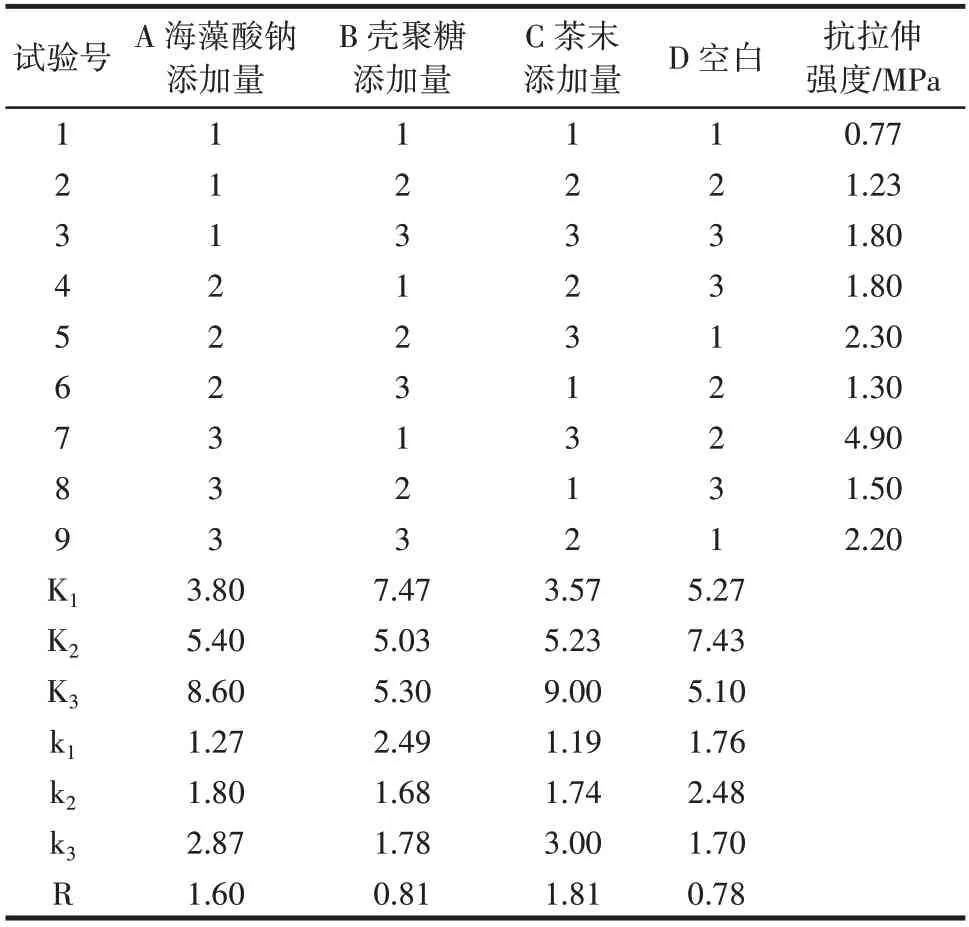
表7 复合膜抗拉伸强度的正交试验结果Table 7 Orthogonal test of tensile strength of composite membrane
由表7 可知,各因素对SA-CS-茶末复合膜抗拉伸强度的影响程度依次为C>A>B,茶末添加量影响最大,其次为海藻酸钠添加量,壳聚糖添加量影响最小。正交试验中,复合膜抗拉伸强度最大的组合为为A3B1C3(4.90 MPa),正交试验优化得出的最优组合也为A3B1C3,试验结果相同,因此制作SA-CS-茶末复合膜过程中抗拉伸强度最佳的工艺条件为A3B1C3。
2.2.4 复合膜抑菌性的正交试验
不同因素添加量对复合膜抑菌性的正交试验结果见表8。

表8 复合膜抑菌性的正交试验数据Table 8 Orthogonal test of bacteriostatic activity of composite membrane
由表8 可知,各因素对SA-CS-茶末复合膜抑菌性的影响程度依次为A>C>B,海藻酸钠添加量影响最大。正交试验中,复合膜抑菌性最好的为A2B2C3(19.1 mm)。由于正交试验优化得出的最优组合为A2B3C3,故需进行验证试验。通过验证,A2B3C3组合制得的SA-CS-茶末复合膜的抑菌圈直径为18.3 mm,低于A2B2C3试验结果,因此抑菌效果最佳的工艺条件为A2B2C3。
2.2.5 正交试验综合分析
由于不同指标对应的最优参数组合不一致,需要进行综合平衡[27],结果如表9所示。
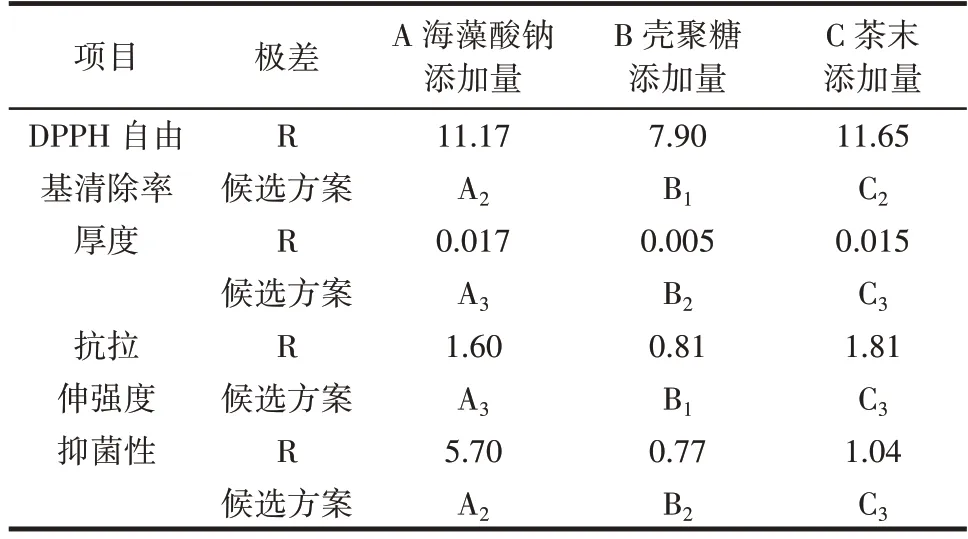
表9 综合平衡结果Table 9 Integrated balance results
从表9 可以看出,海藻酸钠添加量对复合膜厚度和抗拉伸强度以A3水平为最好,对DPPH 自由基清除率和抑菌性以A2水平为最好。其中复合膜厚度主要影响制膜效果、抗拉伸强度、抗氧化能力和抑菌性能,在DPPH 自由基清除率和抑菌性较好的基础上,抗拉伸强度的极差又不是影响最大的因素,因此,海藻酸钠添加量以A2水平(2.0%)为较优配方;壳聚糖添加量对复合膜DPPH 自由基清除率和抗拉伸强度以B1水平最好,对厚度和抑菌性以B2水平最好,但壳聚糖各指标的极差都最小,表明壳聚糖添加量是影响最小的因素,因此,壳聚糖添加量以B1水平(0.22%)为较优配方,且具有较好的经济效益;茶末添加量对厚度、抗拉伸强度、抑菌性以C3水平最好,对DPPH 自由基清除率以C2水平最好,但C3水平在正交试验中高于C2水平,且二者相差结果不大。因此,茶末添加量取C3(1.5%)水平最好。
因此,最佳的试验方案是A2B1C3,即海藻酸钠、壳聚糖、茶末的添加量分别为2.0%、0.22% 和1.5%。其DPPH 自由基清除率为96.44%,厚度为0.041 mm,抗拉伸强度为1.9 MPa,抑菌圈直径为18.6 mm。
2.3 复合膜保鲜效果的影响
2.3.1 果实失重率
果实失重率见图2。
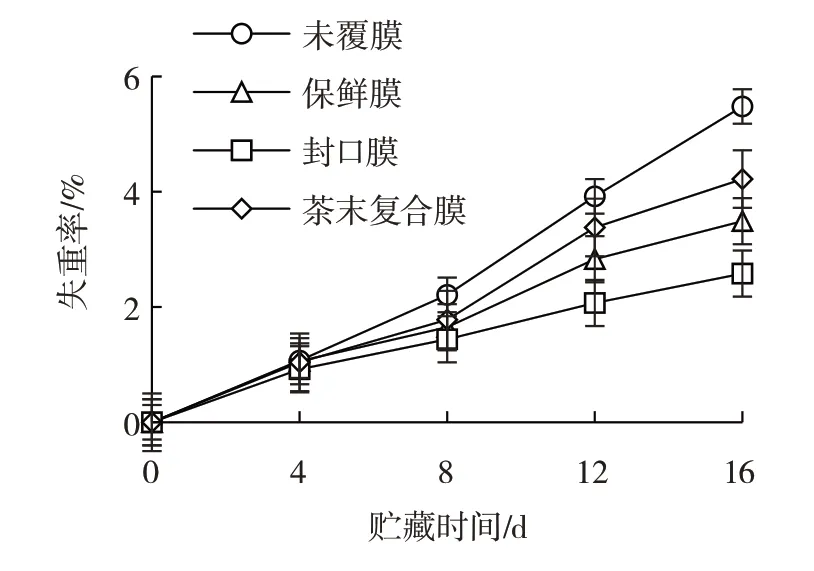
图2 果实失重率Fig.2 Weight loss of the fruit
由图2 可知,室温保存16 d 时,SA-CS-茶末复合膜处理组的失重率比未覆膜组低1.26%,但高于保鲜膜(3.49%)和封口膜(2.58%)处理组,表明复合膜处理能够降低果实的失重率,但与保鲜膜处理组和封口膜处理组相比效果还不理想,原因是复合膜有一定的透气性,水蒸气蒸发散失,而保鲜膜、封口膜不透气,水蒸气无法溢出,因此失重率低。
2.3.2 果实腐烂率
葡萄腐烂率如图3所示。
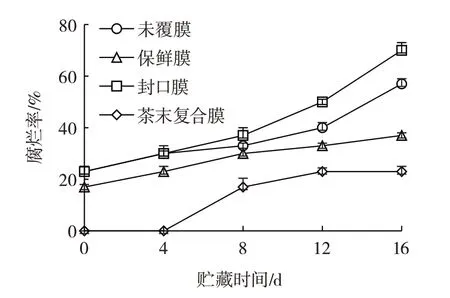
图3 果实腐烂率Fig.3 Rotting of the fruit
由图3 可知,葡萄室温保存16 d,复合膜组的腐烂率为23%,未覆膜、保鲜膜和封口膜组的腐烂率分别57%、37%和70%,封口膜组腐烂率较高是由于气密性好,瓶内水蒸气含量较高,导致大量霉菌生长。复合膜的失重率虽然比封口膜组、保鲜膜组的高,但是透气性较好,且抑制了霉菌的生长,所以腐烂率比较低,因此复合膜可以更好的保鲜葡萄,降低葡萄被微生物感染的概率。
2.3.3 果实中可溶性固形物
果实在储藏期间淀粉等物质会分解为小分子糖,使果实的糖度增加[20]。葡萄可溶性固形物变化如图4所示。

图4 果实可溶性固形物含量Fig.4 Sugar content of the fruit
由图4 可知,随着贮藏时间的延长,可溶性固形物含量增加,但复合膜处理组的可溶性固形物含量低于未覆膜、保鲜膜和封口膜处理组,表明复合膜处理组能够有效抑制果实贮藏期间的生理活动。
2.3.4 果实中VC含量
果实VC含量如图5所示。
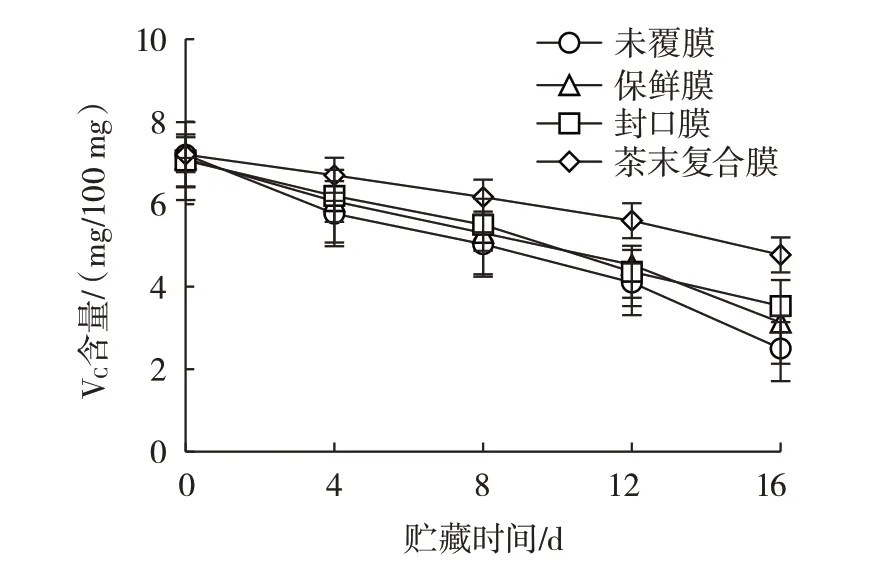
图5 果实VC 含量Fig.5 VC content of the fruit
VC在葡萄贮藏过程中会逐渐氧化分解,导致VC含量下降。由图5 可知,随着贮藏时间的延长,VC含量逐渐减少,贮藏4 d,未覆膜、保鲜膜、封口膜和复合膜组的VC含量分别为5.8、6.1、6.2 mg/100 g 和6.7 mg/100 g,贮藏4 d 后各组的VC含量下降速率增大,贮藏16 d,复合膜组的VC含量高于其他处理组,表明复合膜能够有效的抑制葡萄中VC的分解。
2.3.5 果实中多酚氧化酶活性
果实多酚氧化酶活性见图6。

图6 果实多酚氧化酶活性Fig.6 Activity of polyphenol oxidase of the fruit
由图6 所知,随着贮藏时间的延长,葡萄果实中的多酚氧化酶活性整体呈现先增大后减小趋势。果实贮藏至12 d,未覆膜组的多酚氧化酶活性增加了62%,保鲜膜处理组增加了59%,封口膜处理组上升了38%,而复合膜组上升了22%,贮藏16 d,复合膜组多酚氧化酶活性低于其他处理组,说明复合膜处理有效抑制了葡萄多酚氧化酶活性,延缓了葡萄的褐变。
2.3.6 果实中过氧化物酶活性
果实过氧化物酶活性见图7。
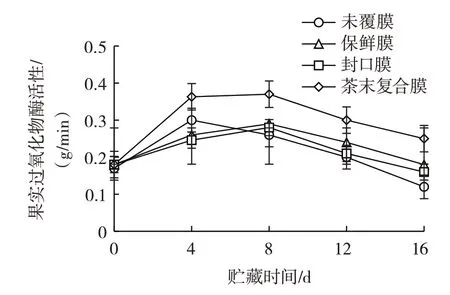
图7 果实过氧化物酶活性Fig.7 Activity of peroxidase of the fruit
由图7 可知,贮藏前4 d 各组的过氧化物酶活性均呈上升趋势;贮藏4~8 d,未覆膜组过氧化物酶活性下降,其余3 组均上升;贮藏8~16 d,各组过氧化物酶活性均开始下降。整个贮藏过程中复合膜组的过氧化物酶活性始终比其他组的活性高,说明复合膜处理能够有效维持葡萄中过氧化物酶的活性,使葡萄贮藏时间更长。
3 结论
通过单因素试验和正交试验确定SA-CS-茶末复合膜最佳制备工艺为海藻酸钠添加量2.0%、壳聚糖添加量0.22%、茶末添加量1.5%,此条件下制得的复合膜DPPH 自由基清除率为96.44%,厚度为0.041 mm,抗拉伸强度为1.9 MPa,抑菌圈直径为18.6 mm。此工艺制备复合膜具有较好的抗氧化、抑菌特性,有一定的韧性。与未覆膜组、保鲜膜组、封口膜组相比,SA-CS-茶末复合膜能够有效降低葡萄的腐烂率、抑制VC含量下降、延缓可溶性固形物含量上升,并有效地抑制了多酚氧化酶活性,延缓果实褐变,提高了果实过氧化物酶活性,延缓果实衰老。因此,认为SA-CS-茶末复合膜在一定程度上对葡萄具有保鲜效果。

