宫颈癌组织IGHG1、TRIM14表达及其临床意义
王 微,胡美丽,张雪芹,王红红,付琳琳,许 辉
(1.保定市妇幼保健院,河北 保定071000;2.青岛市西海岸新区中心医院,山东 青岛 266555)
宫颈癌是妇科常见的恶性肿瘤。近年来,宫颈癌发病率和死亡率逐年上升,且患病人群趋于年轻化,直接影响了妇女的身心健康[1-2]。宫颈癌疫苗的上市一定程度上降低了宫颈癌的发病率,但HPV感染筛查率仍然较低,宫颈癌患者存活率没有得到有效提高[3]。宫颈癌患者预后较差,术后易复发,因此,寻找准确评估宫颈癌患者预后的生物标志物对提高宫颈癌防治能力具有重要意义[4]。免疫球蛋白G1重链恒定区(immunoglobulin G1 heavy chain constant region,IGHG1)是免疫球蛋白IgG的亚型之一,研究发现其参与多种肿瘤的发生与发展,与肿瘤细胞的增殖、迁移、侵袭和上皮间质转化等过程密切相关,与肿瘤来源的IgG呈正相关[5-6]。三结构域蛋白14(tripartite motif-containing 14,TRIM14)是一种与感染和免疫调节相关的蛋白质,近期研究发现其在多种肿瘤组织中异常表达,参与恶性肿瘤的迁移、侵袭、血管生成等恶性生物学行为[7-8]。但IGHG1、TRIM14蛋白在宫颈癌组织中的表达和临床意义还尚未见相关研究。因此,本研究通过检测宫颈癌组织IGHG1、TRIM14蛋白表达水平,分析两者的临床意义。
1 资料与方法
1.1 研究对象
选取2019年3月至2020年3月保定市妇幼保健院收治的新诊断的82例宫颈癌患者作为研究对象,患者年龄25~78岁,平均(58.50±5.34)岁。研究对象纳入标准:①经妇科检查,影像学和宫颈组织病理学检查等初次确诊为宫颈癌;②均拟进行宫颈癌根治性切除术;③外科手术切除前未经过任何形式的抗肿瘤治疗;④根据FIGO的分期标准[9]显示病情已进入临床分期Ⅰ~Ⅲ期;⑤有完整的临床病理资料;⑥患者本人及家属知晓并同意,本人自愿签署同意书。排除标准:①伴有其他妇科疾病者;②合并其他恶性肿瘤者;③合并严重感染者;④随访时间不足1个月或院内死亡者;⑤妊娠或哺乳期妇女;⑥伴有心、肝、肾等重要器官严重功能障碍者;⑦精神状态异常者;⑧合并自身免疫性疾病者。本研究符合相应人体实验伦理原则和规范,已得到我院的伦理委员会批准(2020-A109)。
1.2 研究方法
1.2.1 主要试剂与仪器
二步法试剂盒、DAB显色试剂盒、山羊血清购自北京中杉金桥生物技术有限公司;兔抗人IGHG1、TRIM14抗体购自美国Abcam公司。
1.2.2 一般资料的收集
收集所有研究对象的临床资料,包括年龄、肿瘤直径、肿瘤病理类型、肿瘤分化程度、TNM分期、淋巴转移、生育、绝经等资料。
1.2.3 组织样本的采集与储存
所有宫颈癌患者入院后均在术中取部分肿瘤组织与癌旁组织(≥肿瘤边缘5cm),于-80℃冻存,待测。
1.2.4 免疫组化法检测宫颈癌肿瘤组织与癌旁组织IGHG1、TRIM14蛋白表达
取样本制备组织切片,之后进行脱蜡、水化、抗原修复,除去内源性过氧化物酶,在室温下用山羊血清封闭30min。之后加入IGHG1(1∶200)、TRIM14(1∶200)一抗孵育过夜。次日加入二抗室温下继续孵育2h,之后PBS洗涤,加入DAB显色液显色3min,加入自来水终止显色。经苏木精复染、脱水、透明,用中性树胶进行封片。显微镜下观察IGHG1、TRIM14蛋白的表达情况。若呈阳性表达,则细胞质或细胞核被染成棕黄色,若为阴性表达,则为蓝色。光镜下随机选取5个视野,以阳性细胞百分数评价IGHG1、TRIM14蛋白的表达情况。
1.2.5 随访
所有宫颈癌患者术后通过电话或门诊接受3年的规律随访,每月随访1次,统计患者3年的生存情况,随访截止到2023年3月。并依据患者存活情况分为预后良好组(存活时间≥3年)与预后不良组(存活时间<3年)[10]。
1.3 统计学方法

2 结果
2.1 癌旁组织与肿瘤组织IGHG1、TRIM14蛋白表达比较
如表1和图1、2所示,与癌旁组织相比,宫颈癌患者的肿瘤组织中IGHG1、TRIM14蛋白表达水平均显著升高,且具有显著性差异(P<0.05)。
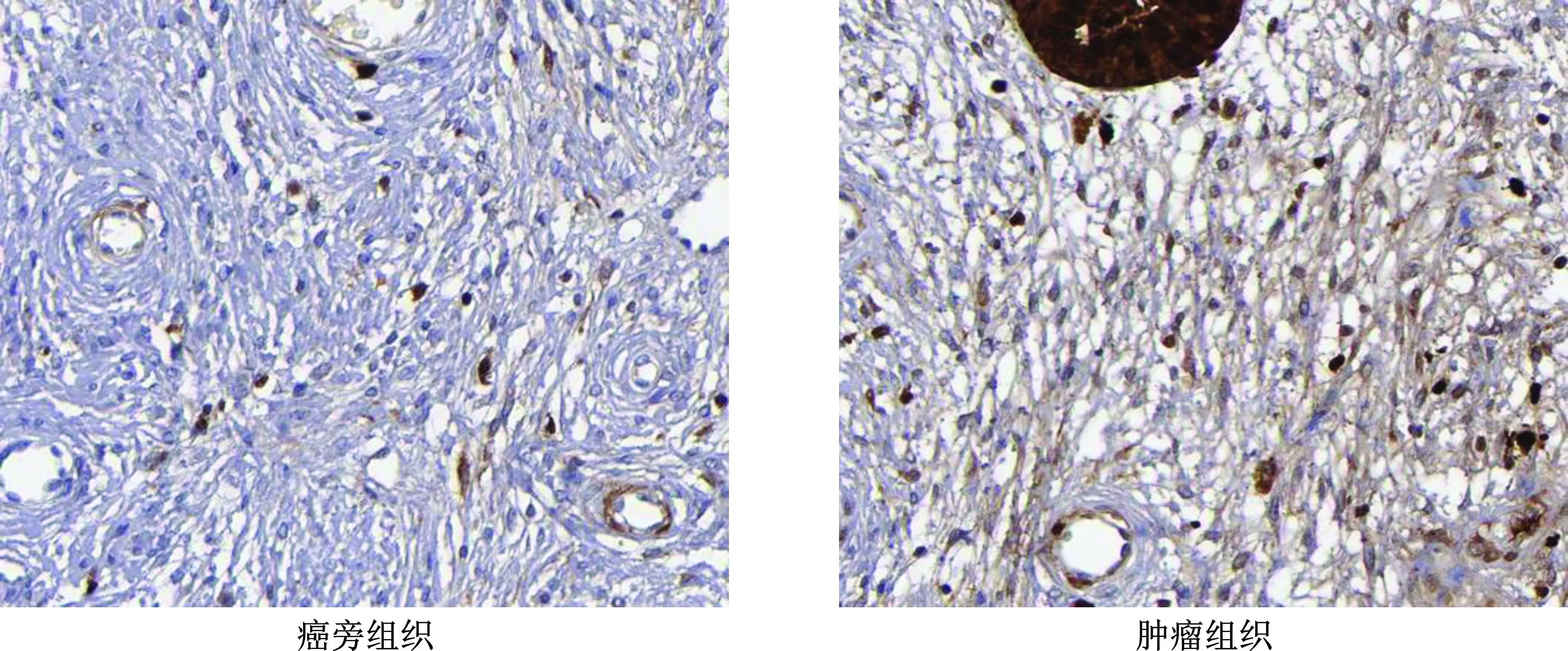
图1 免疫组化法检测癌旁组织与宫颈癌肿瘤组织中IGHG1蛋白表达(×400)
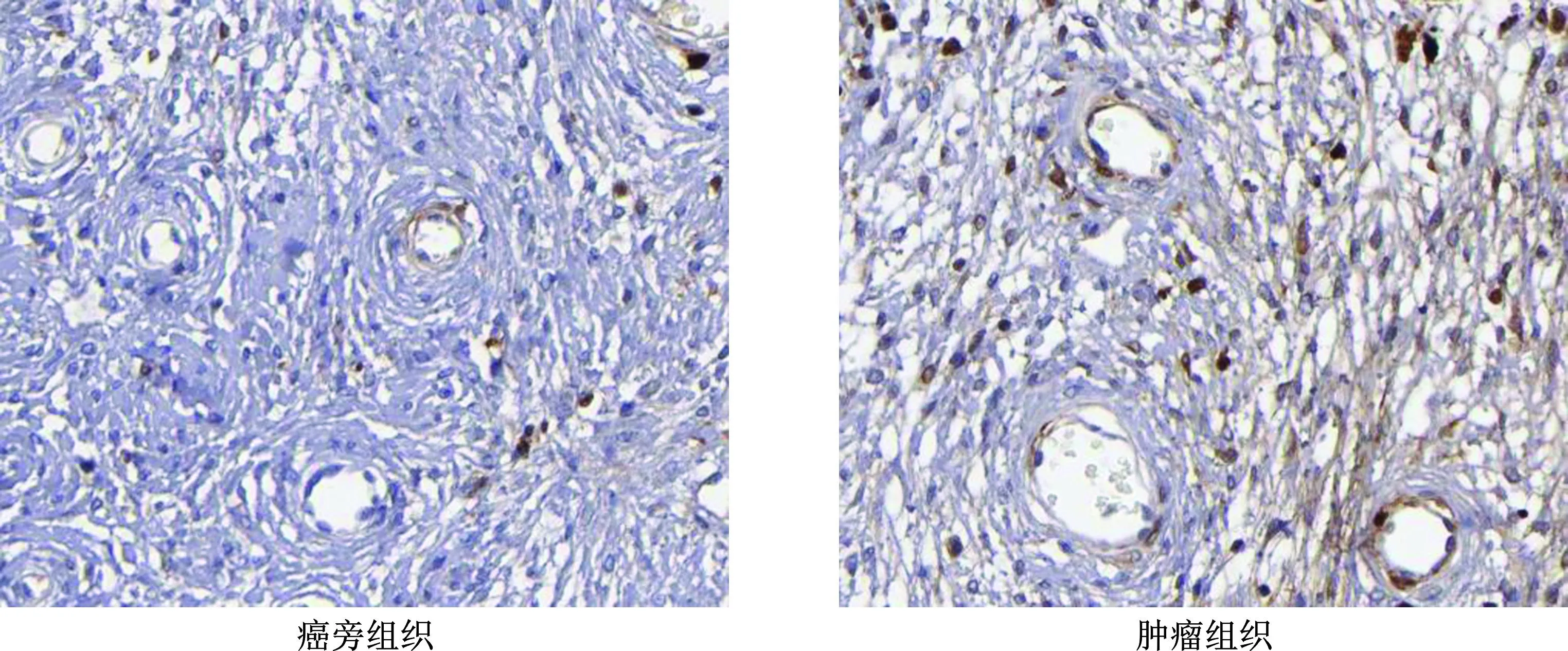
图2 免疫组化法检测癌旁组织与宫颈癌肿瘤组织中TRIM14蛋白表达(×400)
表1 癌旁组织与肿瘤组织中IGHG1、TRIM14蛋白表达水平比较
2.2 IGHG1、TRIM14蛋白表达水平与患者临床病理特征的关系
如表2所示,IGHG1、TRIM14蛋白表达水平与患者年龄、肿瘤直径、肿瘤病理类型、绝经、生育情况等无关(P>0.05);与TNM分期、肿瘤分化程度、淋巴转移有关(P<0.05)。

表2 IGHG1、TRIM14蛋白表达水平与患者临床病理特征的关系
2.3 预后良好组与预后不良组肿瘤组织IGHG1、TRIM14蛋白表达的比较
如表3和图3、4所示,预后不良的发生率为30.49%(25/82)。与预后良好组相比,预后不良组患者肿瘤组织中IGHG1、TRIM14蛋白表达水平显著升高(P<0.05)。
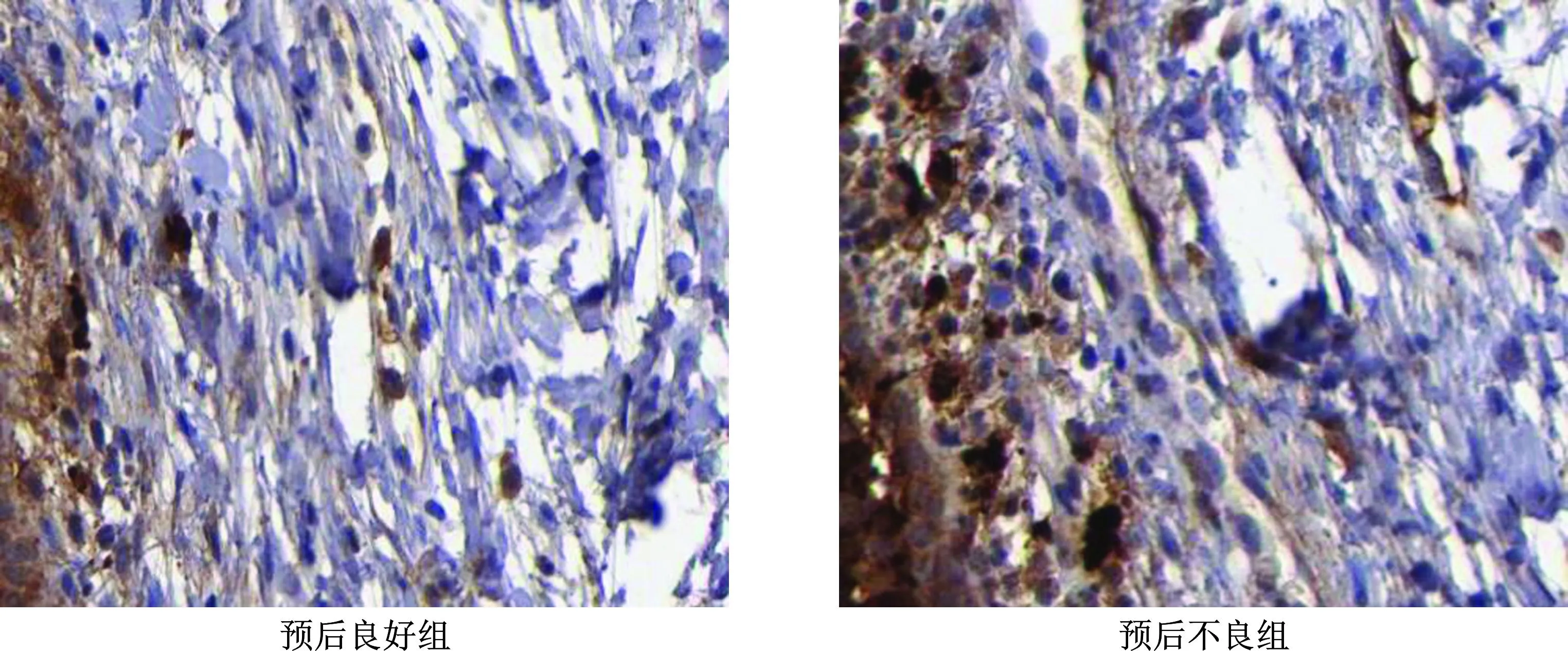
图3 免疫组化法检测预后良好组与预后不良组肿瘤组织中IGHG1蛋白表达(×400)
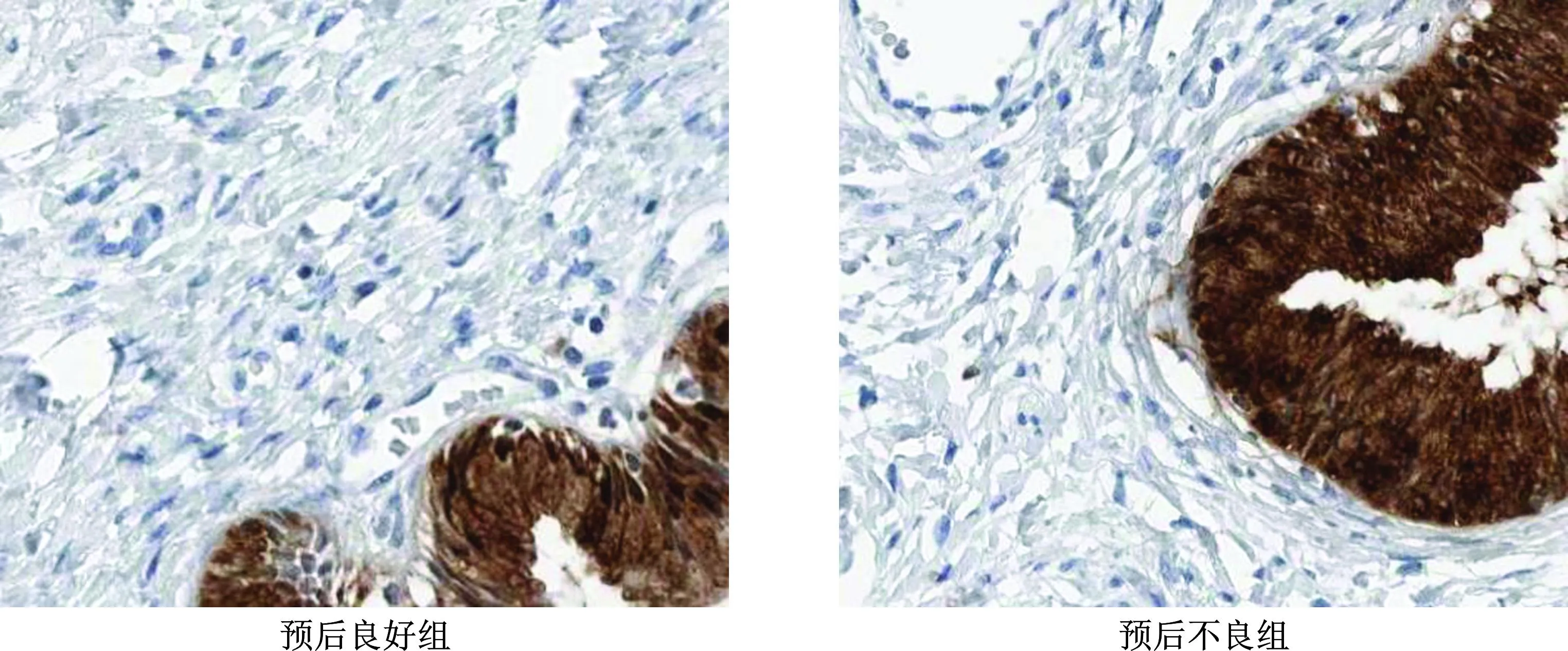
图4 免疫组化法检测预后良好组与预后不良组肿瘤组织中TRIM14蛋白表达(×400)

表3 预后良好组与预后不良组肿瘤组织中IGHG1、TRIM14蛋白表达水平比较
2.4 多因素Logistic回归分析宫颈癌患者预后的影响因素
以患者3年内是否死亡为因变量,以IGHG1、TRIM14蛋白表达水平为自变量进行多因素Logistic回归分析,结果显示,IGHG1、TRIM14是宫颈癌患者发生不良预后的危险因素(P<0.05),见表4、5。

表4 变量赋值方式
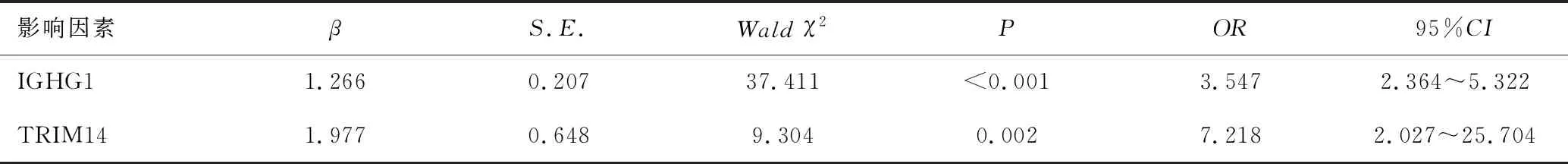
表5 多因素Logistic回归分析宫颈癌患者预后的影响因素
2.5 IGHG1、TRIM14蛋白表达水平对宫颈癌患者预后的价值分析
如表6和图5所示,IGHG1、TRIM14蛋白表达水平与二者联合预测宫颈癌患者预后的AUC分别为0.947、0.793与0.957,二者联合优于TRIM14蛋白单独预测(Z二者联合-TRIM14=2.383,P=0.017),与IGHG1蛋白表达水平单独预测预后的AUC相比无显著性差异(Z二者联合-IGHG1=1.089,P=0.276)。
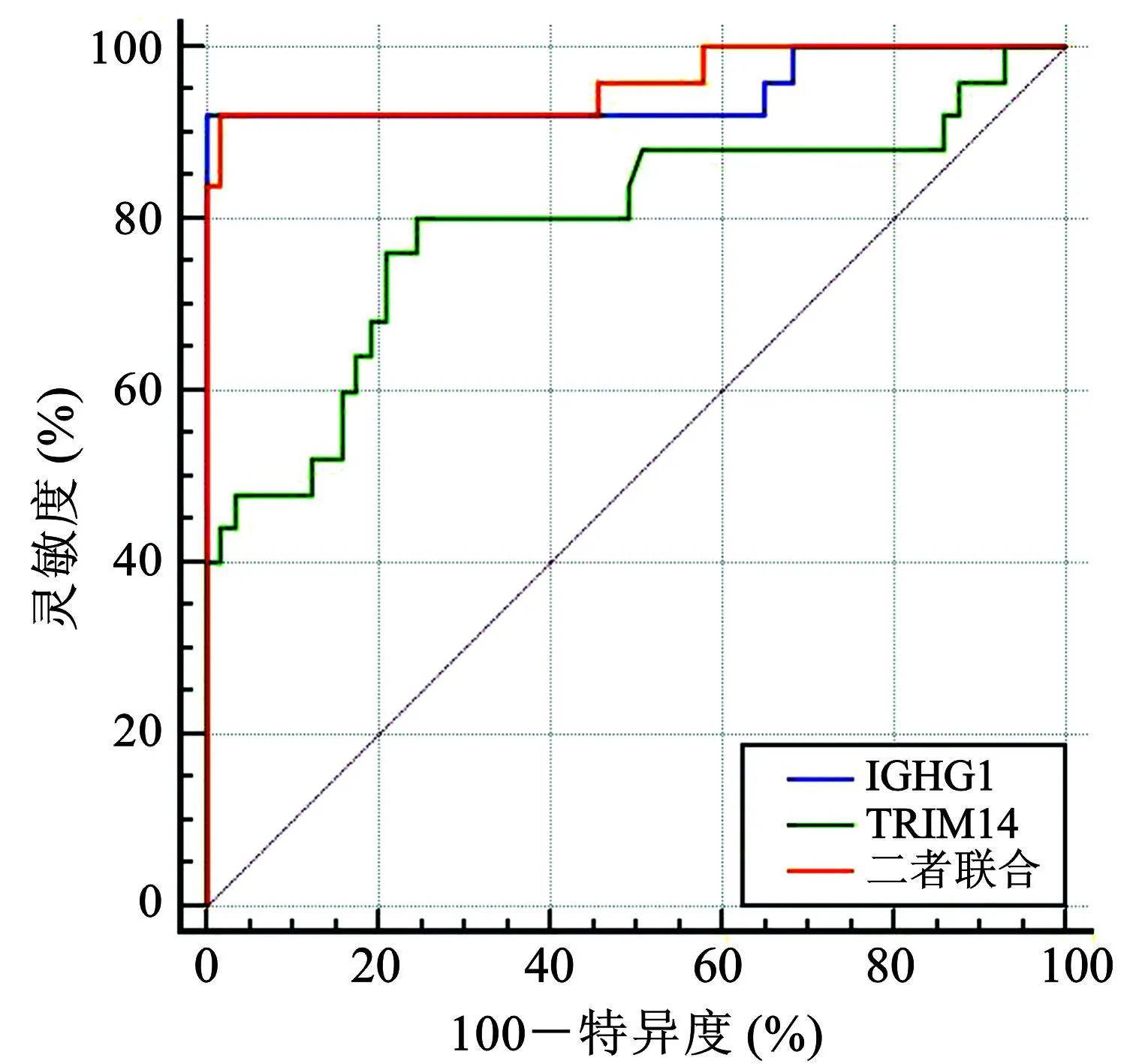
图5 肿瘤组织IGHG1、TRIM14蛋白表达水平预测宫颈癌患者预后的ROC曲线
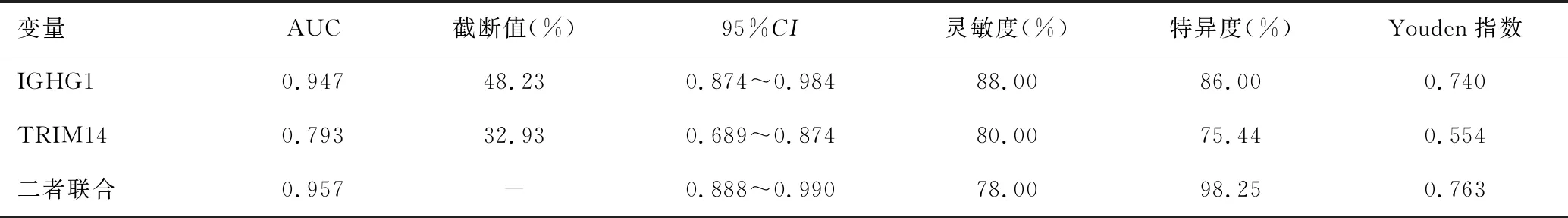
表6 肿瘤组织IGHG1、TRIM14蛋白表达水平对宫颈癌患者预后的价值分析
3 讨论
宫颈癌是妇科常见的三大恶性肿瘤之一,全球每年的宫颈癌病例高达50万,中国确诊人数占全球的25%,严重威胁着女性的生命健康[11]。宫颈癌通常在中晚期被确诊,5年生存率为66%,晚期的存活率仅为17%[12]。宫颈癌患者临床结局差异较大,若不及时进行干预,患者发生不良预后的可能性将会增加,对提高患者存活率带来不利影响。因此,寻找分子标志物来准确评估宫颈癌患者的预后具有重要的临床意义。
3.1 IGHG1在宫颈癌中的表达
IgG存在于多种上皮来源的肿瘤细胞如肺癌、肝癌、乳腺癌等中,而IGHG1是位于14号染色体的一种蛋白质编码基因,是IgG的一种亚型[13]。有证据表明,IGHG1在许多癌细胞中异常表达,且其异常表达与肿瘤的发生发展息息相关[14]。Li等[15]研究发现IGHG1在胃癌组织和细胞中表达明显升高,且IGHG1能作为癌基因促进胃癌细胞增殖、迁移和化疗耐药。Jin等[16]研究发现沉默IGHG1减弱了乳腺癌细胞的活力、侵袭、上皮间质转化,增强了其凋亡的能力,IGHG1能通过激活AKT途径促进乳腺癌的恶性发展。吴遥西等[17]研究发现沉默IGHG1基因后,膀胱癌EJ细胞的增殖和迁移水平降低,细胞凋亡率增加。本研究结果显示,与癌旁组织相比,宫颈癌患者肿瘤组织IGHG1蛋白表达显著升高;对宫颈癌患者进行预后价值分析结果显示,预后不良组宫颈癌患者肿瘤组织IGHG1蛋白表达显著高于预后良好组宫颈癌患者。对临床病理特征进行比较发现,IGHG1蛋白表达水平与患者与TNM分期、肿瘤分化程度、淋巴结转移有关。这些结果提示IGHG1可能参与宫颈癌的发生发展,对宫颈癌的进展具有促进作用,且其水平升高可提示患者发生不良预后的风险增加。
3.2 TRIM14在宫颈癌中的表达水平及临床意义
TRIM14是TRIM的家族成员,位于染色体9q22,已有大量研究证明其在肝癌、结肠癌、乳腺癌等肿瘤组织中表达上调,促进肿瘤增殖、迁移、侵袭、耐药等一系列恶性生物学行为[18]。Hu等[19]研究发现TRIM14在乳腺癌组织和细胞系中表达上调,沉默TRIM14的表达可抑制细胞增殖,促进细胞凋亡,说明TRIM14能作为乳腺癌癌基因促进肿瘤进展。Chen等[20]研究发现TRIM14在结直肠癌中表达显著上调,且与患者的不良预后呈正相关,能够促进结直肠癌细胞的增殖、迁移、侵袭等过程。余道武等[21]研究发现胰腺癌组织中TRIM14的表达异常升高,且与患者的临床病理特征与预后相关,可以作为预后的评估指标。本研究结果显示,与癌旁组织相比,宫颈癌患者肿瘤组织TRIM14蛋白表达水平显著升高;与预后良好组相比,预后不良组宫颈癌患者肿瘤组织TRIM14蛋白表达水平显著升高,且其表达与TNM分期、肿瘤分化程度、淋巴结转移有关。这些结果说明TRIM14与宫颈癌的病情进展有密切关系,且水平升高提示病情严重,预后较差。
本研究ROC曲线分析显示,肿瘤组织IGHG1与TRIM14蛋白表达水平联合评估宫颈癌患者预后的AUC为0.957,优于TRIM14单独预测宫颈癌患者预后的AUC。多因素Logistic回归分析结果显示,IGHG1与TRIM14是宫颈癌患者发生不良预后的危险因素。这些结果说明IGHG1与TRIM14蛋白表达水平对宫颈癌患者预后预测具有一定价值。
综上所述,宫颈癌患者肿瘤组织中IGHG1和TRIM14蛋白高表达,其与宫颈癌患者预后有关,可能是宫颈癌预后评估的生物标志物。然而,本研究还存在不足之处,IGHG1和TRIM14对宫颈癌病情进展的影响机制还尚未明确,还需进一步研究。

