外源氨基酸对层出镰刀菌菌丝生长和伏马毒素合成的影响
梁文豪 胡时开 圣忠华 魏祥进 焦桂爱 邵高能 谢黎虹 王玲 唐绍清 胡培松
(中国水稻研究所/水稻生物育种全国重点实验室,杭州 310006;*通信作者:wangling03@caas.cn;tangshaoqing@caas.cn;peisonghu@126.com)
水稻穗腐病是由层出镰刀菌(Fusarium proliferatum)为主侵染引起的一种真菌病害[1]。被病原菌感染后的稻穗籽粒灌浆受阻,导致产量降低5%~10%,严重时达30%以上[2]。近年来,由于秸秆还田措施的实施,水稻穗腐病蔓延迅速,在我国呈现逐年加重的趋势,已经成为水稻生育后期的主要病害之一。层出镰刀菌不仅为害玉米、水稻和小麦等多种粮食作物[3],而且在侵染寄主时还会产生有毒的次级代谢产物,其中伏马毒素具有较强的毒性和致癌能力,长期误食该毒素容易引起人食管癌[4]。伏马毒素被认为是层出镰刀菌侵染水稻的毒性因子[5]。
氨基酸是含有羧基和氨基的有机化合物,参与蛋白质合成、信号传导和能量平衡等生理生化过程。已有研究证明,氨基酸代谢在植物病原真菌的生长发育、孢子形成和侵染宿主能力中发挥了重要作用[6-7]。氨基酸合成受阻的突变体会产生多种表型缺陷,尤其是在生活力方面。在禾谷镰孢菌(Fusarium graminearum)中,亮氨酸合成途径中MoLEU1基因缺失导致菌体生长缓慢、产孢量减少、致病力下降以及合成脱氧雪腐镰刀烯醇(deoxynivalenol,DON)能力丧失[6]。在稻瘟病菌(Magnaporthe oryzae)中,苏氨酸合成途径中MoIlv1基因缺失会抑制菌丝生长、孢子萌发、附着孢形成和寄主致病力[7]。为了探明层出镰刀菌与外源氨基酸吸收利用之间的关系,本研究分析和评价了4 种L-氨基酸对层出镰刀菌菌丝生长和伏马毒素合成的影响,旨在为水稻穗腐病防治和毒素污染治理提供科学依据。
1 材料与方法
1.1 供试材料
层出镰刀菌Fp9 菌株:经田间水稻穗腐病自然感病样品中分离纯化获得。试验于2022 年在人工培养箱中进行。
1.2 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯200 g,葡萄糖20 g,琼脂18 g,加水定容至1 L。马铃薯葡萄糖培养基(potato dextrose broth,PDB):马铃薯200 g,葡萄糖20 g,加水定容至1 L。基本培养基(minimal medium,MM):蔗糖30 g,NaNO32 g,KH2PO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,微量元素200 μL[每100 mL 含有Citric acid 5 g,ZnSO4·7H2O 5 g,FeSO4·7H2O 4.75 g,Fe (NH4)2(SO4)2·6H2O 1 g,CuSO4·5H2O 250 mg,MnSO4·H2O 50 mg,H3BO350 mg,Na2MoO4·2H2O 50 mg],pH 6.9,加水定容至1 L。MM 固体培养基:在MM 液体培养基中加入20 g/L 琼脂粉。
1.3 主要试剂
L-精氨酸(arginine,Arg)、L-谷氨酸(glutamate,Glu)、L-脯氨酸(proline,Pro)、L-瓜氨酸(citrulline,Cit),购自北京索莱宝生物科技有限公司。
1.4 菌株生长测定
将层出镰刀菌Fp9 菌株置于PDA 培养基上活化,于28 ℃、黑暗条件下培养5 d 后,打取直径5 mm 的新鲜菌碟备用。在PDA 和MM 的固体培养基中分别添加4 种L-氨基酸(L-精氨酸、L-谷氨酸、L-脯氨酸和L-瓜氨酸),使其终浓度为6 mmol/L 和30 mmol/L。挑取上述新鲜菌碟分别转接到含有不同氨基酸的PDA 和MM固体培养基中,以不添加氨基酸为对照。于28 ℃、黑暗条件下培养4 d,观察菌落形态并拍照记录。采用十字交叉法,测量菌落直径。实验至少重复3 次。
1.5 伏马毒素含量测定
1.5.1 样品制备
将层出镰刀菌Fp9 菌株置于PDB 培养基中,于28℃、150 r/min 培养3 d,收集分生孢子悬浮液,将其浓度调整为106个/mL。在PDB 和MM 的液体培养基中分别添加4 种L-氨基酸(L-精氨酸、L-谷氨酸、L-脯氨酸和L-瓜氨酸),使其终浓度分别为6 mmol/L 和30 mmol/L。取1 mL 的孢子悬浮液分别接种到含有不同氨基酸的PDB 和MM 的液体培养基中,以不添加氨基酸为对照。于28 ℃、150 r/min 培养15 d,将菌丝过滤,收集发酵液。
1.5.2 伏马毒素检测
采用FD-100 型真菌毒素快速检测仪检测伏马毒素含量。取1 mL 发酵液于15 mL 离心管中,加入5 mL提取液[甲醇∶水=4∶1(V/V),含2%氯化钠]。用旋涡混合器振荡3 min,后静置5 min。将100 μL 上清液加入到1 mL 样品稀释液中,振荡混匀,取100 μL 滴至荧光定量快速检测卡的加样孔中。置于37 ℃恒温孵育器中温育8 min,将检测卡插入荧光免疫定量分析仪中读数。实验重复3 次。
1.6 伏马毒素生物合成基因表达量分析
1.6.1 样品收集
将层出镰刀菌Fp9 菌株置于PDB 培养基中,于28 ℃、150 r/min 培养3 d,收集菌丝。在MM 液体培养基中分别添加4 种L-氨基酸(L-精氨酸、L-谷氨酸、L-脯氨酸和L-瓜氨酸),使其终浓度分别为6 mmol/L 和30 mmol/L。将收集菌丝分装到含有不同氨基酸的MM液体培养基中,以不添加氨基酸为对照,于28 ℃、150 r/min培养3 h,收集菌丝。
1.6.2 基因表达分析
将菌丝于液氮中研磨至粉末,用EastepTMSuper Total RNA Extraction Kit (Promega) 提取样品中总RNA。按照ReverTraRT Master Mix with gDNA Remover 试剂盒(TOYOBO)去除基因组DNA,反转录制备cDNA。以合成的cDNA 为模板,利用THUNDERBIRDMix 试剂盒(TOYOBO)进行实时荧光定量PCR(qRT-PCR)反应。扩增反应体系:SYBR qPCR Mix 10 μL,正反向引物(10 μM)各1 μL,cDNA 模板50 ng,加ddH2O 至20 μL。反应程序:95 ℃预变性30 s;95 ℃10 s,60 ℃15 s,72 ℃30 s,共40 个循环。根据伏马毒素生物合成基因(fum)的cDNA 序列,使用Primer Premier 5.0 软件设计引物,引物序列见表1。选用β-tubulin为内参基因,以对照样品中基因的表达量为1,采用2-ΔΔCt法[8]分析靶标基因的相对表达量。每个样品重复3 次。

表1 荧光定量PCR 所使用的引物
1.7 数据统计与处理
实验数据采用Microsoft Excel 2007 进行处理,利用GraphPad Prism 8 软件进行统计分析,采用Student’st检测法(t-test)进行差异显著性分析,P<0.05 为差异显著,P<0.01 为差异极显著,P>0.05 为差异不显著。
2 结果与分析
2.1 不同氨基酸对层出镰刀菌菌丝生长的影响
从图1 和图2 可见,在PDA 培养基中,与未添加氨基酸的对照相比,不同氨基酸对菌丝生长的影响不一样。添加Arg,菌丝生长明显加快,气生菌丝旺盛,在6 mmol/L 和30 mmol/L 浓度时,菌丝生长速率分别比对照显著提高14.25%和21.37%。添加Pro 和Cit,在6 mmol/L 浓度时菌丝生长无明显变化,在30 mmol/L 浓度时菌丝生长速率分别提高了3.82%和3.56%。而添加Glu,菌丝生长速度减慢,气生菌丝变少,在6 mmol/L 和30 mmol/L 浓度时菌丝生长速率分别下降了8.65%和7.12%,且随着浓度增加菌株的黄色色素分泌增多。说明在PDA 培养基中,L-氨基酸参与层出镰刀菌的菌丝生长和色素积累。
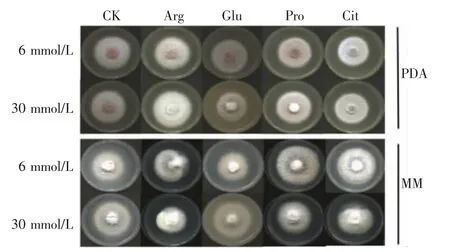
图1 添加L-氨基酸的PDA 和MM 固体培养基上层出镰刀菌的菌落形态
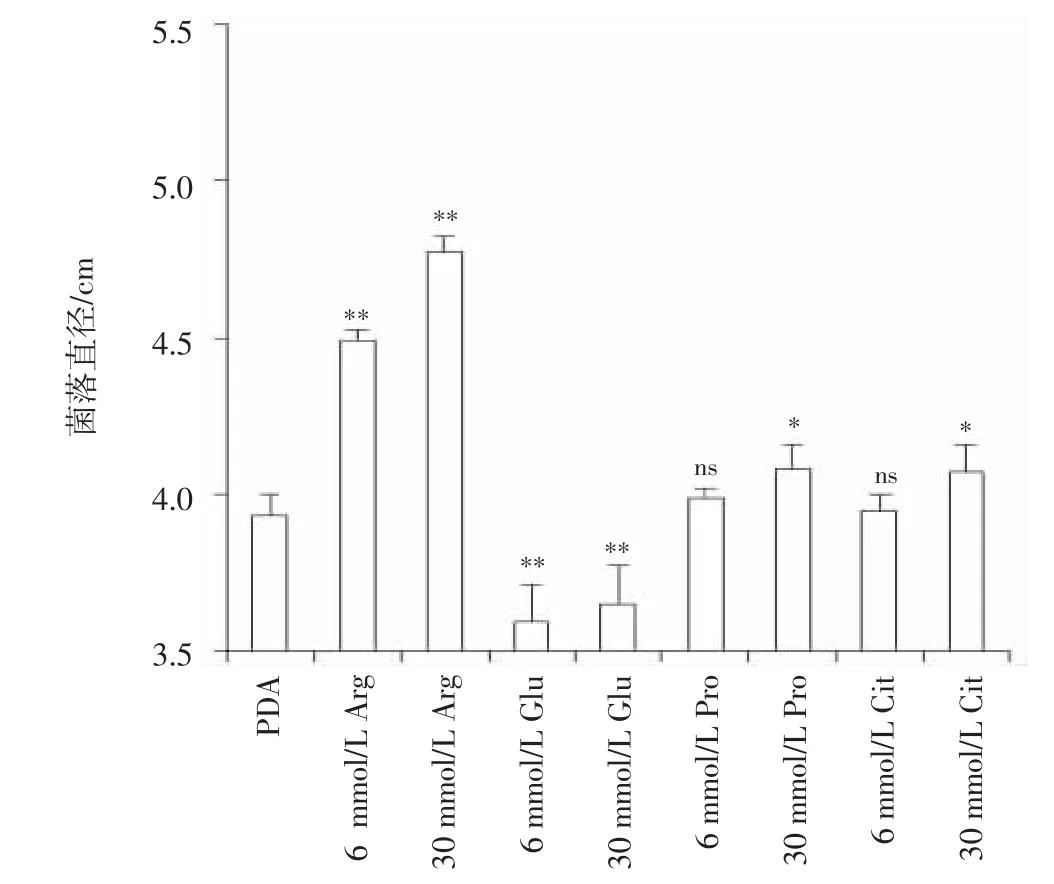
图2 添加L-氨基酸的PDA 培养基上层出镰刀菌的菌落直径
从图1 和图3 可见,在MM 培养基中,未添加氨基酸的对照中菌丝基本长满培养基表面,外源L-氨基酸添加后菌丝生长速率明显低于对照。添加Glu,其菌丝生长最慢,气生菌丝稀疏,颜色变淡,有黄色色素沉积,在6 mmol/L 和30 mmol/L 浓度时菌丝生长抑制率分别为21.55%和20.39%。添加Pro,菌丝老化速度快,高浓度的生长抑制率(15.34%)明显高于低浓度的生长抑制率(7.18%)。添加Arg,菌丝颜色较深,在6 mmol/L 和30 mmol/L 浓度时其抑制率分别为9.71%和6.60%。添加Cit,菌落中央凹陷,其对菌丝生长的抑制程度相对最弱。整体来看,在MM 培养基中,微量L-氨基酸对层出镰刀菌的菌丝生长具有明显的抑制作用。

图3 添加L-氨基酸的MM 培养基上层出镰刀菌的菌落直径
2.2 不同氨基酸对层出镰刀菌伏马毒素合成的影响
由表2 可见,在PDB 发酵培养液中,添加6 mmol/L和30 mmol/L 的L-氨基酸对伏马毒素积累具有明显的促进作用,且与对照间差异达到显著水平。以添加Arg的处理毒素积累最为明显,与对照相比分别提高8.08倍和7.39 倍;其次为添加Pro 的处理,分别提高8.55倍和5.38 倍;添加Cit 的处理分别提高7.07 倍和5.86倍,而添加Glu 的处理仅提高3.17 倍和0.30 倍。

表2 添加L-氨基酸的发酵培养液中层出镰刀菌的伏马毒素含量(单位:μg/L)
由表2 可见,在MM 发酵培养液中,外源添加不同浓度的L-氨基酸均显著增强了层出镰刀菌伏马毒素的合成能力。其中,添加Arg 后毒素含量分别增加2.63倍和4.03 倍,添加Glu 后分别增加3.50 倍和11.35 倍,添加Pro 后分别增加3.64 倍和5.58 倍,添加Cit 后分别增加6.72 倍和3.72 倍。
2.3 不同氨基酸对层出镰刀菌伏马毒素合成基因表达的影响
伏马毒素的合成主要依赖于伏马毒素生物合成途径中fum基因的转录水平,本研究进一步分析了添加L-氨基酸后层出镰刀菌的fum基因表达模式。由图4可知,添加Arg 后,大多数fum基因被诱导表达。当Arg浓度为6 mmol/L 时,除fum18基因表达量显著下调,其余fum基因的表达水平相对于对照均显著提高0.61~5.60 倍,其中fum17基因的表达水平上调最为明显;当浓度达到30 mmol/L 时,fum基因的相对表达量明显增加,除fum18基因表达量下调,其余fum基因的表达量比对照显著提高3.09~80.58 倍,其中fum1基因的表达水平上调最高。

图4 添加Arg 后伏马毒素生物合成基因的转录丰度
由图5 可知,添加Glu 后,层出镰刀菌fum基因的转录在很大程度上受到抑制,其相对表达量明显低于对照。当Glu 浓度为6 mmol/L 时,fum基因表达水平较对照显著下降50%~97%;当浓度为30 mmol/L 时,fum基因相对表达量下降43%~92%。其中,fum7基因表达水平最低,在6 mmol/L 和30 mmol/L 浓度处理中表达量较对照分别降低97%和92%。
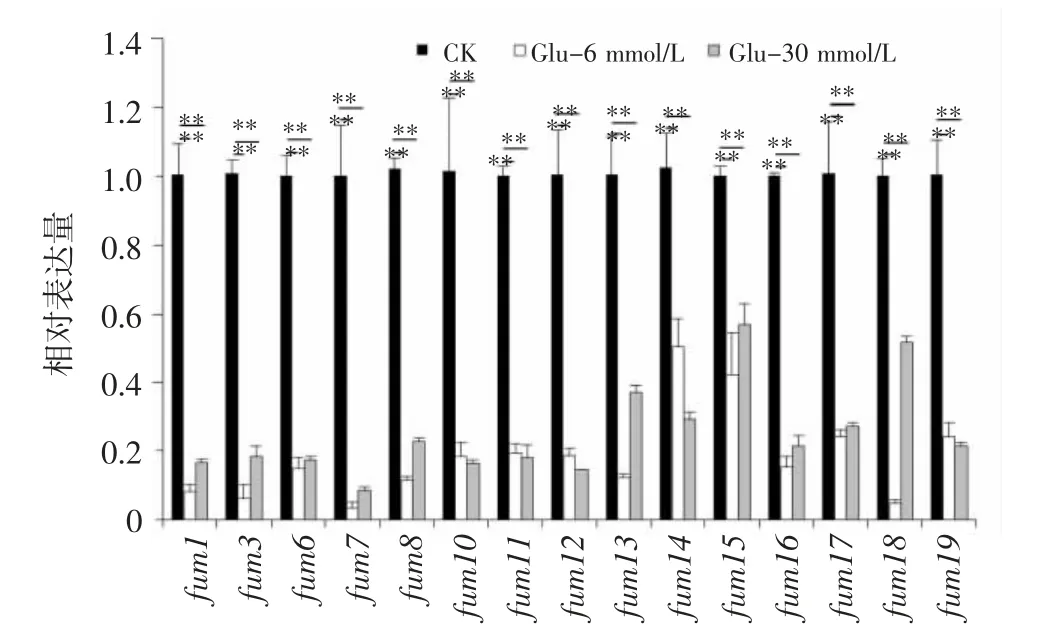
图5 添加Glu 后伏马毒素生物合成基因的转录丰度
由图6 可知,添加Pro 后,层出镰刀菌fum基因的表达水平发生显著变化。当Pro 浓度为6 mmol/L 时,所有fum基因的相对表达量都明显低于对照,显著下调61%~97%,其中fum1、fum6、fum8、fum12和fum16基因的表达水平较低;而当浓度为30 mmol/L 时,仅fum7基因和fum15基因表达量下调,fum18基因表达水平变化不明显,其余fum基因均比对照显著上调1.54~3.30倍,其中fum8、fum16和fum17基因的表达量分别比对照提高3.05、3.30 和3.27 倍。
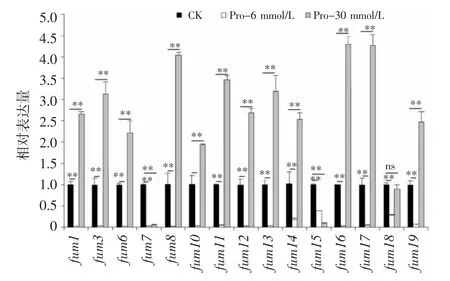
图6 添加Pro 后伏马毒素生物合成基因的转录丰度
由图7 可知,添加Cit 后,层出镰刀菌的大多数fum基因都具有较强表达水平,且在高浓度中的表达水平高于低浓度的表达水平。当Cit 浓度为6 mmol/L时,除fum7基因和fum18基因表达量明显降低外,其余fum基因表达量均比对照显著提高0.68~4.0 倍。在30 mmol/L 浓度处理中所有fum基因表达水平明显上调,比对照显著提高2.30~44.27 倍,其中fum17基因的表达水平上调最为明显。

图7 添加Cit 后伏马毒素生物合成基因的转录丰度
3 讨论与结论
在植物病原菌中,氨基酸不仅是营养吸收必不可少的,而且在其生长发育、逆境应答和致病过程中起到重要作用。如L-半胱氨酸对稻曲病菌(Villosiclava virens)[9]、葡萄链格孢菌(Alternaria alternata)[10]和李果实褐腐菌(Monilinia fructicola)[11]的菌丝生长均具有明显的抑制作用。添加甘氨酸可抑制尖孢镰孢菌古巴专化型(Fusarium oxysporumf. sp.cubense)厚垣孢子的诱导形成[12]。本研究通过L-氨基酸添加试验,综合分析其对层出镰刀菌菌丝生长的作用,发现不同氨基酸的组间存在较为明显的差异。在PDA 培养基中Arg、Pro 和Cit 作为营养物质,对层出镰刀菌菌丝生长有显著促进作用,而Glu 及MM 培养基中4 种氨基酸则不同程度抑制菌丝生长。不同氨基酸对菌丝生长分化差异的原因,一方面可能是由于细胞的生长代谢需要一定的碳氮比,而氨基酸和培养基成分作为有机氮源影响了这一比值。另一方面可能是由于氨基酸是许多代谢途径的中间产物或供体,其可能会对某些代谢途径产生反馈调节作用,造成代谢通路流向的改变,从而影响菌丝生长。
真菌毒素的生物合成除了受到产毒菌自身遗传因素的调控外,还受到多种环境因素的影响,如营养成分、温度、水活度和pH 值等[13]。其中,氮源物质的吸收与利用对真菌产毒影响较大。谷氨酰胺、天冬氨酰和丙氨酸等会促进黄曲霉毒素产生,而硝酸盐和亚硝酸盐则抑制黄曲霉毒素合成[14]。氨基酸性氮对真菌毒素合成的影响也有差别。与谷氨酸、硝酸钠、缬氨酸和蛋氨酸相比,酪氨酸更能促进DON 毒素产生[15]。本研究表明,氨基酸作为氮源,对层出镰刀菌的伏马毒素合成具有明显的促进作用。比如,在MM 培养基中添加30 mmol/L的Arg,伏马毒素含量比对照显著提高4.03 倍,fum合成基因簇整体上调表达3.09~80.58 倍,其中fum1基因表达水平提高80.58 倍。fum1基因编码一个聚酮合酶,在伏马毒素的生物合成途径中起关键作用,负责生成19 个碳原子的直链碳骨架。因此,本研究认为外源氨基酸可能是通过控制菌体的形态发育,介导fum基因的转录表达而决定伏马毒素的产量。但是,fum基因的表达量因氨基酸种类不同而有所差异,与氨基酸浓度的高低也并非呈正相关性,不同氨基酸的具体功能尚需进一步探究。伏马毒素含量的提高,增强了层出镰刀菌的致病性,从而加重水稻穗腐病的发生。鉴于氨基酸在层出镰刀菌的菌丝生长和伏马毒素合成中的作用,其生物合成途径中一些酶有望作为杀菌剂靶标,对于有效控制水稻穗腐病具有重要意义。

