中性粒细胞与淋巴细胞比值对缺血性卒中相关性肺炎的预测价值
张婷婷, 于明
(江苏大学附属医院神经内科, 江苏 镇江 212001)
急性缺血性脑卒中(acute ischemic stroke,AIS)是最常见的卒中类型,占急性脑卒中69.6%~70.8%[1-2]。卒中相关性肺炎(stroke-associated pneumonia,SAP)是AIS最常见的并发症之一,发病率为7.0%~38.0%[3]。SAP定义为非机械通气的卒中患者在发病7 d内新出现的肺炎[4]。研究表明,SAP致卒中患者预后不佳,导致其住院时间延长且死亡风险和医疗费用增加[5]。SAP可能与多种因素相关,如年龄、卒中严重程度、意识水平以及慢性阻塞性肺疾病等[6]。预测SAP的模型已建立多种,如年龄、心房颤动、吞咽困难、性别、卒中严重程度(age,atrialfibrillation,dysphagia,sex,stroke severity,A2DS2)评分[7]和急性缺血性卒中相关肺炎风险评分(acute ischemic stroke-associated pneumonia score,AIS-APS)[8]等,但多是基于临床表现,评分项目多且复杂,影响评分方法的准确性。中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)是一种易获得的炎症指标,反映全身的免疫炎症状态,其升高与血管疾病的恶化相关[9]。近年来,多项研究表明,NLR升高与患者卒中后不良结局相关[10-11]。目前,关于NLR对SAP的预测价值尚不清楚。因此,本研究拟对2021年2月至2022年6月江苏大学附属医院神经内科收治的AIS患者进行回顾性研究,分析SAP的危险因素,评价NLR对SAP的预测意义。
1 资料与方法
1.1 研究对象
选择2021年2月至2022年6月江苏大学附属医院神经内科收治的AIS患者。纳入标准:病历资料完整;符合脑卒中诊断标准(依据《中国急性缺血性脑卒中诊疗指南》中的临床诊断标准[1]:急性起病的局灶性神经功能缺损且影像学出现责任病灶或症状/体征持续24 h以上,排除非血管性病因且脑CT/MRI排除脑出血);出现卒中症状7 d内住院。排除标准:合并急性颅脑损伤;痴呆患者;既往严重残疾或脑卒中后遗症影响美国国立卫生院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分;有吞咽困难及长期留置鼻胃管史;合并恶性肿瘤;严重脏器功能障碍者;合并血液系统疾病,影响血细胞计数;最近3个月内使用免疫抑制剂或皮质类固醇;卒中发病前2周内有活动性感染或使用预防性抗生素。本研究经医院医学伦理委员会批准且患者家属均知情同意。
1.2 资料收集
收集患者的基本信息包括年龄、性别、体质量指数(body mass index,BMI),临床资料包括既往病史(高血压、糖尿病、高脂血症、心房颤动、慢性阻塞性肺疾病),脑梗死部位(前循环、后循环),TOAST分型(大动脉粥样硬化、心源性栓塞、小动脉闭塞、其他病因、原因不明型),入院时NIHSS评分,是否存在意识障碍,吞咽障碍,入院后7 d内是否发生SAP,住院天数。此外,收集所有患者入院后首次实验室检测结果,包括NLR、空腹血糖、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、血尿酸和血同型半胱氨酸。
1.3 SAP诊断标准
根据卒中患者是否合并SAP,将患者分为SAP组和非SAP组。SAP诊断标准[4]:新发或加重的咳嗽、咳痰或呼吸困难;发热(体温≥38 ℃);外周血白细胞减少(<4.0×109/L)、升高(>10.0×109/L);听诊肺部湿啰音;胸部影像学异常(新出现或进展的肺部浸润性病变)。
1.4 统计学方法
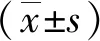
2 结果
2.1 两组一般临床资料比较
共纳入符合条件的患者234例,其中,SAP组73例,非SAP组161例。与非SAP组相比,SAP组患者年龄较大、住院时间延长,NIHSS评分、NLR和空腹血糖较高(P均<0.01);此外,与非SAP组相比,SAP组患者既往并发心房颤动比例较高(P<0.01),入院时意识障碍及吞咽障碍发生率较高(P<0.01)。两组间其他临床参数差异无统计学意义(P>0.05)。见表1。
2.2 SAP危险因素的多因素logistic回归分析
将单因素分析中P<0.05因素纳入多因素logistic回归分析,结果显示,年龄、住院时间、NLR、NIHSS评分和吞咽障碍是SAP的独立危险因素(P<0.05)。见表2。

表2 多因素logistic回归分析SAP危险因素
2.3 NLR对SAP的预测价值
ROC曲线分析结果显示,NLR预测SAP的曲线下面积为0.758(P<0.05),NLR对SAP有一定的预测能力,最佳临界值为3.962,敏感度为0.699,特异性为0.770。见图1。

图1 NLR预测SAP的ROC曲线
3 讨论
缺血后的炎症反应是涉及诱导多种炎症细胞活化的复杂过程。缺血组织募集外周循环中性粒细胞,且淋巴细胞在卒中后数天浸润缺血区域[12]。研究表明,一些特定的淋巴细胞亚型是AIS后的脑保护调节剂[13]。由此可见,中性粒细胞和淋巴细胞可能介导缺血性卒中后不同的炎症反应,并对患者的临床转归产生不同的影响[13]。本研究发现,与非SAP组相比,SAP组NLR值更高,提示中性粒细胞和淋巴细胞可能在卒中后肺炎的发生中起重要作用。
近年来一些研究发现[14-17],NLR与卒中关系密切,不仅与卒中后神经功能恶化相关,还对卒中患者预后具有一定的预测作用。本研究结果显示,SAP组NLR明显高于非SAP组,与Nam等[18]研究结果相似,与之不同的是,本研究基于中国人群,且ROC曲线分析显示,NLR对SAP具有一定的预测价值。
NLR与SAP之间的密切关系可能与卒中性免疫抑制综合征有关[19]。首先,中性粒细胞通过释放中性粒细胞胞外诱捕网在肺内形成血块并激活炎症反应,导致肺组织损伤。其次,中性粒细胞中丰富的蛋白酶进一步破坏肺组织,包括髓过氧化物酶和中性粒细胞弹性蛋白酶[20]。其中,髓过氧化物酶可通过增强氧化应激和引起DNA损伤诱导常驻肺细胞损伤,最终引起人肺上皮细胞的促炎反应;中性粒细胞弹性蛋白酶可能破坏呼吸道上皮细胞结构,且造成局部黏蛋白分泌增多,进一步促进气道阻塞[20]。淋巴细胞计数增加可能与卒中患者预后较好、并发症发生率较低相关,增加的淋巴细胞可调节中性粒细胞的活性,防止炎症过度反应,从而降低肺部感染的风险[21]。因此,当中性粒细胞增加、淋巴细胞减少,即NLR升高,可能会导致免疫抑制。此外,NLR较高的患者可能有更多的SAP危险因素[16]。研究表明,NLR与多种慢性代谢性疾病相关,如高血压、糖尿病,其中多种疾病也是已知的SAP危险因素[18]。本研究结果还显示,对于预测SAP的最佳NLR值为3.962,比Wang等[5]研究发现的最佳临界值(3.745)高,未来可能需要进一步扩大样本量来确定预测SAP的最佳NLR值。
同时,本研究发现,与非SAP组比较,SAP组患者年龄较大,入院时NIHSS评分较高,脑卒中症状较重,住院时间延长,这与以往Tinker等[22]研究结果相似。SAP组年龄偏大一方面是由于年龄增加造成免疫功能降低;另一方面,老年患者呼吸系统屏障功能下降,咳嗽反射减弱,致误吸风险增加[23]。NIHSS评分高的卒中患者往往病情较重(常合并意识障碍、吞咽困难),留置鼻胃管的概率增加,卧床较多,无法锻炼身体,可能更容易导致感染[23]。本研究结果还提示,与非SAP组相比,SAP组吞咽障碍及意识障碍发生比例更高。多项研究表明[23-25],吞咽困难是SAP的独立危险因素。有吞咽困难的脑卒中患者容易误吸,引起吸入性肺炎。Eltringham等[26]研究发现,鼻饲治疗可能通过促进口咽部细菌定植或误吸进一步增加肺部感染风险。因此,脑卒中后吞咽困难的早期诊断有助于减少肺部并发症。SAP组患者意识障碍比例高是由于病情重、脑功能障碍,抵抗力下降,咳嗽反射下降,排痰能力减弱,造成吸入物、分泌物坠积[27]。此外,本研究仅对NLR这一指标进行了ROC曲线分析,后续有待纳入其他预测模型进行预测价值比较。
综上所述,急性缺血性卒中患者发生SAP与多种危险因素相关,其中高NLR是独立危险因素,对于SAP的发生具有一定的预测价值。

