生存素与细胞分裂周期相关蛋白5在胃癌及胃间质瘤中的表达及其临床意义
包洁, 高小姣, 韩玮, 王庆华
(江苏大学附属昆山医院1. 消化内科, 2. 病理科, 3. 普外科, 江苏 昆山 215300)
近年来,由于生活方式与饮食方式的改变,消化道肿瘤发病率呈上升趋势,其中,胃癌与胃间质瘤是最常见的两种胃肿瘤[1-2]。胃癌是来源于胃黏膜上皮细胞的恶性肿瘤,胃间质瘤则是来源于间叶组织的肿瘤,故两者肿瘤性质、恶性程度及预后截然不同[3-4]。虽然将胃间质瘤定义为交界性肿瘤,但其仍有恶性特征,危险程度与核分裂象较高者复发风险也随之增加,严重影响患者预后[5]。研究表明,参与胃癌发生发展的部分重要癌基因,同样也参与胃间质瘤的发生且致患者预后不佳[6-7]。生存素是凋亡抑制蛋白家族重要成员之一,同时在胃癌与胃间质瘤的发生中起重要作用[8-9]。然而,单独检测生存素表达并不能充分评估胃癌与胃间质瘤的临床病理[10-11]。因此,本研究通过数据库挖掘出与生存素表达密切相关的细胞分裂周期相关蛋白5(cell division cycle associated protein 5,CDCA5),并拟用免疫组化进一步确认两者在评估胃癌与胃间质瘤的临床病理中的价值,并通过数据库预测两者共表达可能的机制以及相互作用关系。
1 材料与方法
1.1 数据库分析
首先,利用GEPIA(Gene Expression Profiling Interactive Analysis)数据库(http://gepia.cancer-pku.cn/)检索生存素的编码基因BIRC5(baculoviral IAP repeat containing 5)与CDCA5在胃癌组织与癌旁组织中的表达差异,并应用Spearman相关检验分析两者相关性;然后,在该数据库中,分析与BIRC5mRNA表达相关度最强的前十个基因。其次,采用PROMO数据库(http://alggen.lsi.upc.es/recerca/frame-recerca.html)预测人组织中可能作用于CDCA5与BIRC5启动子(-2 000 bp)的转录因子,查询是否有共同的转录因子,探寻可能的共表达机制。接着,利用HDOCK预测生存素蛋白与CDCA5蛋白之间的相互作用,根据分子直径,将生存素设定为受体,CDCA5为配体,根据两者相互作用评分,选取前三模拟构建结合区域示意图,并分析相互作用位点数。
1.2 组织样本
收集从2015年1月至2021年1月于江苏大学附属昆山医院普外科行胃癌根治术或胃肿瘤切除术获取的胃癌组织(76例)、胃间质瘤组织(63例)及距肿瘤边缘5 cm对应的癌旁/瘤旁组织。其中,胃癌患者男34例,女42例,平均年龄(64.55±12.88)岁;胃间质瘤患者男31例,女32例,平均年龄(62.59±11.26)岁。所有胃癌与胃间质瘤患者临床及病理资料完整,包括性别、年龄、肿瘤直径、分化程度、淋巴管侵犯、TNM分期、核分裂象、NIH危险度分级及病理类型等。本研究获得江苏大学附属昆山医院伦理委员会批准,并获得患者知情同意。
1.3 主要试剂和仪器
SP Rabbit &Mouse HRP试剂盒购自北京康为世纪生物科技有限公司;生存素兔多克隆抗体和CDCA5兔多克隆抗体购自北京博奥森生物技术有限公司;苏木素染色液购自美国Sigma公司。
医用天平购自上海第二天平仪器厂;倒置显微镜购自日本Nikon公司;医用切片机购自上海阿兵食品机械有限公司;医用烤片机、电热恒温烘烤箱购自上海跃进医疗器械一厂。
1.4 免疫组化检测生存素与CDCA5表达
取“1.2”中收集的胃癌、胃间质瘤及对应的癌旁/瘤旁组织石蜡切片,行免疫组化染色。① 脱蜡水化:二甲苯透明3次(分别10 min、5 min和3 min),无水乙醇5 min,90%乙醇、80%乙醇、70%乙醇各3 min,水洗1 min;② 抗原修复:枸橼酸钠高压锅煮沸20 min;③ 封闭:PBS冲洗3次,加过氧化物酶孵育10 min;④ 一抗孵育:PBS冲洗3次,滴加一抗工作液4 ℃孵育过夜;⑤ 二抗孵育:PBS冲洗3次;滴加HRP标记的链霉亲和素孵育30 min;⑥ DAB显色:PBS冲洗3次,滴加DAB孵育8 min,PBS冲洗后用蒸馏水终止染色;⑦ 复染、脱水、封片:苏木素复染1 min,经70%乙醇、80%乙醇、90%乙醇、无水乙醇浸泡各3 min,二甲苯浸泡5 min,封片。生存素兔多克隆抗体和CDCA5兔多克隆抗体为一抗,用PBS将一抗稀释为1∶250混合液,并用PBS作为阴性对照。
采用免疫反应积分(immunoreactive score,IRS)法分析染色结果,包括染色强度评分(intensity score,IS)与染色细胞比例评分(proportion score,PS)。其中,IS为0分,无染色;1分,轻微染色;2分,适度染色;3分,深度染色。PS为0分,0%;1分,1%~25%;2分,26%~50%;3分,51%~75%;4分,76%~100%。IRS=IS×PS,并设IRS≥4分为阳性表达,即至少有26%适度染色或76%轻微染色才能列入阳性表达,反之为阴性表达[12]。每个IRS均由两名病理专业医师评估,任何分歧通过讨论来解决。
1.5 统计分析
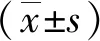
2 结果
2.1 BIRC5与CDCA5在胃癌中的表达
GEPIA数据库分析显示,BIRC5mRNA和CDCA5mRNA在胃癌组织中的表达均明显高于正常胃组织(P<0.01,图1A),且两者在胃癌组织中的表达呈正相关(r=0.79,P<0.01,图1B)。此外,与BIRC5mRNA表达密切相关的前十个分子分别为CDCA5(r=0.79)、KIFC1(r=0.79)、KPNA2(r=0.77)、TK1(r=0.77)、ALYREF(r=0.75)、CENPA(r=0.74)、MRPL38(r=0.73)、TACC3(r=0.72)、CDCA4(r=0.72)和CENPM(r=0.71);其中,CDCA5与其相关性最强。
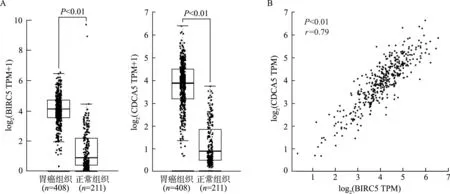
TPM:每百万转录本;A:胃癌组织和正常组织中BIRC5 mRNA与CDCA5 mRNA表达水平比较;B:胃癌组织中BIRC5 mRNA与CDCA5 mRNA表达相关性
2.2 生存素与CDCA5在胃癌及胃间质瘤中的表达
免疫组化结果显示,在胃癌和胃间质瘤中,生存素与CDCA5均在细胞核与细胞质中表达(图2A),两者表达量均明显高于对应癌旁/瘤旁组织(P均<0.001,图2B和2C)。在胃癌及胃间质瘤中,生存素与CDCA5表达均呈一定的正相关(r胃癌=0.410,P<0.001;r胃间质瘤=0.347,P<0.05;图2D)。
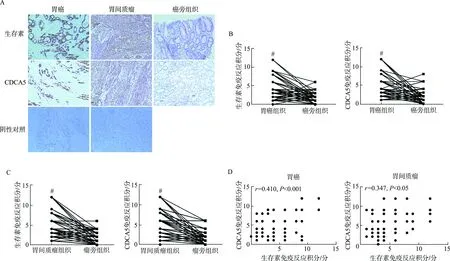
#:P<0.001,与对应的癌旁/瘤旁组织相比;A. 光学显微镜下观察(×100);B. 胃癌与癌旁组织中生存素与CDCA5表达差异;C. 胃间质瘤与瘤旁组织中生存素与CDCA5表达差异;D. 胃癌与胃间质瘤中生存素与CDCA5蛋白表达相关性
2.3 生存素和CDCA5表达与胃癌、胃间质瘤患者临床病理参数相关性分析
在76例胃癌患者中,生存素阳性43例,CDCA5阳性40例。由表1可见,生存素表达与肿瘤直径、淋巴管侵犯及TNM分期相关(P均<0.05),而与年龄、性别及分化程度无关(P均>0.05);CDCA5表达与肿瘤分化程度、TNM分期相关(P均<0.05),而与年龄、性别、肿瘤直径及淋巴管侵犯无关(P均>0.05)。
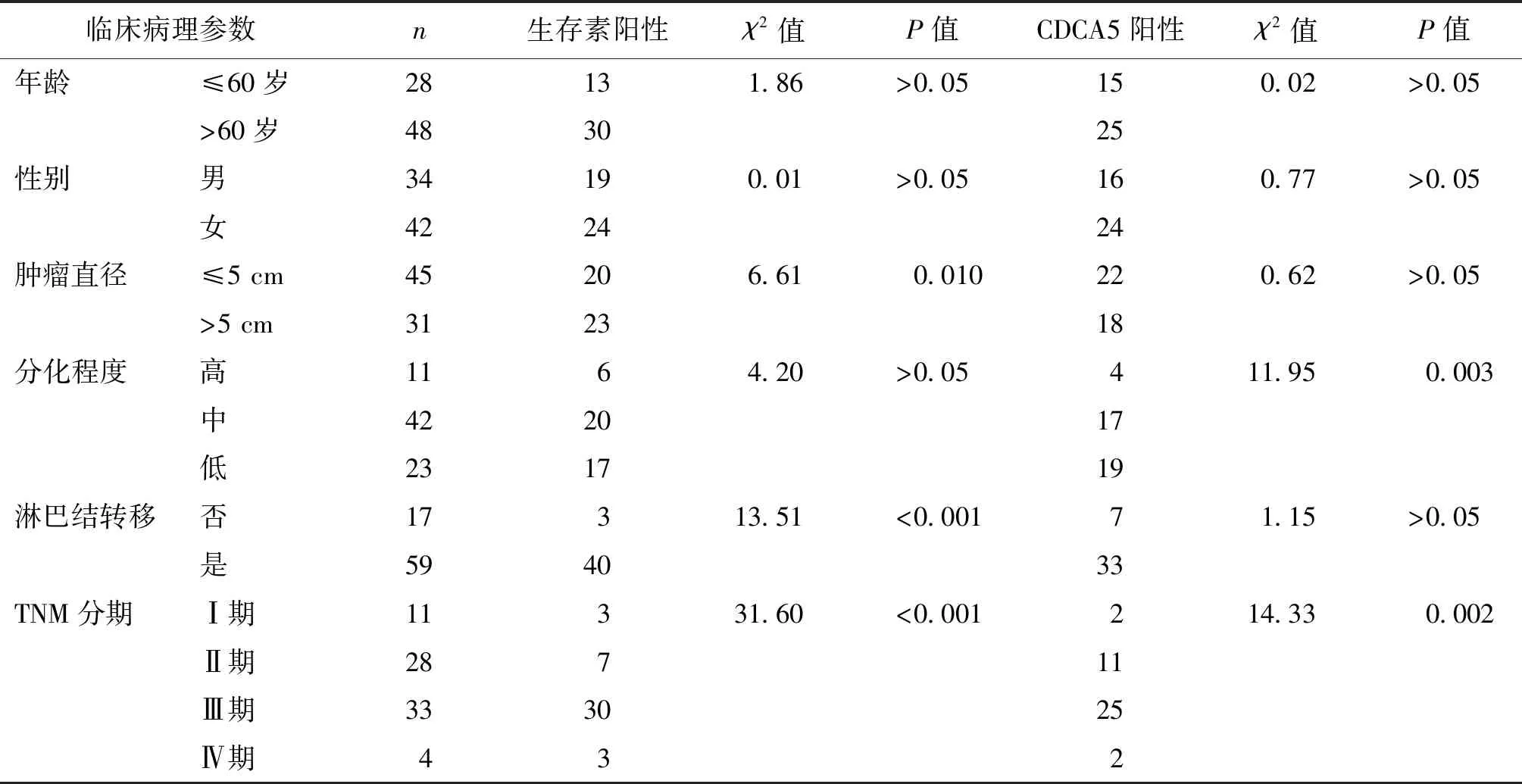
表1 生存素与CDCA5在胃癌中的阳性表达及其与临床病理参数的相关性
在63例胃间质瘤患者中,生存素阳性40例,CDCA5阳性39例。由表2可见,生存素表达与核分裂象及NIH危险度分级相关(P均<0.05),而与年龄、性别、肿瘤直径及病理学分类无关;CDCA5表达与肿瘤直径及NIH危险度分级相关(P均<0.05),而与年龄、性别、核分裂象及病理学分类无关。
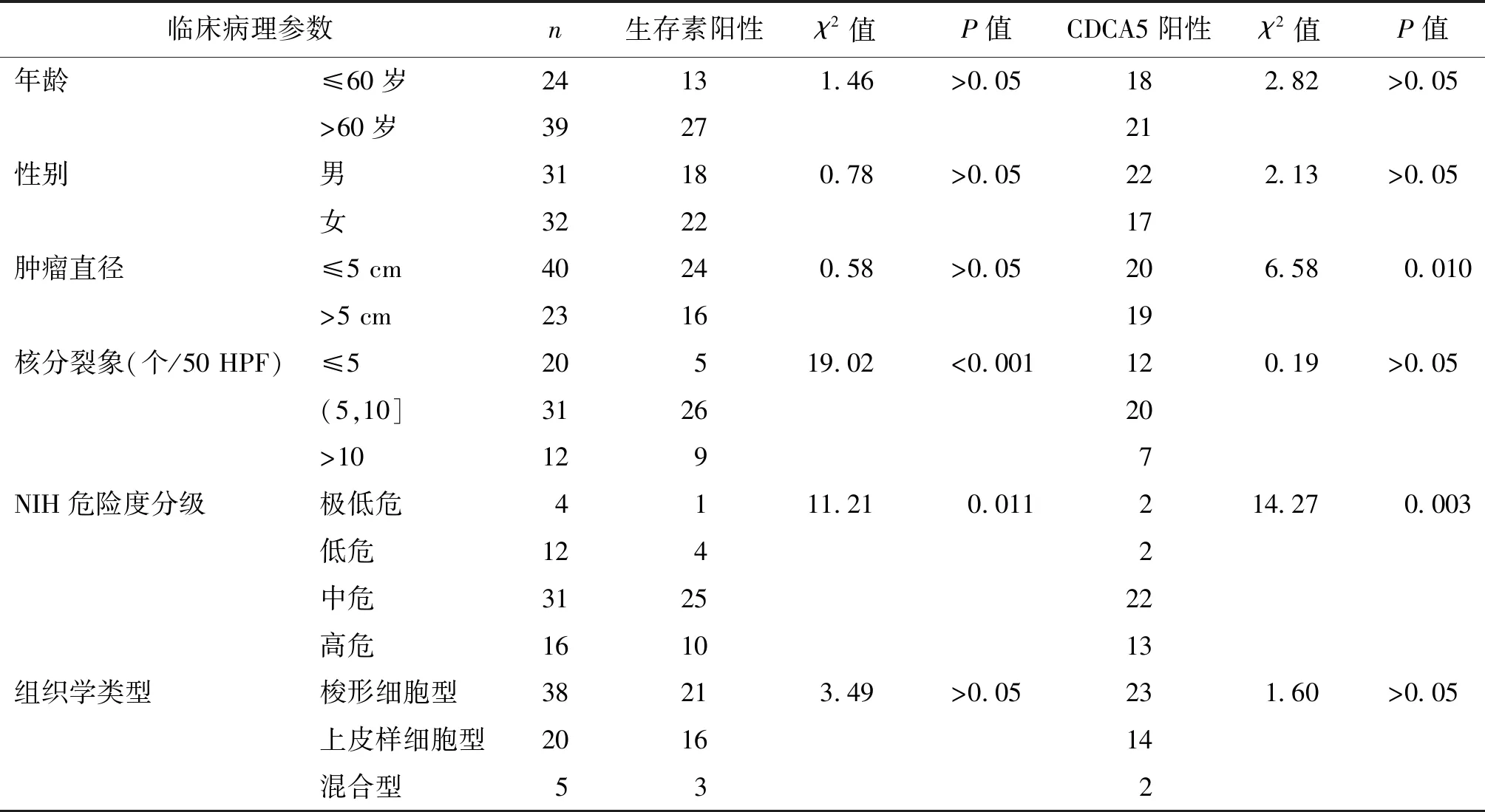
表2 生存素与CDCA5在胃间质瘤中的阳性表达及其临床病理参数的相性分析
2.4 生存素和CDCA5共阳性表达及其与胃癌、胃间质瘤患者临床病理参数的关系
在76例胃癌患者中,生存素与CDCA5均为阳性者26例。由表3可见,生存素与CDCA5共阳性表达与肿瘤直径、肿瘤分化程度、淋巴结转移及TNM分期相关(P均<0.05),而与年龄及性别无关(P均>0.05)。
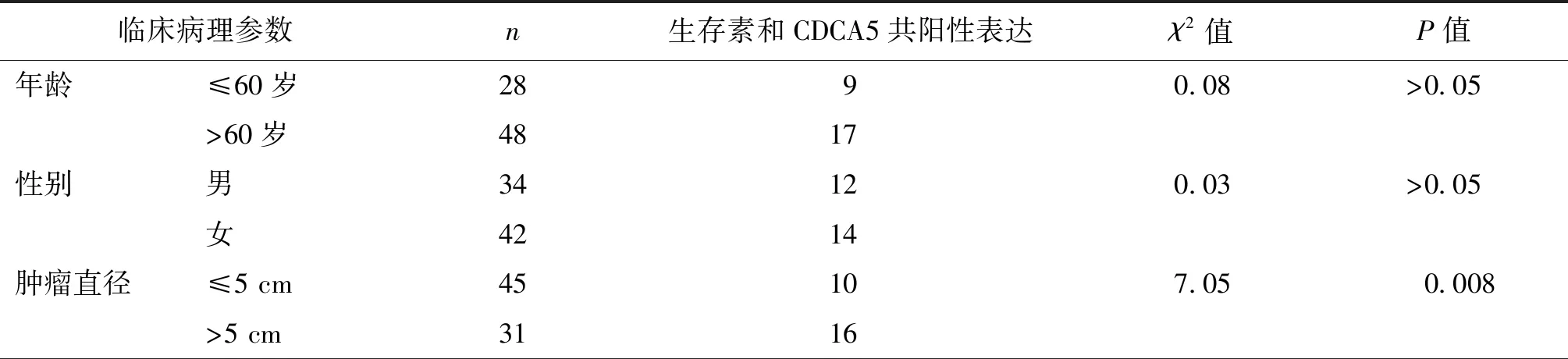
表3 生存素与CDCA5在胃癌中共阳性表达与临床病理参数的相关性分析
在63例胃间质瘤患者中,生存素与CDCA5均为阳性者27例。由表4可见,生存素与CDCA5共阳性表达与肿瘤直径、核分裂象及NIH危险度分级相关(P均<0.05),而与年龄、性别及组织学类型无关(P均>0.05)。
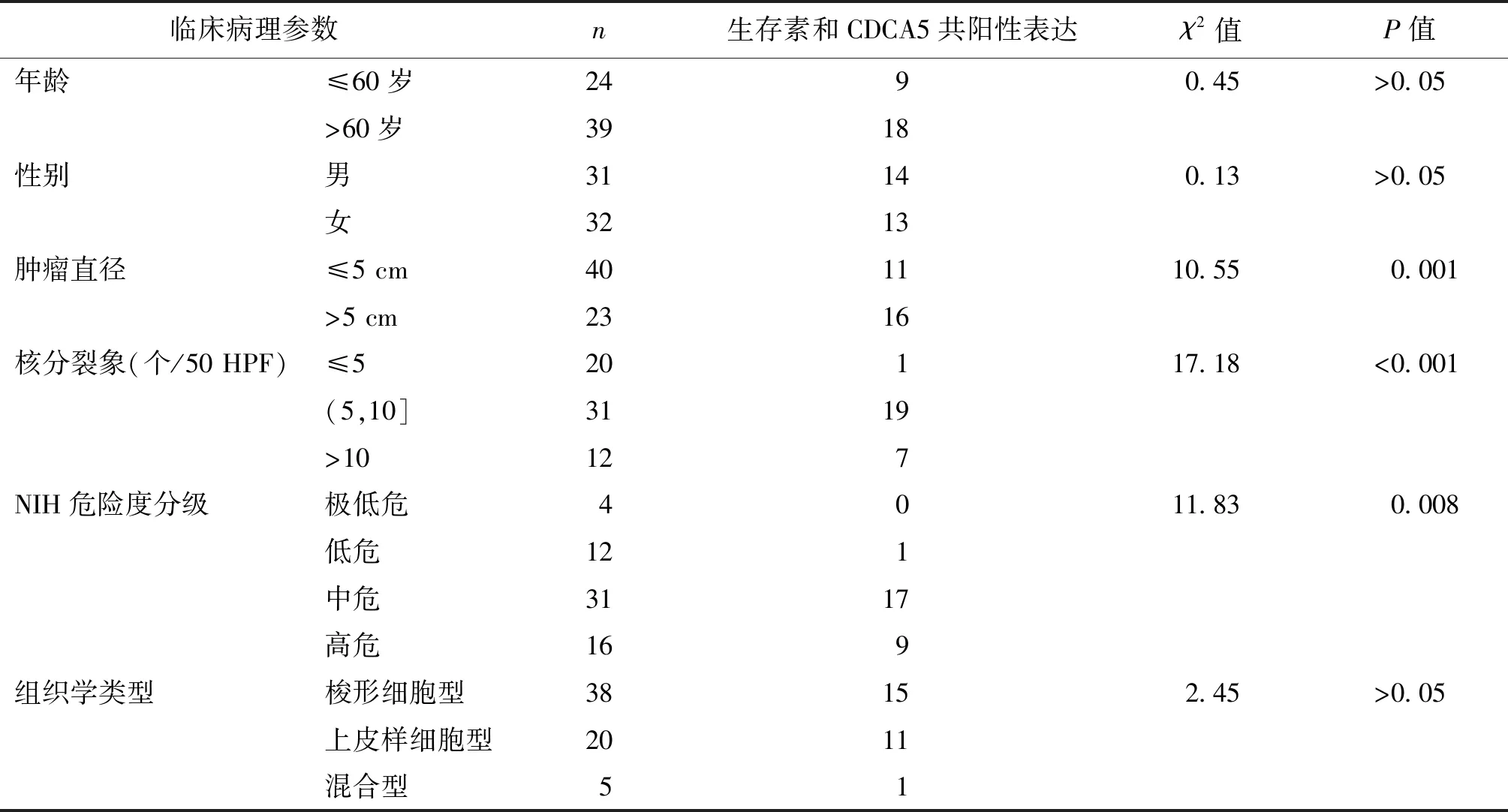
表4 生存素与CDCA5在胃间质瘤中共阳性表达与临床病理参数的相关性分析
2.5 数据库预测作用CDCA5与BIRC5启动子的转录因子
PROMO数据库预测发现,有20个转录因子可作用于CDCA5启动子序列,有19个转录因子可作用于BIRC5启动子;其中,13个转录因子可同时作用于CDCA5与BIRC5启动子,分别为AP-2αA、C/EBPβ、ER-α、FOXP3、GR-α、GR-β、IRF-2、p53、Pax-5、RXR-α、TFⅡD、TFⅡ-I和YY1。见图3。
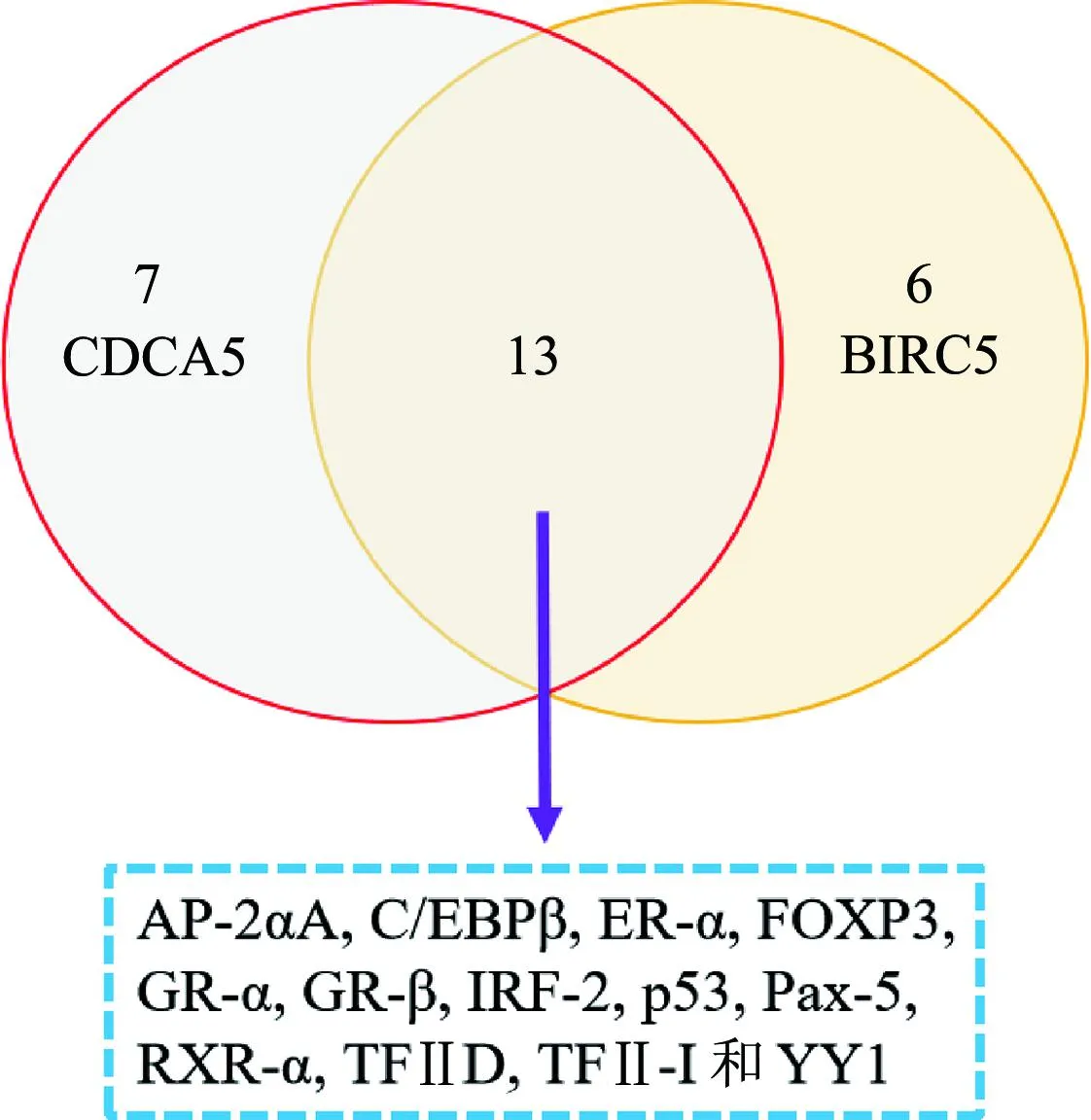
AP-2αA:转录因子激活蛋白2α;C/EBPβ:CCAAT/增强子结合蛋白β;ER-α:雌激素受体-α;FOXP3:头叉状转录因子3;GR-α:糖皮质激素受体-α:GR-β:糖皮质激素受体-β;IRF-2:干扰素调节因子2;p53:肿瘤蛋白p53;Pax-5:配对盒基因5;RXR-α:维甲酸受体α;TFⅡD:转录因子ⅡD;TFⅡ-I:通用转录因子Ⅱ-I;YY1:阴阳因子1
2.6 生存素与CDCA5相互作用预测
HDOCK Server分析发现,生存素蛋白与CDCA5蛋白之间存在多对相互作用,评分前三的结合区域见图4。其中,预测评分最高的结合区域中,生存素蛋白与CDCA5蛋白之间存在67对相互作用位点。由此可见,生存素与CDCA5在胃癌组织中共表达的同时,还可能通过相互作用发挥生物学功能。
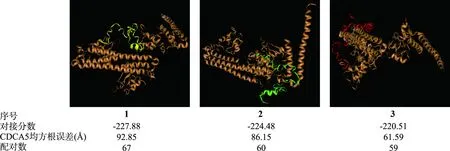
咖啡色示生存素蛋白,黄色、绿色和红色示结合生存素蛋白不同区域的CDCA5蛋白
3 讨论
胃癌与胃间质瘤是常见的胃肿瘤,尤其是中晚期胃癌患者预后往往更差;尽管胃间质瘤是交界性肿瘤,且有伊马替尼等靶向药物的应用,但高危、高核分裂象的胃间质瘤同样具有较高的术后复发率及病死率[2,13]。在胃癌与胃间质瘤的发生过程中,部分癌基因的过表达可能是其发生发展的共同始动因素。生存素的主要功能是通过抑制凋亡终末效应酶和作用周期蛋白激酶发挥抗凋亡作用,以及通过作用染色体着丝点参与细胞有丝分裂[14]。由于参与调控细胞周期与细胞凋亡,生存素可诱导癌变,促进胃癌生长,并抑制细胞凋亡,致其与胃癌的侵袭转移、化疗耐药、血管生成及患者预后密切关[14-15]。研究表明,在胃间质瘤中,生存素与危险程度分级有关,且为疾病进展的重要生物学标志,但其与年龄、性别、部位和组织学类型无关[16-17]。此外,生存素表达还受miR-494的负向调控,当miR-494表达异常下调时,生存素表达持续上调,从而导致胃间质瘤的发生发展[9]。本研究结果显示,BIRC5mRNA及生存素在胃癌组织及胃间质瘤组织中的表达明显高于对应的癌旁/瘤旁组织,且生存素在胃癌中的表达与肿瘤直径、肿瘤分化程度和淋巴结转移相关,在胃间质瘤中的表达与TNM分期、肿瘤直径、核分裂象及NIH危险度分级等临床病理学参数相关。由此可见,尽管胃癌与胃间质瘤起源不同,但均与生存素等癌基因的过表达相关。
CDCA5是细胞分裂周期相关蛋白家族的重要成员之一,参与调节细胞生长周期、促进增殖和抑制凋亡,并与其他细胞周期相关蛋白一同参与细胞的有丝分裂,从而促进胃癌的发生与进展[18-20]。本研究发现,相比于癌旁组织,CDCA5不仅在胃癌组织中表达明显升高,在胃间质瘤组织中同样呈异常高表达;其不仅与胃癌的肿瘤分化程度及TNM分期相关,也与胃间质瘤的肿瘤直径及NIH危险度分级相关。由此表明,CDCA5异常高表达可能也参与胃间质瘤的发生发展。
此外,本研究发现,在胃癌组织与胃间质瘤组织中CDCA5与生存素表达均呈正相关,由此认为两者异常高表达参与胃癌和胃间质瘤的发生发展。但两者呈低度相关,可能与样本量、患者年龄、性别等不可控的一些潜在干扰因素有关,后续有待进一步研究。此外,两者共阳性表达与胃癌、胃间质瘤的多个临床病理参数相关。研究表明,生存素与CDCA5在肿瘤细胞有丝分裂和细胞增殖中起重要的促进作用[14,20]。由此推测,两者高表达可能导致细胞有丝分裂异常活跃,进而促进胃癌、胃间质瘤的发生与进展。然而,两者正相关的具体调控机制还有待深入研究。另外,生物标志物的联合检测通常能够弥补单个标志物在诊断上的不足[21]。值得注意的是,联合检测生存素与CDCA5表达,在胃癌与胃间质瘤的临床病理学参数评估中弥补了检测单个分子的缺陷,具有一定的临床价值。
另外,通过数据库预测发现,CDCA5与BIRC5启动子同时能被多个转录因子调控。转录因子可通过结合靶基因启动子,调控靶基因的转录活性[22]。Jung等[23]研究表明,生存素受到YY1等多种转录因子的调控,但国内外关于调控CDCA5表达的转录因子的相关报道较少。因此,这或许是两者表达呈正相关的重要因素之一,但需要进一步确认。不仅如此,HDOCK预测发现生存素与CDCA5两种蛋白之间存在相互作用。由此推测,在多种转录因子的共同作用下,生存素与CDCA5在胃癌与胃间质瘤组织中呈高表达且共阳性表达,两者经复杂的相互作用在胃肿瘤的发生发展中起重要作用。
综上所述,生存素与CDCA5在胃癌与胃间质瘤中均呈高表达,且呈一定的正相关;两者联合检测对胃癌肿瘤直径、分化程度、淋巴结转移和TNM分期以及胃间质瘤肿瘤直径、核分裂象和NIH危险度分级具有一定的评估作用。生存素与CDCA5表达异常可能是胃癌与胃间质瘤发生发展的共性,两者表达异常在胃肿瘤发生发展中存在重要的内在联系,后续还需要深入研究两者相互作用、相互调控的可能机制。

