LINC02038 与子宫内膜癌发生、发展的关联性分析
赵二勇 陈悦霖 易莉莎 林佩萱
广州市妇女儿童医疗中心(广东广州 510180)
子宫内膜癌(endometrial carcinoma,EC)是女性生殖系统最常见的恶性肿瘤,发病率和病死率持续上升,并呈现发病年轻化的趋势[1-2]。EC可按临床病理特征分型为Ⅰ型和Ⅱ型两类。Ⅰ型EC多发于肥胖的围绝经期妇女,与雌激素水平升高有关;Ⅱ型EC主要发生在瘦弱的绝经后老年妇女中,与雌激素无直接关联[3]。EC早期无特异性表现,缺乏可靠的早期筛查手段,确诊常已属中晚期,预后较差,因此开发新型生物标志物用于EC早期检测和靶向治疗意义重大[4]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸的转录产物,在多种生物学过程中发挥关键调控作用[5-6]。lncRNA既可以与DNA发生相互作用调控基因转录,也可以与RNA或蛋白质相互作用后转译调控蛋白活性,从而影响正常细胞生理功能[7]。越来越多研究证实lncRNA表达失调可导致疾病发生[8-9]。lncRNA与肿瘤的起始、发展、侵袭转移等密切相关,是癌症精准诊疗和预后预测的新型生物标志物[10-11]。
目前大量新发现的lncRNA在肿瘤中的功能机制尚未完全明确。基因间区长链非编码RNA 02038(long intergenic noncoding RNA 02038,LINC02038)是一种新报道的基因间区lncRNA,位于人类第3号染色体上,长度为2.1 kb,包含3个外显子。有研究显示,LINC02038在结直肠癌组织的表达量明显降低,LINC02038吸附微小RNA 552-5p(miR-552-5p)阻断靶基因序列相似性家族 172(family with sequence similarity 172 member A,FAM172A)的降解而抑制结直肠癌细胞的增殖、活力、迁移和侵袭能力[12]。但该新lncRNA与EC关系的研究尚未见报道,本研究拟利用临床样本检测LINC02038在EC组织的表达情况,分析其表达与EC发病、临床进展的关系,利用功能学实验分析该lncRNA在体内外模型中对EC细胞增殖、迁移、侵袭和凋亡的影响,并结合癌症基因组图谱(The Cancer Genome Atlas,TCGA)等公共数据系统阐明该lncRNA的生物学功能和潜在机制,为EC的科学防治提供线索。
1 材料与方法
1.1 研究对象选择
本研究收集我院2019年1月—2022年12月行手术治疗并经病理确诊为EC的患42例者标本。所有标本均在切除后立即冷冻保存。纳入患者均未在术前接受过化学治疗、靶向治疗或内分泌治疗。本研究经医院医学伦理委员会审批(伦理批件号:穗妇儿科伦批字[2022]第313B01号),并征得患者知情同意。42例EC患者年龄为32~71岁,平均(54.4±11.3)岁。按照国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期,I~Ⅱ期患者36例、Ⅲ~Ⅳ期患者6例;病理类型主要为子宫内膜样腺癌(38例),非子宫内膜样腺癌4例;病理分级为G1 级16例、G2~G3级26例。
1.2 主要试剂和仪器
本研究所用RPMI 1640培养基和新生牛血清购自Hyclone公司(美国),LipofectamineTM 3000转染试剂购自Invitrogen公司(美国)。Ishikawa细胞购自广州速研生物科技有限公司(中国)。CCK-8细胞活力检测试剂盒购自上海碧云天生物技术公司(中国)。Trizol总RNA提取试剂、SYBR Green PCR荧光定量试剂盒购自大连宝生物工程公司(中国)。Transwell小室和Matrigel基质胶购自赛默飞公司(美国),PCR引物由生工生物工程公司(中国)合成。实验检测所用酶标仪为BioTek公司产品(美国),实时荧光定量PCR仪器为ABI公司产品(美国),倒置显微镜为Olympus公司产品(日本)。
1.3 实验方法
1.3.1 LINC02038过表达载体的构建 利用UCSC数据库获得LINC02038基因的全长cDNA序列,设计PCR引物用于扩增其全长基因片段。采用In-Fusion技术,将PCR产物克隆插入pcDNA3.1表达载体的XhoI和BamHI限制酶切位点,构建过表达重组质粒pcDNA3.1-LINC02038。质粒扩增产物送测序验证插入序列的正确性。
1.3.2 稳定过表达细胞株的建立 使用Lipofectamine 3000转染试剂将pcDNA3.1-LINC02038和空载体pcDNA3.1转染对数生长期的Ishikawa细胞,48 h后加入G418进行筛选,获得LINC02038稳定过表达细胞株及对照组。采用实时定量荧光PCR法(realtime quantitative PCR,RT-qPCR)检测转染效率。Ishikawa细胞株在37 °C、5% CO2饱和湿度的细胞培养箱内,使用含10%胎牛血清和抗生素的RPMI 1640培养基进行传代培养。
1.3.3 RT-qPCR法检测基因表达水平 采用Trizol法提取细胞或组织总RNA,根据逆转录试剂盒说明书逆转录成cDNA。设计LINC02038和内参基因β-actin的特异性引物,应用SYBR Green PCR系统检测基因的相对表达量。LINC02038上游引物:5ˊ-AGAGGCCAGCTCTCATCTGA-3ˊ,下游引物:5ˊ-TAGAGGAGCCGGTTCCATGA-3ˊ;β-actin内参上下游引物分别是5ˊ-GGCGG CACCACCATGTACCCT-3ˊ和5ˊ-AGGGGCC GGACTCGTCATACT-3ˊ。qPCR反应体系为25 μL,包含上下游引物各0.5 μL,cDNA模板2 μL,ddH2O 10 μL,SYBR Green Mix 12 μL。PCR扩增条件设置:95 °C预变性5 min;95 °C 15 s,60 °C 1 min,共40个循环。
1.3.4 细胞功能实验 CCK-8法检测细胞增殖能力。取对数生长期的转染细胞,以500 /孔密度接种96孔细胞培养板,每孔体积100 μL,设5个复孔。分别在接种0、1、2、3、4 d,每孔加入CCK-8试剂10 μL,避光孵育2 h后,酶标仪检测450 nm波长光密度值,绘制细胞生长曲线。使用孔径8 μm的Transwell小室进行细胞迁移实验,使用预包被Matrigel基质胶的Transwell小室进行细胞侵袭实验。取对数生长期细胞制备1×105/mL的单细胞悬液,取200 μL细胞悬液接种于小室内层,600 μL 含10%胎牛血清培养基于小室下层。常规培养48 h后磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗去除未迁移细胞,甲醛固定、结晶紫染色。棉签轻拭去小室上层细胞,显微镜下随机选取6个视野计数下室迁移和侵袭的细胞数目。每组设置3个复孔,重复实验3次。
1.4 生物信息学分析
1.4.1 公共数据的获取与处理 从TCGA(https://portal.gdc.cancer.gov/)数据库中下载EC的转录组测序(RNA-seq)数据并获得相应临床患者的资料。EC转录组count数据经log2(x+1)转化并提取LINC02038基因表达信息进行后续癌和癌旁组织的组间差异分析和生存分析。
1.4.2 功能富集分析 利用T C G A 数据探索LINC02038潜在的生物学功能和机制。以LINC02038表达中位数分组进行下游靶基因的差异分析,使用“clusterProfile” R包对筛选后的靶基因进行基因本体论(Gene Ontology,GO)、京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)及基因集富集分析(Gene Set Enrichment Analysis,GSEA),探索LINC02038在EC恶性进展中的潜在分子调控机制。
1.5 统计学方法
应用R 3.2统计软件进行本研究所有数据的处理和分析。符合正态分布的计量指标,使用描述,肿瘤组织与癌旁组织比较使用比较采用配对t检验,两组间比较使用独立样本t检验,不符合正态分布的指标比较使用Wilcoxon秩和检验;分类变量采用χ2检验。相关性分析采用Spearman秩相关分析。生存分析以Kaplan-Meier法绘制生存曲线,Log-rank检验比较生存率的组间差异。Cox比例风险回归模型分析LINC02038表达对EC预后的影响。所有检验均为双侧检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 LINC02038在EC组织中高表达
相较于癌旁组织,LINC02038在EC癌组织中的表达水平上调(0.000 28±0.000 04vs0.000 15±0.000 02,P<0.01;图1A)。利用TCGA EC组织的测序数据分析亦得到了一致的结果(图1B)。

图1 LINC02038 在EC 组织的表达水平
2.2 LINC02038表达与EC临床特征的相关性
进一步分析LINC02038表达与EC临床病理特征之间的关系。LINC02038表达水平在不同年龄、病理类型、肿瘤分级和FIGO分期的EC患者间比较差异均无统计学意义(P>0.05)。见图2。
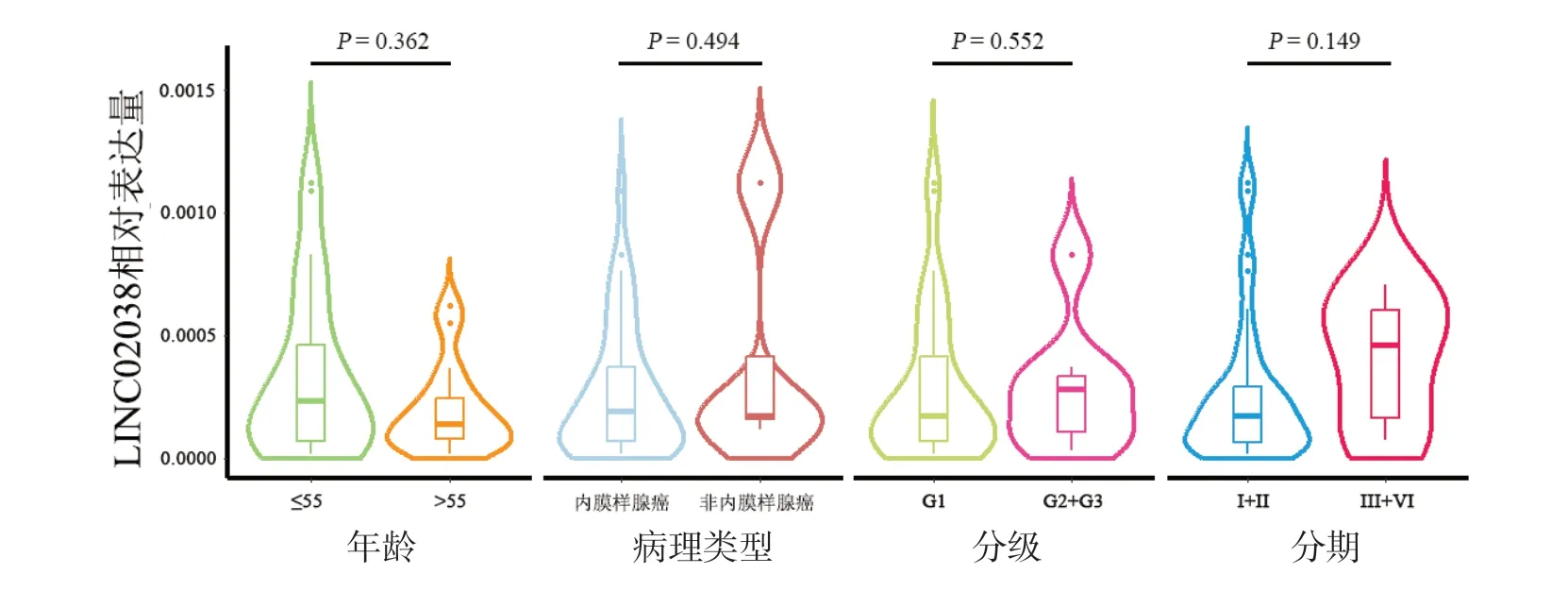
图2 LINC02038 表达与EC 临床病理特征的关系
2.3 LINC02038表达与EC预后的关系
利用TCGA数据分析LINC02038表达与EC预后的关系。结果显示,高表达组和低表达组在不同时间点的生存曲线比较差异无统计学意义(P=0.396,图3A)。单因素及多因素Cox回归分析发现:与低表达组相比,高表达LINC02038的EC患者的死亡风险有一定下降,但差异不明显(图3B)。
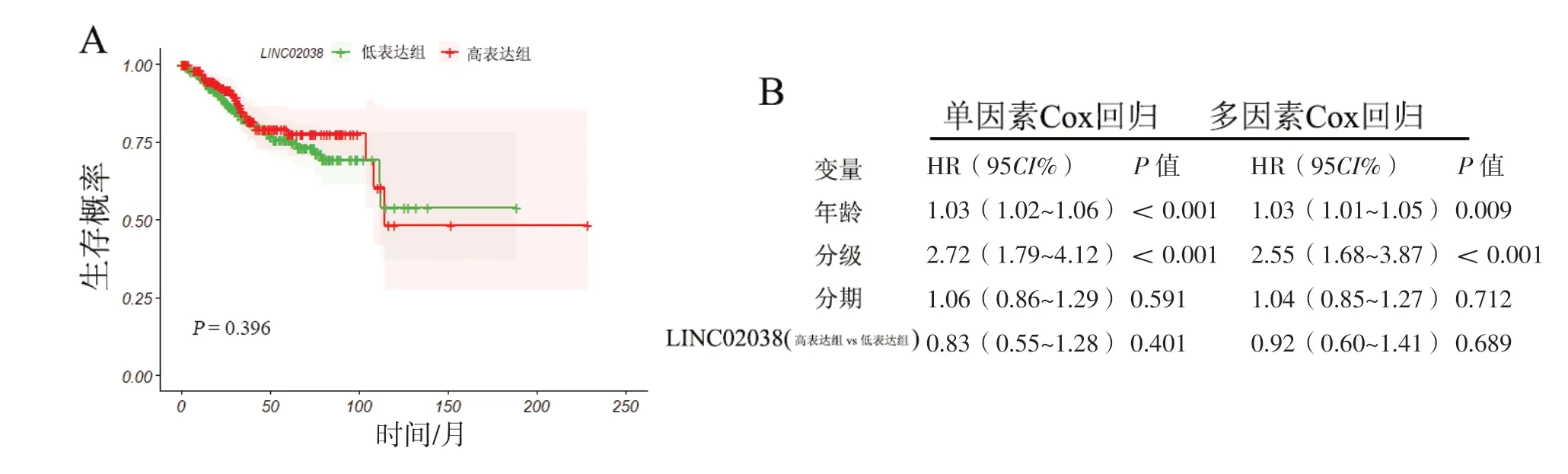
图3 LINC02038 表达与EC 预后的生存分析
2.4 LINC02038表达对EC细胞表型的影响
C C K-8 实验显示,与空白对照组相比,LINC02038过表达组的细胞增殖速率明显升高(图4 A)。两组在第4 天时的增殖速率分别为:LINC02038过表达组1.26±0.10,对照组1.84±0.15,组间比较差异有统计学意义(P<0.001)。Transwell迁移实验发现,过表达LINC02038的EC细胞穿过小室的个数多于对照组(148.6±35.6vs80.9±32.4,P<0.01)。但是在侵袭实验中,两组穿过小室的细胞数量比较差异无统计学意义(102.3±44.3vs76.8±36.4,P=0.201)。
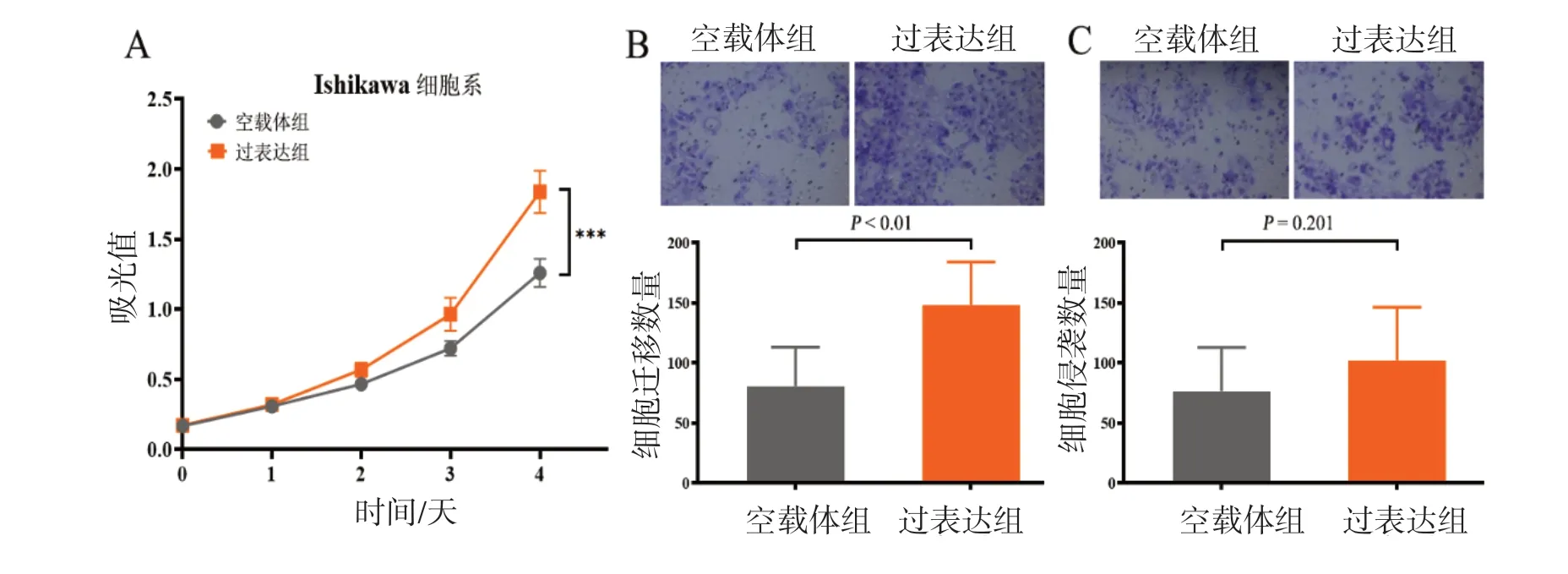
图4 LINC02038 的生物学效应
2.5 LINC02038在EC的潜在生物学功能分析
LINC02038高低表达组别的差异基因分析结果显示,受LINC02038表达影响的差异基因有614个,其中包括228个表达上调基因,386个表达下调基因(图5A)。利用上述差异基因进行富集分析,结果提示LINC02038可能参与细胞分化,细胞外基质重塑和激素分泌调控等生物学功能(图5B),并影响药物代谢、能量代谢及多条肿瘤相关信号通路(图5C)。GSEA分析进一步提示,高表达LINC02038可激活Drug metabolism、ECMreceptor interaction、NF-κB等下游信号通路。

图5 LINC02038 的功能富集分析
3 讨 论
本研究探讨了LINC02038与EC发生、发展之间的关联。结果显示LINC02038在EC癌组织中高表达,但其表达高低与患者预后无关。功能学实验证实该lncRNA可影响EC肿瘤细胞的增殖和迁移,提示其在EC恶性进展中发挥着重要作用。
EC属于妇女常见的生殖系统恶性肿瘤,近十余年来其发病率呈明显上升趋势,已经对妇女健康造成严重威胁[13]。大部分早期EC患者预后较好,5年生存率可达90%以上[14]。但仍有一部分患者存在癌灶转移,导致预后不佳[15]。因此,深入阐明EC的发病起源和分子机制,寻找新的诊断标志物和治疗靶点,对改善患者预后非常重要。众多研究显示,作为基因调控网络中的新星分子,lncRNA为探究复杂疾病的发病机制提供了新的研究视角[5,16]。lncRNA能够通过表观遗传、转录和转录后多种途径调控基因的表达[9,17],参与恶性肿瘤的发生、发展过程[8,18]。已有一些研究报道了特定的lncRNA在EC发生、发展过程中的关键调控作用。譬如,有研究报道lncRNA 淋巴细胞白血病缺失基因2(deleted in lymphocytic leukemia 2,DLEU2)在EC组织中高表达,其表达增加可导致EC预后不良。DLEU2通过与miR-455 竞争性结合诱导己糖激酶2(hexokinase 2,HK2)表达或与果蝇zeste基因增强子人类同源物2相互作用解除miR-181a对HK2的沉默效应等不同机制,促进EC细胞糖酵解和上皮-间充质转化转移进程[19]。另有证据显示lncRNA Opa相互作用蛋白5-反义转录物1在EC细胞系和组织中的表达异常下调,其通过与miR-200c-3p竞争性结合来控制EC细胞中的张力蛋白同源蛋白/蛋白激酶B通路来调节EC进展[20]。尽管已有大量证据证实了lncRNA在肿瘤进展过程中的重要功能,但是对于新发现的lncRNA在特定肿瘤中的表达规律和功能机制还需要深入研究,以进一步阐明其在癌症发生、发展中的分子机制。
本次研究中,LINC02038在EC癌组织中高表达,但其表达水平与EC患者的总体生存率无关。这表明LINC02038可能是参与EC癌变过程的特异性分子,但其是否与预后相关仍需进一步研究。关于LINC02038与恶性肿瘤关系的报道不多。Liu等[12]发现LINC02038在结直肠癌中异常低表达,且与肿瘤转移呈负相关。Zhao等[21]利用生物信息学分析发现LINC02038在乳腺癌中显著高表达,是乳腺癌预后不良的重要生物标志。这些报道提示LINC02038在不同肿瘤类型中具有表达特异性,可能在肿瘤进展中发挥不同的生物学功能。为了进一步探究LINC02038在EC中的作用机制,我们构建了过表达LINC02038的EC细胞系,并检测了其对细胞增殖和迁移侵袭能力的影响。结果发现高表达LINC02038能够促进EC细胞的增殖和迁移。功能富集分析结果提示LINC02038参与细胞分化、激素分泌、细胞外基质重塑等生物学过程,并激活下游细胞外基质受体互作通路、NF-κB信号通路等。已有大量证据证实NF-κB信号通路的异常激活能促进EC发生和发展[22-23]。由此推测,高表达的LINC02038可能通过调控NF-κB信号通路,促进EC细胞增殖、迁移,从而促进EC癌变进程。然而,LINC02038如何激活NF-κB信号通路,以及其调控相关基因的表达机制,后续工作中仍需进一步探索。
综上所述,LINC02038在EC中表达上调并具有促进肿瘤细胞增殖和迁移效应,可能成为EC发生过程中的重要调节因子,是EC诊断和治疗的潜在靶点。今后还需开展进一步研究,深入阐明其分子调控机制。

