石蒜属植物叶绿体基因组结构及系统学研究
付文佛,肖 涛,张永洪*
(1.云南师范大学生命科学学院,云南 昆明 650500;2.个旧市第十三中学,云南 个旧 661011)
石蒜属Lycoris隶属于石蒜科Amaryllidaceae,在全世界有20 余种,其中我国分布有15 种(含1 变种),12 种为我国特有,主要分布于长江流域至华东、华南、华中、西南等多个省(自治区、直辖市)[1—3]。近年来,石蒜属有7 个新类群被发现和命名,包括春晓石蒜L.chunxiaoensis[4]、秀丽石蒜Lycoris×jinzheniae[5]、长叶石蒜L.longifolia[6]、海滨石蒜L.insularis[7]、武陵石蒜L.wulingensis[8]、秦岭石蒜L.tsinlingensis[9]和湖北石蒜Lycoris×hubeiensis[10]。其中,秀丽石蒜在过去30年里一直被错误地命名为乳白石蒜Lycoris×albiflora[5]。另外,秦卫华等[11]于2021年发表了石蒜科一新属,即守标蒜属Shoubiaonia, 仅有云南守标蒜Shoubiaonia yunnanensis一种,该属具有的先花后叶、3 裂柱头和较多小苞片等特征能够与石蒜属物种区别开来。石蒜属植物极具观赏价值和药用价值。因其独特的观赏价值,被广泛用作鲜切花、盆景观赏以及地被植物[12]。目前,在石蒜属植物内发现80 余种生物碱成分,其中部分生物碱具有抗老年痴呆、抗肿瘤、抗病毒等生物活性,还能作用于心血管系统[13—17]。由于石蒜属植物存在种间天然杂交和种内形态具有较大变异等情况,使得石蒜属的系统分类和物种鉴定存在一定的困难[18]。Traub 等[19]曾经依据花型和雄蕊长度,将石蒜属分为整齐花亚属 subgen.Symmanthus和石蒜亚属subgen.Lycoris。徐炳声等[20]结合《中国植物志》和Traub & Moldenke(1949)分类体系,于1995年重新整理了分布于东南亚的石蒜属植物,将其合并为20 个种,仍然划分为整齐花亚属和石蒜亚属。然而,近年来对石蒜属物种基于形态分支分类和分子系统学研究的结果不支持传统的石蒜属分亚属的分类处理[21—25]。迄今为止,对于石蒜属的一些系统分类、鉴定和部分天然杂交种的分类与起源仍存在较多争议。
被子植物叶绿体基因组大多具有典型的四分体结构,即存在一对编码相同基因但方向相反的重复区(Inverted Repeat,IR),一般长6~76 kbp。它们之间有一个大单拷贝区(Large Single-copy Region,LSC)和一个小单拷贝区(Small Single-copy Region,SSC)[26]。植物叶绿体基因组序列具有以下优点:(1)叶绿体基因组含有大量的遗传信息,为比较研究提供了一个良好的数据基础[27];(2)叶绿体DNA 的核苷酸置换率较为适中,使其被广泛应用;(3)由于叶绿体基因组的编码区和非编码区的分子进化速度差异巨大,故适用于不同阶层的系统学研究[28];(4)叶绿体基因组较小,全基因组序列更容易测得,且各植物类群叶绿体基因组之间具有良好的共线性,为比较分析提供了便利;(5)叶绿体基因组一般为单亲遗传,不存在基因重组等问题[29]。因此,近年来叶绿体基因组在分子进化及系统发育研究中被广泛应用,并在分析科、族、属乃至于属下种间的系统关系方面发挥了重要作用。此外,通过叶绿体基因组结构比较能够发现种间序列变异和识别高变异区与简单重复和散在重复序列等分子标记位点,有助于物种的遗传多样性与系统发育分析[30—31]。
目前,对于石蒜属的研究主要集中于繁殖和栽培技术、化学成分和药理性质以及育种等方面,而对其系统学方面的研究,多是基于叶绿体基因片段,少有利用叶绿体全基因组进行系统发育研究。基于此,本研究利用已公布的17 条石蒜属植物叶绿体全基因组序列,分析其叶绿体基因组结构和进行比较基因组学分析,并结合石蒜科其他属物种的叶绿体全基因组序列进行分子系统学分析,为石蒜属的系统分类和种间亲缘关系研究提供理论依据。
1 材料与方法
1.1 材料
从NCBI 数据库(https://www.ncbi.nlm.nih.gov/genome/organelle/)下载已公布的石蒜属17 个物种叶绿体全基因组序列(表1)。
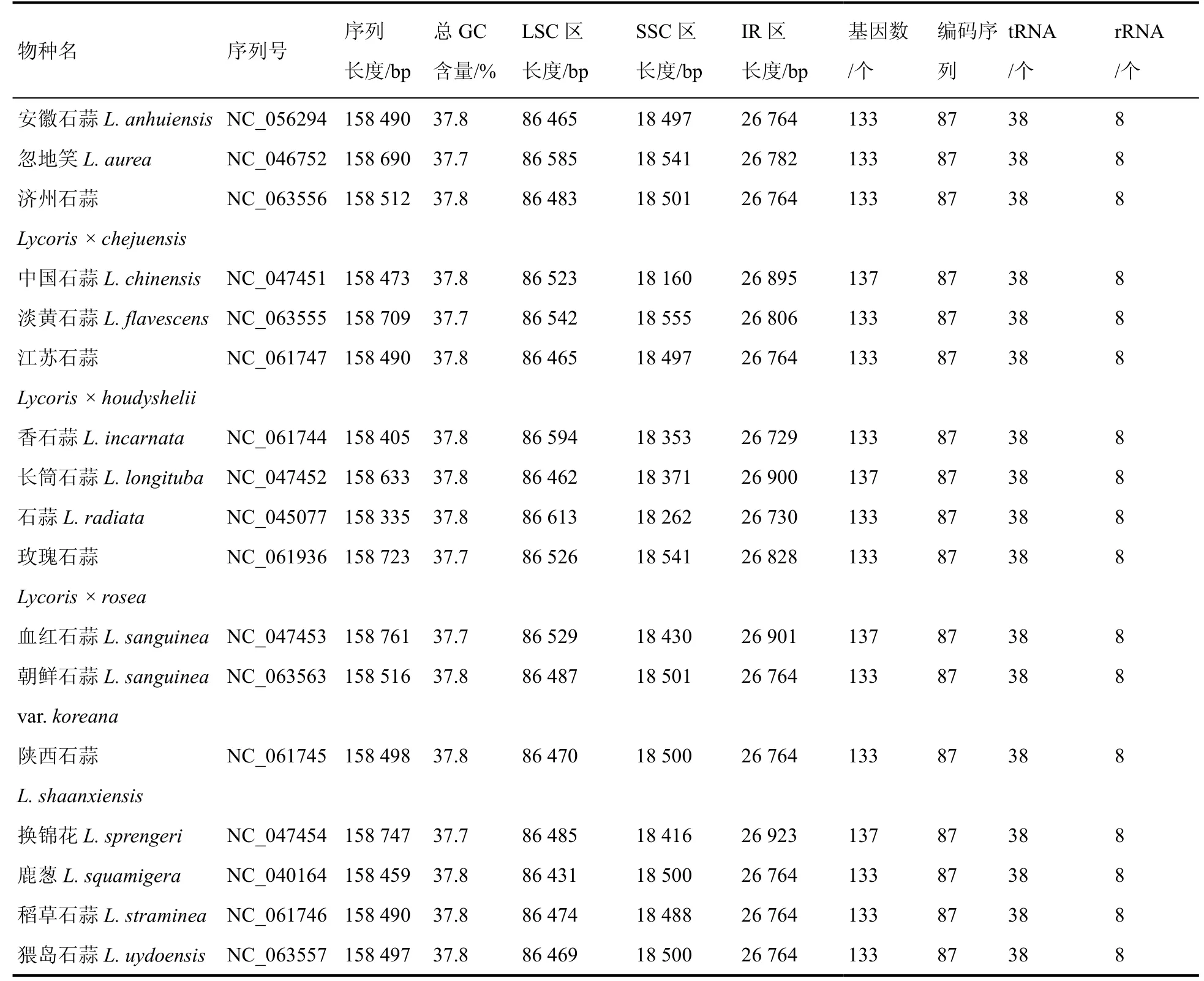
表1 石蒜属17 个物种叶绿体基因组序列信息Table 1 Chloroplast genome information of 17 taxa of Lycoris
1.2 基因组基本信息分析
利用Geneious v2020.0.5 软件对石蒜属叶绿体基因组序列的基本信息[32],包括序列长度、四个分区长度、GC 含量等情况进行统计。通过在线软件OGDRAW 绘制石蒜属植物的叶绿体基因组物理图谱[33]。
1.3 简单重复序列和散在重复序列分析
使用在线工具MISA-web(https://webblast.ipkgatersleben.de/misa/index.php)对17 种石蒜属植物的叶绿体基因组序列中的简单重复序列(Simple sequence repeat,SSR)进行识别和统计,其参数设置为:单核苷酸≥10 个重复单元,二核苷酸≥5 个重复单元,三核苷酸≥4 个重复单元,四、五、六核苷酸≥3 个重复单元[34]。借助线上软件REPuter[35]统计散在重复序列(Interspersed repeat)。散在重复序列包括正向重复(Forward repeats)、反向重复(Reverser repeats)、回文重复(Palindromicp repeats)和互补重复(Complementc repeats),其参数设置的最小长度(Minimal Repeat Size)为30 bp,最多碱基错配(Hamming Distance)为3。
1.4 密码子偏好性和IR 区边界分析
利用软件MEGA 7 对叶绿体基因组中蛋白编码基因编码的密码子数量进行统计[36],并计算相对同义密码子使用度(RSCU),再将分析好的数据利用TBtools 进行可视化[37]。使用在线分析软件IRscope对IR 区边界进行可视化分析[38]。
1.5 基因组比较及共线性分析
通过在线软件mVISTA 并选用安徽石蒜L.anhuiensis的注释文本为参考注释[39],选择Shuffle-LAGAN 模式对全基因组序列进行比较分析。使用软件MAFFT v7.450 对所有的序列在默认参数下进行比对[40],比对完成后利用Mauve 软件进行共线性分析[41]。
1.6 核苷酸多态性分析
将比对完成的序列通过DnaSPv5.10 进行核苷酸多态性(Pi)分析[42]。将其参数设置为步长(Step size)500 bp 和窗口大小(Window length)1000 bp。
1.7 系统发育分析
为了解石蒜属植物在科内的系统发育地位和属内的系统关系,选取石蒜属17 个物种和石蒜科其他属的物种(22 属43 种)并以百合科滇百合Lilium bakerianum(NC_035592)、高山贝母Fritillariafusca(NC_060547)作为外类群基于叶绿体全基因组序列进行系统树的构建。所有序列用MAFFT v7.450 软件在默认参数下进行序列比对[40]。最佳核酸替代模型经Modeltest v3.7 软件基于Akaike Information Criterion(AIC)计算后均为General Time Reversible+Gamma distribution(GTR+G)模型[43]。选择最大似然法(Maximumm likelihood,ML)和贝叶斯法(Bayesian inference,BI)进行建树。最大似然法使用RAxML v8.2.11 软件,循环次数设为 1000(bootstrap:1000)[44]。贝叶斯分析利用MrBayes 3.2.6 软件,设置运行20 000 000 代[45]。
2 结果与分析
2.1 石蒜属叶绿体基因组基本结构特征
石蒜属物种的叶绿体基因组表现为四分体环形结构,即由大单拷贝(LSC)区、小单拷贝(SSC)区以及两个反向重复(IR)区组成(图1)。石蒜属物种叶绿体基因组长度差异不大,其基因组长度在158 335~158 761 bp 之间,其中最长的是血红石蒜L.sanguinea,长度为158 761 bp,最短的是石蒜L.radiata,长度为158 335 bp,二者叶绿体基因组序列长度差异仅426 bp;总GC 含量为37.7%~37.8%;LSC 区长度86 431~86 613 bp,GC 含量35.8%~35.9%;SSC 区长度18 160~18 555 bp,GC 含量31.8%~32.0%;IR 区长度26 729~26 923 bp,GC含量42.9%~43.0%。石蒜属17 个物种的基因数量存在差异。血红石蒜、换锦花L.sprengeri、长筒石蒜L.longituba和中国石蒜L.chinensis四个物种的基因数量为137;其余13 个物种的基因数量为133,ycf15 和ycf68 基因丢失,而在上述4 个物种中,这两基因有两个拷贝。ycf15 和ycf68 基因为不编码蛋白质的假基因,因此17 种石蒜属植物除了基因数目存在差异外,CDS、rRNA 基因、tRNA 基因数量相同,分别为87 个、38 个、8 个(表1)。17 种植物的叶绿体基因按照功能可分为四类:遗传系统中用于自我复制的基因(76 个)、光合系统基因(45 个)、其他基因(6 个)、未知功能基因(6~10 个)。其中rrn4.5、rrn5、rrn16、rrn23、rps7、rps12、rps19、trnA-UGC、trnH-GUG、trnI-CAU、trnI-GAU、trnL-CAA、trnN-GUU、trnR- ACG、trnV-GAC、rpl2、rpl23、ndhB、ycf1、ycf2 等20 个基因有两个拷贝,其余为单拷贝基因(表2)。

图1 石蒜属叶绿体基因组图谱Fig.1 Genome map for the plastomes of Lycoris

表2 石蒜属植物叶绿体基因组的基因功能分类组成Table 2 Functional genes composition of the chloroplast genome of Lycoris
2.2 散在重复序列和简单重复序列分析
在石蒜属17 个物种中检测到的散在重复序列数量在41~57 个之间,共统计到810 个。其中,回文重复459 个、正向重复276 个、反向重复74 个、互补重复1 个(仅在中国石蒜)。散在重复序列主要位于LSC 区(39.38%)和IR 区(47.53%),SSC 区最少(13.09%)(图2A,B)。共统计出SSR 位点1191 个,在石蒜属不同物种中数量差异不大(66~74 个)。其中单核苷酸772 个、二核苷酸207 个、三核苷酸20个、四核苷酸118 个、五核苷酸73 个、六核苷酸1个(仅在忽地笑L.aurea中)。单核苷酸数量最多,且A/T 重复最多,仅在9 个物种中检测到少量C/G 重复。SSR 主要分布在LSC 区(73.63%),SSC 区(17.80%)和IR 区(8.56%)较少;在IR 区的分布最为均匀,每个物种都为6 个,在LSC 区和SSC 区的分布无较大差异(图2C,D)。

图2 石蒜属植物叶绿体基因组重复序列分析Fig.2 Repeat sequence analysis of the chloroplast genome of Lycoris
2.3 密码子偏好性分析
石蒜属17 个物种的密码子数量在26448 个(忽地笑)~26740 个(中国石蒜和长筒石蒜)之间,17个石蒜属物种之间无较大差异。色氨酸(Try)和甲硫氨酸(Met)只由一个密码子编码,其他氨基酸都由2~6 个同义密码子编码。相对同义密码子使用度(RSCU)能说明密码子使用是否偏好及偏好性强弱:RSCU>1 表明密码子使用频率较高;RSCU=1表明密码子无使用偏好性;RSCU<1 表明密码子使用频率较低[46]。共有31 个密码子的RSCU 值大于1,说明其密码子的使用频率较高,而其中29个密码子的第三位碱基为A 或U,只有编码亮氨酸(Leu)的UUG 和编码丝氨酸(Ser)的UCC 第三位碱基为C 或G,这表明17 个石蒜属植物偏好A或U 结尾的密码子;共有31 个密码子的RSCU 值<1,说明其密码子使用频率较低;甲硫氨酸(Met)和色氨酸(Trp)的RSCU 值为1,密码子使用无偏好性(图3)。
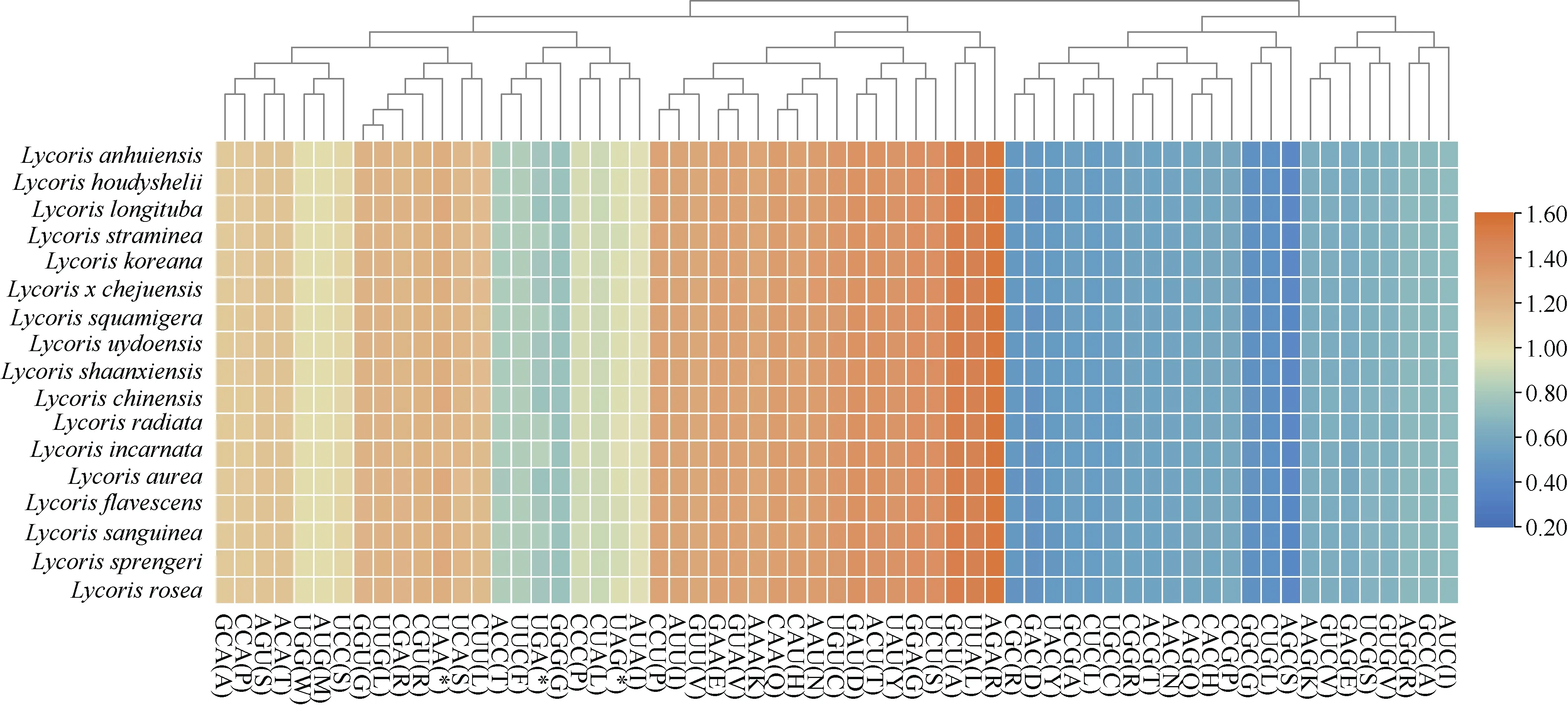
图3 石蒜属物种的密码子偏好性分析Fig.3 The relative synonymous codon usage analysis of Lycoris species
2.4 叶绿体基因组比较及共线性分析
利用mVISTA 软件对石蒜属植物进行叶绿体基因组比对,结果显示其叶绿体基因组不存在重排和倒置,具有很高的保守性(图4)。非编码区的变异频率高于编码区;LSC 和SSC 区变异较大,IR 区变异较小,IR 区相对更为保守;rRNA 基因基本没有发生变异,其保守度更高。共线性分析没有检测到基因重排和倒置现象,也表明石蒜属17 个物种的叶绿体基因组相对保守(图5)。

图4 利用mVISTA 对石蒜属17 个物种叶绿体基因组的可视化分析(Shuffle-LAGAN 模式)Fig.4 Visual comparison of chloroplast genomes of 17 Lycoris species by mVISTA(the comparisonresult in Shuffle-LAGAN mode)
2.5 IR 边界分析
对石蒜属植物17 个叶绿体基因组的LSC/IRb(JLB)、IRb/SSC(JSB)、SSC/IRa(JSA)、IRa/LSC(JLA)边界进行分析,结果如图6所示。17 个叶绿体基因组的边界分布的基因类型相同,只在基因的位置和大小上有所区别。在JLB 边界分布的基因为rpl22 和rps19,只有忽地笑的rpl22 基因跨过JLB 边界,其余物种的rpl22 基因全部位于LSC区;石蒜和香石蒜L.incarnata的rps19 基因跨过JLB 边界,其余物种的rps19 基因全部位于IRb 区。在JSB 边界分布的基因为ycf1 和ndhF,ycf1 基因均跨过JSB 边界;14 个物种的ndhF 基因跨过JSB边界,只有忽地笑、换锦花和玫瑰石蒜的ndhF 基因完全位于SSC 区。在JSA 边界处分布的基因为ycf1 和trnN,ycf1 基因横跨JSA 边界,trnN 基因全部位于IRa 区。JLA 边界位于rps19 基因和psbA基因之间。
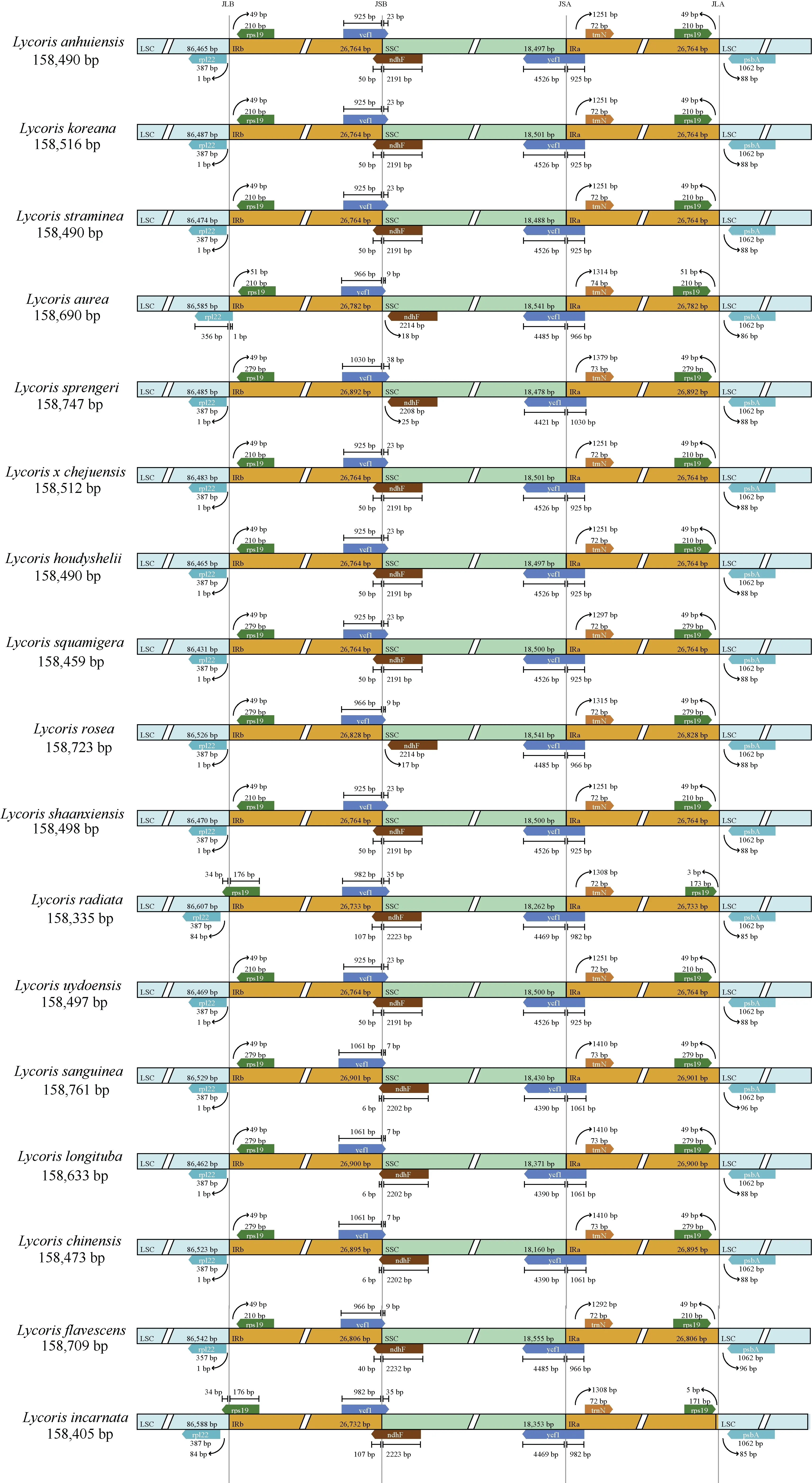
图6 石蒜属植物叶绿体基因组LSC、SSC 和IR 区边界的比较Fig.6 Comparison of LSC,SSC and IR region boundaries in the chloroplast genome of Lycoris
2.6 核苷酸多态性分析
利用 DnaSP(DNA Sequences Polymorphism v5.10.01)软件对17 个石蒜属植物叶绿体基因组的核苷酸多态性进行分析。Pi 值的范围为0~0.009。核苷酸多态性Pi 值大于0.006 的基因被认为是高变基因和基因间隔区,折线图中几个峰值所对应数值高的基因和基因间隔区为:trnG-UCC(0.00641)、atpF-atpH(0.00659)、psbC-trnS-UGA-psbZ(0.00957)、trnG-GCC-psbZ(0.00718)、rpl32(0.00807)、trnLUAG-rpl32-ccsA(0.00819)、rps15-ycf1(0.00641)、ycf1(0.00634,0.00621)等(图7)。
2.7 系统发育分析
利用叶绿体全基因组序列基于最大似然法(ML)和贝叶斯法(BI)构建的进化树整体拓扑结构大体一致,只有少数分支支持率和后验概率存在差异且绝大多数的分支都获得很高的支持率(图8)。从叶绿体全基因组序列的系统树来看,石蒜科形成单系类群,这与部分前期研究结果一致。石蒜属与水仙属Narcissus、全能花属Pancratium、雪片莲属Leucojum、秋雪片莲属Acis和箭药莲属Lapiedra等形成的分支构成姐妹分支。在石蒜属17 个物种中,处于最基部的物种是淡黄石蒜L.flavescens、血红石蒜、换锦花和玫瑰石蒜。石蒜属形成一个单系分支(BS=100,PP=1),并分为六个小的分支,其中安徽石蒜、长筒石蒜、江苏石蒜Lycoris×houdyshelii、稻草石蒜L.straminea为第一个分支(Clade Ⅰ),安徽石蒜和江苏石蒜亲缘关系最近(BS=94,PP=0.97);朝鲜石蒜L.sanguineavar.koreana和济州石蒜Lycoris×chejuensis以较高的支持率(BS=100,PP=1)聚为姐妹分支形成Clade Ⅱ;第三个分支(Clade Ⅲ)包括鹿葱L.squamigera、猥岛石蒜L.uydoensis和陕西石蒜L.shaanxiensis,其中鹿葱和猥岛石蒜形成姐妹分支,但支持率相对较低(BS=54);中国石蒜和石蒜形成姐妹分支并获得强烈支持(BS=100,PP=1),与香石蒜共同形成第四个分支(Clade Ⅳ);忽地笑单独形成第五个分支(Clade Ⅴ);淡黄石蒜和血红石蒜以及换锦花和玫瑰石蒜均以较高的支持率形成姐妹分支(BS=100,PP=1),共同组成Clade Ⅵ。

图8 基于最大似然法(ML)和贝叶斯法(BI)的石蒜属叶绿体基因组系统发育树Fig.8 Phylogenetic tree of the chloroplast genomes of Lycoris based on maximum-likelihood(ML)and bayesian inference(BI)
3 讨论
石蒜属物种间的叶绿体基因组全长最大差仅为426 bp,LSC 区、SSC 区、IR 区序列长度差分别为182 bp、395 bp、194 bp。由此可见,石蒜属植物叶绿体基因组结构相对保守。SSR 分子标记有着多态性丰富、通用性强、分率高、重复性高等优点[51—52],本研究共统计出SSR 位点1191 个,在整个基因组中都有分布,可应用于石蒜属植物种质资源鉴定、分子育种和群体遗传等方面的研究。植物叶绿体基因组中普遍存在IR 区边界的收缩和扩张[53—54]。石蒜属属内物种序列总长度和IR 区长度都相差不大,可见其IR 区扩张或收缩幅度微小,对其叶绿体基因组长度的影响较小。序列比对和共线性分析显示不存在重排和倒置,表明石蒜属叶绿体全基因组具有很高的保守性。根据石蒜属叶绿体基因组的核苷酸多态性(Pi)筛选出以下高变基因和基因间隔区:trnG-UCC、atpF-atpH、psbC-trnS-UGA-psbZ、trnGGCC-psbZ、rpl32、trnL-UAG-rpl32-ccsA、rps15-ycf1。这些高变位点可为石蒜属植物的系统发育分析和群体遗传研究提供可参考的基础数据。
Traub 等[19]基于花形和雄蕊长度将石蒜属分为两个亚属,然而基于叶绿体全基因组的系统发育结果并不支持该处理。例如,整齐花亚属的换锦花和血红石蒜与石蒜亚属的淡黄石蒜和玫瑰石蒜聚为一支,类似的情况在每个分支里都有出现。传统的亚属间区别形态特征在每个分支里都存在交叉,部分形态特征极为相似的物种也未聚类在一起,如香石蒜和陕西石蒜、稻草石蒜和江苏石蒜等,这与Zhang等[55—56]的结论相似。此外,邓传良等[25]和袁菊红[57]认为雄蕊与花被片的位置关系可将石蒜属划分为两个大类群,但在本研究中,雄蕊明显伸出花被外的玫瑰石蒜、石蒜、稻草石蒜、江苏石蒜与雄蕊不伸出或略伸出于花被外的换锦花、香石蒜、陕西石蒜、长筒石蒜等均未形成单系类群。因此,基于雄蕊与花被片的位置关系对石蒜属植物属下物种进行分类仍值得商榷。
基于叶绿体全基因组的系统发育分析表明,17个石蒜属物种所在分支可分为六个小的分支类群。安徽石蒜、江苏石蒜、长筒石蒜和稻草石蒜组成Clade Ⅰ,其中安徽石蒜和长筒石蒜形态极为相似,染色体数目均为2n=16,核型均为2n=16=6 m+10 t[58],且系统发育树显示二者的亲缘关系很近。因此,本研究支持安徽石蒜作为长筒石蒜的变种或是以长筒石蒜为母本的杂交种的观点[21]。江苏石蒜、稻草石蒜也与长筒石蒜聚在Clade Ⅰ中,表明这三个物种具有较近的亲缘关系,这在一定程度上验证了江苏石蒜和稻草石蒜可能是杂交起源的观点[47]。
朝鲜石蒜和济州石蒜以100%的支持率组成Clade Ⅱ,二者主要分布于朝鲜和韩国,因此它们亲缘关系较近可能与其分布有关。朝鲜石蒜是血红石蒜的变种,但二者并未形成姊妹群关系,其系统学关系有待进一步研究。
鹿葱、猥岛石蒜和陕西石蒜组成Clade Ⅲ,并得到100%的支持率,说明三个物种的亲缘关系很近。有研究认为石蒜属中2n=27(如鹿葱)是由2n=16的未减数配子和2n=22 的正常配子杂交得到的[48]。但在本研究中,鹿葱并未与染色体数为16 或22 的物种聚在一起,不支持鹿葱起源于长筒石蒜(2n=16)和换锦花(2n=22)的杂交的观点[47]。猥岛石蒜在1996年被作为淡黄石蒜的变种发表,即L.flavescensvar.uydoensisM.Kim[49],但在叶绿体基因组系统发育树中,两者亲缘关系较远,未形成姊妹群关系,其系统关系有待深入研究。张鹏翀等[50]通过核型分析认为,陕西石蒜也是杂交种,可能是中国石蒜与未减数分裂或四倍体石蒜的杂交后代,但本研究中陕西石蒜并未与中国石蒜或石蒜聚在一起。目前,关于陕西石蒜的资料较少,未来需要更多资料以明确该种的起源和系统位置。
中国石蒜、石蒜和香石蒜以100%的支持率组成Clade Ⅳ,表明石蒜和香石蒜的亲缘关系很近,这与部分学者的研究结果相似[21—22,59],但中国石蒜的系统位置不一样。香石蒜核型较为复杂,尽管其与石蒜的亲缘关系较近,但二者的染色体数目和核型都不相同。因此,香石蒜是否起源于石蒜或二者有较为相近的共同祖先还不能确定。
忽地笑未与其他石蒜属物种显示较近的亲缘关系,而是单独聚为一支(Clade Ⅴ),与利用RAPD 分析得到的结论一致[24],这可能与忽地笑分布范围较广、染色体数目和核型多样,且具有特有的染色体基数有关。
淡黄石蒜、血红石蒜、换锦花和玫瑰石蒜组成Clade Ⅵ,并获得100%的支持率。徐炳声等[20]认为淡黄石蒜可能是朝鲜石蒜和中国石蒜的杂种,玫瑰石蒜是二倍体石蒜和换锦花的杂种。在本研究中,换锦花和玫瑰石蒜也以100%支持率形成姐妹分支,支持玫瑰石蒜是换锦花与二倍体石蒜杂种的观点,且换锦花可能是玫瑰石蒜的母本。
综上所述,基于叶绿体全基因组序列构建的分子系统树不支持石蒜属基于花冠是否整齐划分亚属的传统处理,基于雄蕊与花被片的位置关系对石蒜属进行亚属划分的处理也值得商榷。建议取消对石蒜属属下亚属的划分,或者未来利用更多的形态学特征(如花粉粒、叶微形态等)并结合分子系统学资料再对石蒜属物种进行属下分类处理。杂交起源是石蒜属物种形成和分化的一个重要途径,本研究支持安徽石蒜、江苏石蒜、稻草石蒜、玫瑰石蒜等物种杂交起源的观点,并揭示其可能的母本。对石蒜属叶绿体全基因组的系统学研究,不仅有助于更深入地认识石蒜属物种的系统演化与杂交起源,同时,也为杂交品种的培育和选择提供参考。

