罗汉果伯林2号种子形态结构及萌发特性
曾荔琦,曾嘉欣,杨蕾蕾,杨 洋1,*
(1.湖南医药学院药学院,湖南 怀化 418000;2.华南农业大学生命科学学院,广东 广州 510642;3.深圳市中国科学院仙湖植物园,广东 深圳 518004)
罗汉果Siraitiagrosvenorii是葫芦科Cucurbitaceae罗汉果属Siraitia多年生藤本植物,又名金不换、假苦瓜、光果木鳖等,收载于1977~2020年各版本《中华人民共和国药典》中[1],其主要成分罗汉果苷V的甜度为蔗糖的250~350 倍[2],而热量仅为蔗糖的1/50[3],糖尿病患者亦宜服用,是我国特有的珍贵药用植物和甜料植物,也是我国卫生部首批公布的药食同源名贵中药材,被誉为“东方神果”,具有较高的经济价值。
罗汉果性喜温暖、湿润环境,主要分布在华南地区的广西、广东、湖南、江西等省(自治区)[4—5]。目前,关于罗汉果的研究主要集中在栽培[4,6]、成分[7]、药理[8—9]、质量标志物[9]、代谢组学[10]等方面。谭芳香等[11]发现,自2010年后,关于罗汉果品种选育和种苗繁育的研究和专利申请较少。市场存在罗汉果品种良莠不齐、种苗质量标准空缺、感病严重等问题[12—13]。罗汉果的繁殖方式主要有播种、扦插和组织培养等方法[4,14]。其中,组织培养繁殖成本高;长期无性扦插繁殖会导致罗汉果种性退化,品质和产量下降;种子繁殖则具有种源丰富,成本低廉,方法简单,繁殖系数高,能活化种性等优势[14];还可通过大量实生苗选择培育良种。目前关于罗汉果种子萌发研究较少,潘丽梅等[15]探索不同浓度激动素和赤霉素对罗汉果种子萌芽的影响。张碧玉等[16]和李锋等[17]则集中对长滩果、拉江果、青皮果、冬瓜果等罗汉果品种的种子在不同温度、不同贮藏方式及去皮处理条件下的萌发进行相关研究。此外,研究发现降水和温度是影响罗汉果生长和分布的主要环境因子[18],其分布的南方地区多为酸性壤土[19]。但关于罗汉果种子酸胁迫和干旱胁迫等生理研究未见系统报道。因此,本文以广西壮族自治区桂林市永福县伯林2 号罗汉果种子为材料,对其形态、萌发特性,以及浸种、酸胁迫和干旱胁迫对种子萌发的影响开展研究,为罗汉果的区系分布、保护、繁殖和育种等研究提供理论依据。
1 材料与方法
1.1 材料
罗汉果伯林2 号成熟果实于2022年1月购自广西壮族自治区桂林市永福县。经华南农业大学生命科学学院孔德鑫副教授鉴定为罗汉果伯林2 号果实,并于常温干燥储存,萌发实验前取出种子。
1.2 方法
1.2.1 种子形态指标测定
随机选择10 粒饱满的罗汉果种子,在体视显微镜(M205FA,Leica)下观察其外部形态。将干燥种子从中部纵切,固定后放入样品台,用离子溅射仪(MC1000,Hitachi)均匀喷金30 s;在扫描电子显微镜(SU8100,Hitachi)下观察并拍照。
种子长、宽和厚用数显游标卡尺(精度0.01 mm)测定,重复50 次,取平均值。种子千粒重采用四分法随机取种子1000 粒,电子天平(精度0.0001 g)称量,重复10 次,取平均值。
1.2.2 吸水率测定
将50 粒饱满种子置于装有蒸馏水的烧杯中,常温吸胀,分别在处理2、4、8、16、24、48、72 h取出,用滤纸吸干表面水分后称重,计算吸水率。设3 次重复,取平均值。
吸水率(%)=[(吸水后重量–吸水前重量)/吸水前重量]×100%
1.2.3 萌发率与萌发势测定
随机选择健康饱满的种子40 粒,70%乙醇喷洒消毒。设置一组用无菌水浸泡24 h,一组不浸泡处理。用灭菌后的细砂培养,并保持培养盒无流动水且湿润状态。于常规条件下(温度25 ℃、相对湿度60%、12 h 光照/12 h 黑暗,下同)培养。以种壳裂开,子叶突出种皮作为种子萌发的标志,连续5 d 无萌发视为萌发结束。设3 次重复,取平均值。
发芽率(%)=(发芽种子总数/供试种子总数)×100%;
发芽势(%)=(日发芽种子数达峰值时的发芽种子总数/供试种子总数)×100%。
1.2.4 种子酸胁迫处理
使用盐酸模拟种子萌发酸胁迫。随机选择健康饱满的种子40 粒,分别喷淋pH 为4、5、6 的盐酸溶液,对照组喷淋无菌水(pH 7),于常规条件下培养。设3 次重复,统计发芽率和发芽势。
1.2.5 种子干旱胁迫处理
使用PEG-6000 模拟种子萌发干旱胁迫。选择健康饱满的种子40 粒,分别喷淋5%、10%和15% PEG-6000 溶液,对照组喷淋无菌水,于常规条件下培养。设3 次重复,统计发芽率和发芽势。
1.3 数据统计
采用SPSS 22.0 软件和EXCEL 软件对数据进行统计分析与作图。
2 结果与分析
2.1 罗汉果种子形态特征
罗汉果伯林2号种子千粒重为178.71±6.99 g;外形呈类圆形,扁平状,长17.00±1.04 mm,宽14.34±0.84 mm,厚3.44±0.30 mm。种子边缘较厚,呈淡黄色;中间向内微凹陷呈棕黄色(图1 A);内含米白色种仁,呈纺锤形(图1 C)。种子上下种壳在淡黄色区域的侧面不闭合,具缝隙(图1 B)。
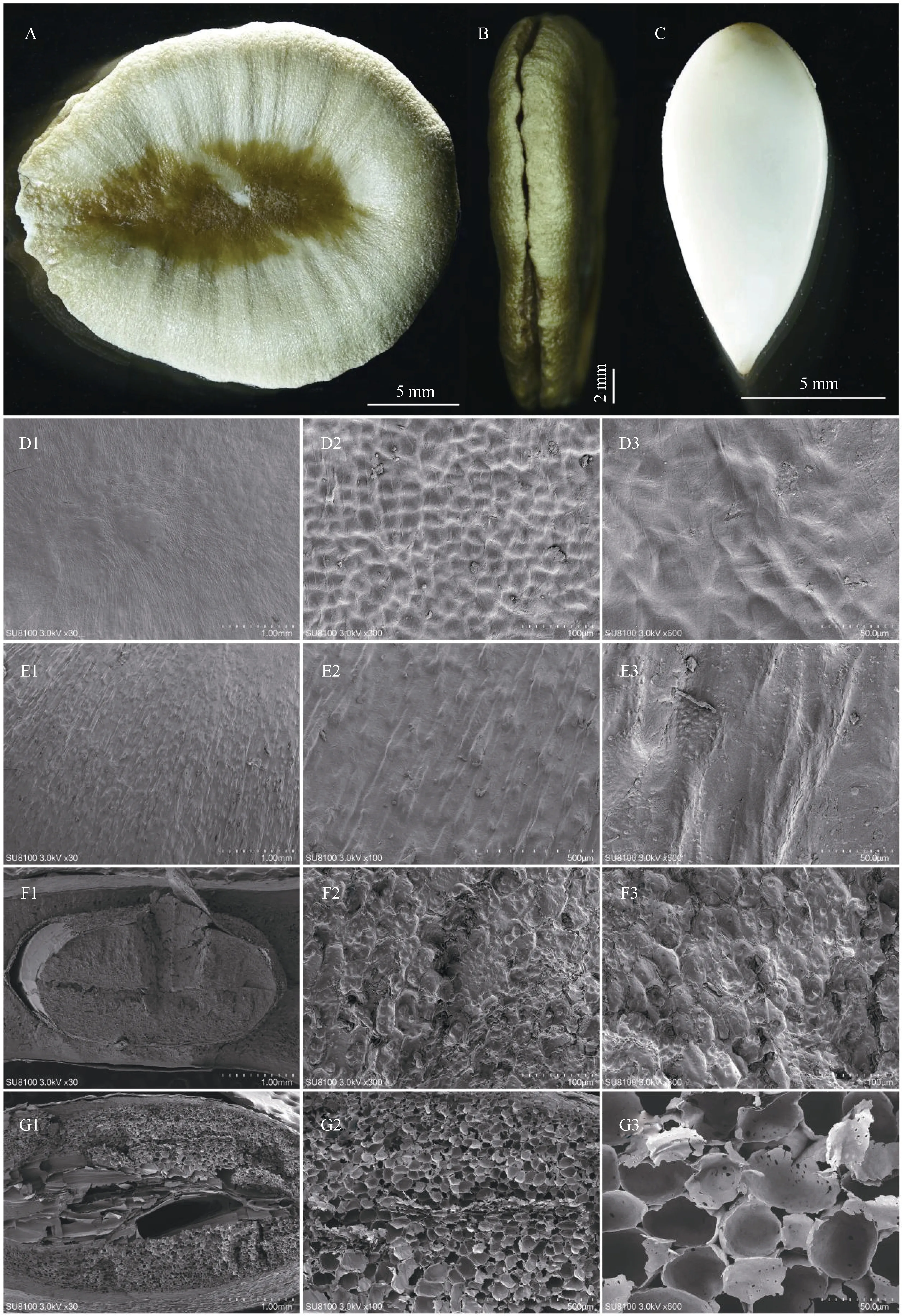
图1 罗汉果种子的形态特征Fig.1 Morphological characteristics of Siraitia grosvenorii seed
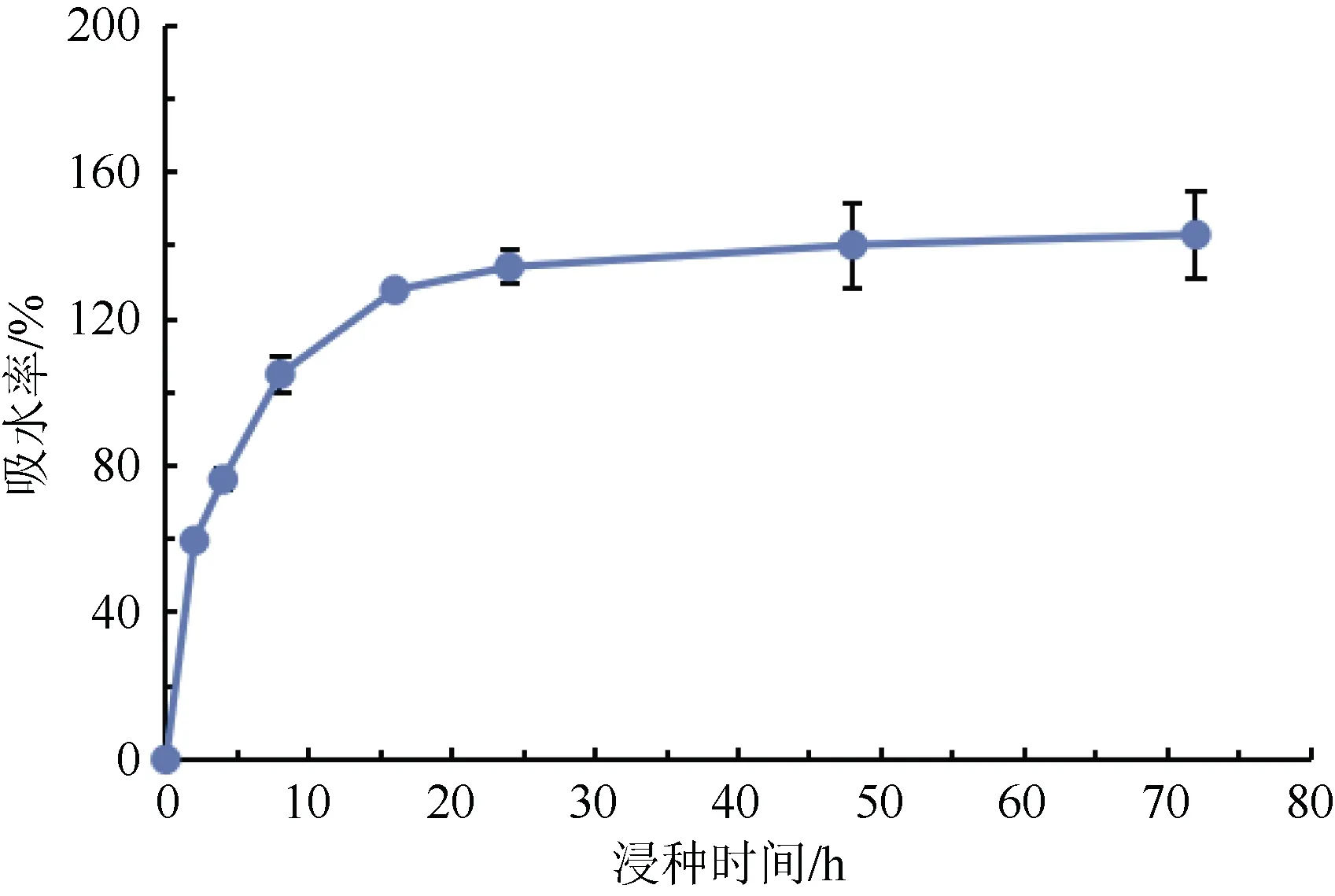
图2 罗汉果种子吸水率变化Fig.2 Variation trend of water absorption of Siraitia grosvenorii seed
罗汉果伯林2号种子扫描电镜如图1 D~G。种皮中间棕黄色区域较为平整(图1 D1),放大后可见细微的网状凸纹(图1 D2~D3)。边缘淡黄色区域呈放射状沟纹(图1 A,图1 E1~E3)。从种子剖面可见,种子扁平面的表皮为一列栅状细胞,下层为数层厚壁纤维和石细胞。其中,种子中间近种仁区域细胞排列为环状,且紧密(图1 F1~F3)。边缘区域的下层为排列疏松的海绵状细胞,细胞排列疏松,细胞间隙大,离种皮越远,细胞越大(图1 G1~G3),且在中心区域有较大空隙(图1 G1)。
2.2 罗汉果种子吸水率
罗汉果伯林2号种子浸泡8 h 内的吸水率迅速增加,尤其是前2 h,吸水率高达59.67%,当浸种8 h时,吸水率达105.03%。在8~24 h 之间,吸水率逐渐减慢,其24 h 吸水率为134.30%。24 h 后,种子吸水率无明显增加,吸水达到饱和状态。
2.3 种子萌发特性
由表1 可知,浸种和未浸种的罗汉果伯林2号种子的发芽率和发芽势无显著差异。浸种24 h 的罗汉果种子发芽初始时间较未浸种的提前8 d,发芽末期时间提前7 d。可见浸种不会影响罗汉果伯林2号种子的发芽率和发芽势,但可提前其发芽的始末时间。
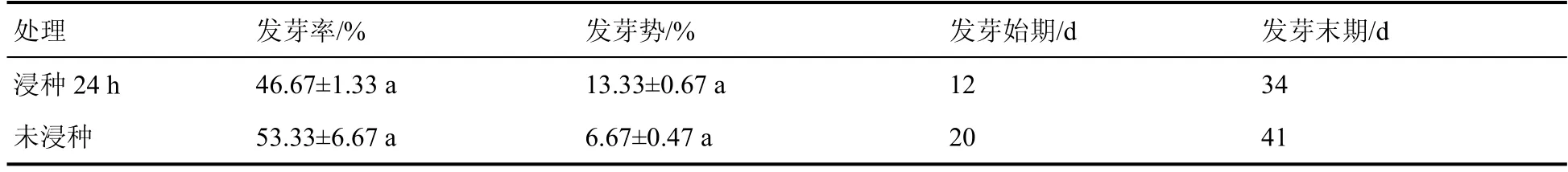
表1 浸种对罗汉果种子萌发的影响Table 1 Effects of soak on seed germination of Siraitia grosvenorii
2.4 酸胁迫对种子萌发的影响
图3 显示,随着pH 降低,罗汉果伯林2号种子的发芽势呈先升高后下降趋势,发芽率在pH<6时显著下降。对照组种子发芽率为46.67%,发芽势为13.33%;当pH=6 时,萌发率上升至53.33%,发芽势上升至20.00%,但其萌发率与对照组无显著差异;当pH 降至5 和4 时,其发芽率、发芽势依次分别降低至40.00%、13.33%和20.00%、6.67%。可见弱酸性条件(pH=6)不影响罗汉果伯林2号种子的萌发,但当pH<6 时,则会抑制罗汉果种子萌发。
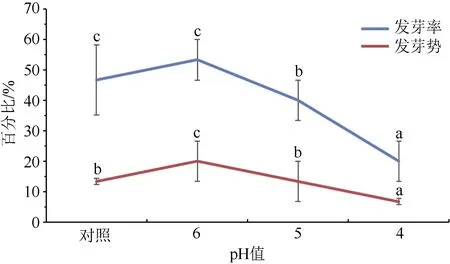
图3 酸胁迫下罗汉果种子发芽率和发芽势Fig.3 Germination percentage and germination potential of Siraitia grosvenorii seeds under acid stress
图4 可见,与对照组A1 和A2 相比,随着pH降低,罗汉果伯林2 号幼苗的植株高度、叶片大小和根系等长势均与对照组A1 和A2 无显著差异;除萌发数量的差异外,均未出现生长畸变等现象。

图4 酸胁迫对罗汉果幼苗的影响Fig.4 Effects of acid stress on Siraitia grosvenorii seedlings
对照组初始萌芽时间在第12 天,pH=6 处理组初始萌芽时间为第15 天,pH=5 和pH=4 处理组初始萌芽时间分别为第17 天和第18 天(图5)。在不同pH 酸胁迫处理下,罗汉果伯林2号种子的发芽启动时间分别延后3~6 d,但差异不显著。因此,酸胁迫对罗汉果伯林2号种子萌发启动时间没有影响。

图5 酸胁迫和干旱胁迫下罗汉果种子萌发进程Fig.5 Germination process of Siraitia grosvenorii seeds under acid stress and drought stress
2.5 干旱胁迫对种子萌发的影响
由图6 可见,随着PEG-6000 浓度增加,罗汉果伯林2号种子的发芽率和发芽势均呈先不变后下降的趋势。在5% PEG-6000 浓度处理下种子发芽率为46.67%,与对照组种子发芽率一致,且与10%和15% PEG-6000 处理组呈显著差异,10%和15% PEG-6000 处理组的发芽率分别降低至26.67%和13.33%。在5%和10% PEG-6000 下种子发芽势均为13.33%,而 15% PEG-6000 处理下发芽势降至6.67%,可见较严重的干旱胁迫(PEG-6000 浓度高于10%)可抑制罗汉果伯林2号种子萌发。

图6 干旱胁迫下罗汉果种子发芽率和发芽势Fig.6 Germination percentage and germination potential of Siraitia grosvenorii seeds under drought stress
随着PEG-6000 浓度增高,罗汉果伯林2 号幼苗的长势亦受到显著影响(图7)。其中5% PEG-6000浓度处理下萌发的幼苗植株高度、叶片大小和根系等长势情况均与空白对照组幼苗基本一致,无显著性差异。而10% PEG-6000 浓度处理下萌发的幼苗植株较5%处理组出现明显矮化、生长迟缓等现象。在15% PEG-6000 处理下萌发的幼苗,其生长状况受到显著抑制,并伴随根系弱化甚至无根、真叶畸变等现象。可见由PEG-6000 建立的干旱胁迫能显著影响罗汉果伯林2 号幼苗的长势,甚至导致植株畸变。

图7 干旱胁迫对罗汉果幼苗的影响Fig.7 Effects of drought stress on Siraitia grosvenorii seedlings germination
在不同PEG-6000 浓度处理下,罗汉果伯林2号种子的发芽启动时间存在显著后移现象(图5)。空白组初始萌芽时间在第12 天,5% PEG-6000 处理组初始萌芽时间为第18 天,而10%和15% PEG-6000处理组的初始萌芽时间分别推迟到第31 天和第34天。可见由PEG-6000 建立的干旱胁迫能显著推迟罗汉果伯林2号种子的萌芽启动时间。
3 讨论
种子是植物有性繁殖的最高形式,是植物生命周期的起始。种子萌发是植物能否正常生长的最关键阶段之一[20],除自身特性以外,种子萌发与生长受到温度、干旱、酸碱度、光照和盐度等各种环境因素的影响[21—22]。
从伯林2号种子吸水率曲线来看,罗汉果种子具有良好的吸水性,但其横切面扫描电镜图显示,罗汉果的种仁被由厚壁纤维和石细胞等组成的坚硬种壳包裹在种子中间微凹区内。显然,快速上升的吸水量是由于水通过种壳边缘的裂缝快速进入种壳边缘厚壁纤维间的缝隙和死亡的海绵细胞中造成的。因此推测,罗汉果种子边缘的大面积区域(淡黄色区域)不仅在动物啃食和消化中起到保护种仁的作用,还有助于种子迅速吸水与储水,进而为种子的萌发和初期生长提供充足的水分。同时,大量储水加速种壳软化,从而加快罗汉果种子的发芽始末时间,但并未影响发芽率和发芽势,这与秦芳等[23]对栝楼Trichosantheskirilowii种子的研究结果一致。
研究表明,降雨、温度、土壤酸碱度及盐度等是影响植物生长和分布的主要环境因子[22,24]。在不同pH 的酸胁迫处理下,罗汉果种子的发芽率呈下降趋势,当处于pH=6 的弱酸性条件下时,其发芽率和发芽势均表现最好。这与曾其国等[19]对广西桂林罗汉果原产地A 层土壤pH 检测为5.76,且我国南方地区多为红壤、砖红壤、棕壤等酸性土壤研究结果相印证。在对罗汉果种子萌发率的研究中,李锋等[14]发现25~28 ℃的萌发率(76.47%)远高于20 ℃(14.00%)和34~35 ℃(12.86%)条件下的萌发率。本研究发现,PEG-6000 模拟的干旱胁迫显著抑制罗汉果伯林2号种子的萌发和幼苗的长势,并推迟种子的萌芽启动时间。说明温度和降水亦是影响罗汉果种子萌发和幼苗生长的重要环境因子,这与Wei 等[18]认为温度和降水是影响罗汉果分布和生长的主要环境因子相互印证。干旱胁迫降低植物的吸水能力和水势,从而对植物各种生理过程产生负面影响[22]。研究发现,干旱胁迫下可溶性糖的转运减少会影响植物细胞内可溶性碳水化合物的积累,进而影响植物的生长和发育[25]。本研究从浸种、酸胁迫和干旱胁迫等多方面探索罗汉果伯林2号种子的萌发情况,为后期相关种子的研究和生产中罗汉果种子的萌发提供参考。
4 结论
(1)罗汉果伯林2号种子吸水吸胀主要集中在浸种24 h 内,尤其是前8 h;吸收的水分主要储存在种壳边缘厚壁纤维间的大量缝隙和死亡的海绵细胞中。
(2)浸种可使罗汉果伯林2号种子萌芽的始末时间提前7~8 d,但不会改变其发芽率和发芽势。
(3)在酸胁迫处理中,罗汉果伯林2号种子在pH=6 时发芽率和发芽势均表现最佳;随着pH 降低,发芽率和发芽势均显著降低,且发芽初始时间推迟3~6 d;酸胁迫对幼苗长势无显著影响。
(4)在PEG-6000 建立的干旱胁迫处理中,较高浓度PEG-6000 显著影响罗汉果伯林2号种子的发芽率和发芽势,以及幼苗的长势,且浓度越高,对种子的萌发和幼苗生长影响越大。不同程度的干旱胁迫致使其发芽初始时间推迟6~22 d。

