复方红豆杉胶囊与替莫唑胺对胶质瘤细胞的协同杀伤作用
张弛,王英 ,杨福义*
(1 佳木斯大学,佳木斯 154000;2 齐齐哈尔医学院附属第二医院,齐齐哈尔 161000;3 佳木斯大学院附属第一医院神经外科,佳木斯 154000)
脑胶质瘤是常见的颅脑恶性肿瘤,其约占所有类型的颅内肿瘤的50%,且发病率、复发率和死亡率一直居高不下[1]。由于替莫唑胺-烷化剂(temozolomide,TMZ)易穿透血脑屏障,已成为治疗脑胶质瘤最重要的药物[2]。但TMZ 也依然具有杀伤正常细胞、胃肠道反应和骨髓抑制以及耐药等副作用[3]。目前胶质瘤的联合治疗已经非常普遍,多种药物联合使用不仅可以有效控制患者体内肿瘤细胞的生长,还有助于抑制或改善的并发症,改善机体的耐药性[4,5]。复方红豆杉胶囊(compound taxus chinensis capsule, CTCC)具有强力杀伤肿瘤细胞,增强机体免疫系统,且治疗效果持久稳定、抗肿瘤谱广且不良反应较轻特点,目前已经用于如肺癌、直肠癌和胃癌等多种肿瘤的直接或辅助化疗中[6-8]。而在胶质瘤的化疗中,CTCC 与TMZ 是否具有协同作用并不清楚。因此,本研究以体外培养的U251 细胞为研究对象,初步分析了CTCC 和TMZ 对胶质瘤的化疗的影响。
材料与方法
1 主要试剂
TMZ(上海创赛科技有限公司);CTCC(重庆赛诺生物药业股份有限公司),在使用时,去掉胶囊,用DMSO 溶解药粉;兔源一抗KI-67、PCNA、Bcl-2、Bax、细胞色素C(cytochrome C,Cyt C)和Cleaved Caspase-3 和普通ECL 化学发光检测试剂盒、Dylight 488 或Dylight 594 或HRP 标记的羊抗兔IgG(武汉三鹰生物技术有限公司);RIPA 试剂、细胞质/核分离试剂盒、Bradford 蛋白浓度测定试剂盒、SDS-PAGE 凝胶制备试剂盒、BSA-TBS 缓冲系统封闭液、Blotto A 封闭液、Western blot 专用一抗和二抗稀释液、SDS-PAGE 蛋白上样缓冲液(武汉博士德生物科技有限公司);细胞固定液(北京百瑞极生物科技有限公司)。
2 主要仪器
超净工作台(苏州净化设备有限公司);DTY-2000 脱色摇床(北京德天佑科技发展有限公司);DNM-9602A 酶标仪(北京普朗新技术有限公司);IRX50 荧光显微镜(舜宇光学科技 (集团)有限公司);EXFLOW 流式细胞仪(深圳市达科为生物技术股份有限公司);化学发光成像及分析系统(上海勤翔科学仪器有限公司)。
3 细胞培养
将人神经胶质瘤U251 细胞购自广州赛业生物科技有限公司,将其置于含10%胎牛血清的低糖DMEM 培养基内,于37 ℃、5% CO2和饱和湿度的条件培养,待生长融合度达90%时,行1∶3 传代。
4 MTT 法筛选CTCC 和TMZ 对U251 细胞的作用浓度与实验分组
用不同浓度的CTCC 和TMZ 处理U251 细胞48 h 后,用MTT 法检测细胞活力,然后求出IC50值。实验步骤如下:
①CTCC 量效设计:0 mg/mL、0.5 mg/mL、1 mg/mL、1.5 mg/mL、2 mg/mL、2.5 mg/mL、3 mg/mL。
②TMZ 量效设计:0 μmol/L、10 μmol/L、25
μmol/L、50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L。
③将对数生长期的U251 细胞接种到96 孔板(1×104个/孔)中,于37℃细胞培养箱培养24 h,然后吸掉旧培养基,分别加入含不同浓度(0 mg/mL、
0.5 mg/mL、1 mg/mL、1.5 mg/mL、2 mg/mL、2.5 mg/mL、3 mg/mL)CTCC 和/ 或含不同浓度(0
μmol/L、10 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L)TMZ 的DMEM培养液预处理细胞30 min,每组设置3 个复孔,同时设置校准孔、溶剂对照孔,再用新培养基培养48 h 后,弃去培养液,向每孔加入新鲜培养液及10 μL MTT 溶液(5 mg/mL,即0.5% MTT),在37℃孵育4 h,再加入100 μL 二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,在490 nm 的波长下,用酶标仪测量每个孔的OD 值,计算出IC50值。根据计算结果,CTCC 的IC50值的中位数1.796(95%CI:1.666~2.047)mg/ml,TMZ 的IC50值的中位数106.2(95%CI:83.98~153.1)μmol/L。为了后续实验简便,后续实验采用的CTCC 的浓度为2 mg/mL,CTCC 的浓度为100 μmol/L。将U251 细胞分为对照组、CTCC 处理组(2 mg/mL),TMZ 处理组(100 μmol/L),CTCC+TMZ 处理组,即除对照组外,分别用2 mg/ml CTCC 或/和100 μmol/L TMZ预处理细胞30 min。
5 MTT 检测各组细胞活力
将对数生长期的U251 细胞接种到96 孔板(1×104个/孔)中,于37 ℃细胞培养箱培养24 h,然后吸掉旧培养基,按照前述分组方法预处理细胞30 min,再培养48 h,用MTT 法检测细胞活力。细胞活力=(实验组OD 值-溶剂对照孔OD 值)/(对照组OD 值-溶剂对照孔OD 值)×100%。
6 集落形成实验检测各组细胞集落形成能力
将U251 细胞按照前述分组方法预处理细胞30 min,收集细胞并进行计数。12 孔板种板,每个孔中加入1000 个细胞,放入CO2培养箱常规培养7 d,根据细胞状态进行培养基的更换,弃掉培养基,用PBS 进行清洗2 次(注意清洗力度,一定要轻柔),于12 孔板内加入1 mL 细胞固定液,30 min,弃掉细胞固定液,用PBS 进行清洗2 次,于12 孔板内加入1 mL 0.1%结晶紫,3 min,弃掉结晶紫,用PBS进行清洗至孔板底部清洗,拍照计数。
7 JC-1 探针检测各组细胞线粒体去极化
将U251 细胞按照前述分组方法预处理细胞30 min,再培养48 h 后,收集细胞,并重悬于1 mL EP管内,加入0.5 mL JC-1 探针染色工作液37℃避光孵育30 min,流式细胞仪上进行检测。
8 Annexin V/PI 染色与TUNEL 染色检测各组细胞凋亡
将U251 细胞按照前述分组方法预处理细胞30 min,再培养48 h 后,再分别按Annexin V/PI 染色与TUNEL 染色法检测各组细胞凋亡。
Annexin V/PI 染色步骤:收集各组细胞,加入200 µL Annexin V-FITC 结合液,避光条件下,加入5 µL Annexin V-FITC,轻轻混匀,再加入10 µL PI 染色液,轻轻混匀,室温(22 ~25 ℃)孵育20 min,在流式细胞仪上进行检测。
TUNEL 染色步骤:用细胞固定液固定细胞1 h,PBS清洗以后,加0.1% Triton X-100通透细胞5 min,避光条件下,加入100 µL TUNEL 染色液,室温(22~25℃)孵育60 min,加入DAPI 染液3 min,荧光显微镜下观察。
9 免疫荧光观察各组细胞Ki-67 和PCNA 表达
将U251 细胞按照前述分组方法预处理细胞30 min,然后进行细胞爬片48 h。用细胞固定液固定细胞1 h,PBS 清洗以后,加0.1% Triton X-100通透细胞5 min,用5% BSA 封闭1 h,分别用Ki-67、PCNA 一抗(均1∶1000)37 ℃孵育2 h,PBS清洗后,分别孵育Dylight 488 或594 标记的羊抗兔IgG(H+L)二抗(均1∶1000),室温(22 ~25 ℃)孵育60 min,加入DAPI 染液3 min,荧光显微镜下观察。
10 Western blot 检测各组细胞Ki-67、PCNA、Bcl-2、Bax、Cyt C 和Cleaved Caspase-3 表达
将U251 细胞按照前述分组方法预处理细胞30 min,然后培养48 h。收集细胞,并按说明书方法,用RIPA 提取总蛋白,用细胞质/核分离试剂盒提取细胞质蛋白。取适量蛋白质样品(30 μg/样),进行SDS 变性10%聚丙烯酰胺凝胶电泳,分离蛋白后停止电泳,取出凝胶,置于转膜专用的三明治夹中将凝胶中的蛋白质转移到PVDF 膜上形成印记。将膜置于Blotto A 中,室温密封2 h。分别加入Ki-67(1∶2000)、PCNA(1∶2000)、Bcl-2(1∶4000)、Bax(1∶1000)、Cyt C(1∶500)、Cleaved Caspase-3
(1∶1000)和GAPDH(1∶5000)单克隆抗体,4 ℃摇动孵育过夜。将膜置于1 ×TBST 溶液中,摇动漂洗5 min,共4 次。将膜置于含有HRP 标记羊抗兔IgG(H+L)二抗(1∶800)的Blotto A 中,室温摇动孵育1.5 h。将膜置于1 ×TBST 溶液中,摇动漂洗5 min,共4 次。ECL 法显像,用化学发光成像分析系统捕获膜并分析每个蛋白质带的光密度值。该方法计算每个样品的蛋白质波段光密度值和对应值GAPDH(内参)比值,得到校正后的蛋白质波段光密度值,以对照组为进行标准化,并绘制代表蛋白表达的柱状图。
11 统计学分析
使用SPSS 22.0 进行数据分析。结果表示为均值±标准差,多组之间均数的两两比较采用方差分析事后Tukey 成对检验。P<0.05 表示有统计学差异。
结 果
1 CTCC 与TMZ 协同抑制胶质瘤细胞增殖
与对照组比较,其余3 组细胞的活力、集落形成能力以及Ki-67 和PCNA 表达均降低;且CTCC+TMZ处理组变化较CTCC处理组和TMZ处理组变化更为明显(图1)。
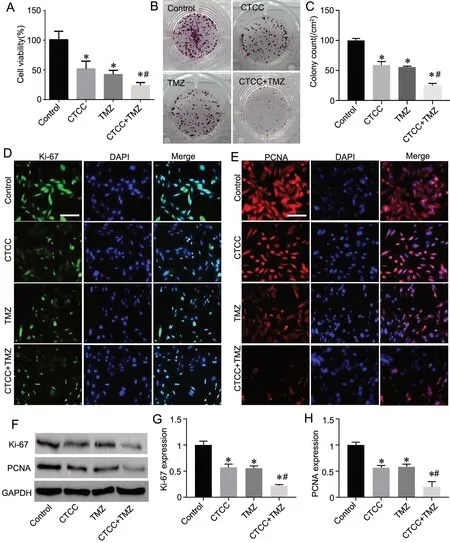
图1 CTCC 与TMZ 协同抑制胶质瘤细胞增殖。A,各组细胞活力的柱状图;B 和C,各组细胞集落(B)和集落计数的柱状图(C);D 和E,各组Ki-67(D)和PCNA(E)代表性免疫荧光图;F—H,各组Ki-67 和PCNA 代表性Western blot 条带(F)以及Ki-67(G)和PCNA(H)相对表达量的柱状图。比例尺,20 μm。与对照组比较:*P<0.05 ;与CTCC 组或TMZ 组比较:#P<0.05;n=3Fig. 1 CTCC and TMZ synergistically inhibit glioma cell proliferation. A, histogram of cell viability in each group; B and C, cell colonies of each group (B) and histogram of colony counts (C); D and E, representative immunofluorescence images of Ki-67 (D) and PCNA (E) in each group; F to H,representative Western blot bands for Ki-67 and PCNA (F) and relative expression levels of Ki-67 (G) and PCNA (H) in each group. Scale bar, 20 μm.P<0.05, compared with Control group; #P<0.05, compared with CTCC group or TMZ group; n=3
2 CTCC 与TMZ 协同促进胶质瘤细胞凋亡
与对照组比较,其余3 组细胞的细胞凋亡比例、TUNEL 阳性率以及Cleaved Caspase-3 表达均增加;其中CTCC+TMZ 处理组变化较CTCC 处理组和TMZ 处理组变化更为明显(图2)。
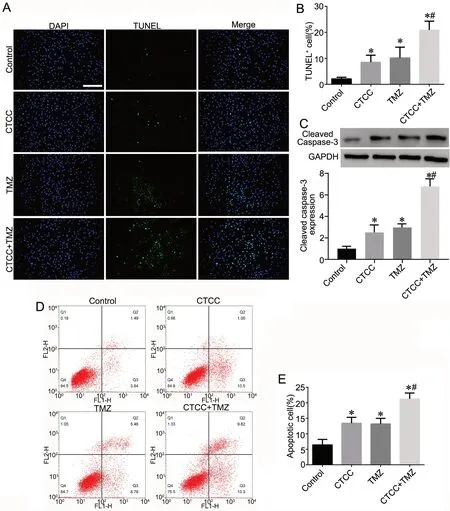
图2 CTCC 与TMZ 协同促进胶质瘤细胞凋亡。A 和B,各组代表性TUNEL 染色图(A)以及TUNEL 阳性率的柱状图(B)。C,Western blot 检测各组Cleaved caspase-3 表达。D 和E,各组细胞凋亡的代表性流式细胞散点图(D)以及凋亡率的柱状图(E)。比例尺,200 μm。与对照组比较:*P<0.05;与CTCC 组或TMZ 组比较:#P<0.05;n=3Fig. 2 CTCC and TMZ synergistically promote glioma cell apoptosis. A and B, representative TUNEL staining images (A) and histogram of TUNEL positive rates (B) in each group. C, Western blot of the Cleaved caspase-3 expression of each group.D and E, representative flow cytometry scatter plots of apoptosis (D) and histogram of apoptosis rates (E) in each group. Scale bar, 200 μm. *P<0.05, compared with Control group; #P<0.05, compared with CTCC group or TMZ group; n=3
3 CTCC 与TMZ 对线粒体去极化/Bcl-2/Bax 机制的协同调控作用
与对照组比较,其余3 组细胞的Bcl-2 表达均降低,而线粒体去极化、Cyt C 释放和Bax 表达均增加;其中CTCC+TMZ 处理组变化较CTCC 处理组和TMZ 处理组变化更为明显(图3)。
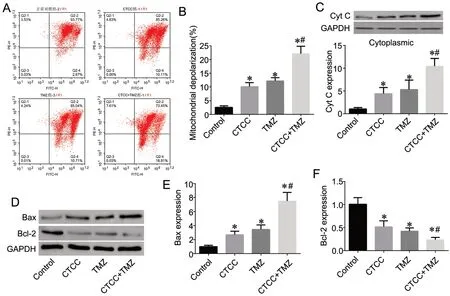
图3 CTCC 与TMZ 对线粒体去极化/Bcl-2/Bax 机制的协同调控作用。A 和B,各组JC-1 染色的代表性流式细胞散点图(A)以及线粒体去极化率的柱状图(B);C,Western blot 检测各组细胞质中Cyt C 表达;D—F,各组Bax 和Bcl-2 代表性Western blot 条带(D)以及Bax(E)和Bcl-2(F)相对表达量的柱状图。与对照组比较:*P<0.05;与CTCC 组或TMZ 组比较:#P<0.05;n=3Fig. 3 Synergistic regulation of CTCC and TMZ on mitochondrial depolarization /Bcl-2/Bax mechanism. A and B, representative flow cytometry scatter plots of JC-1 staining (A) and histogram of mitochondrial depolarization rates (B) in each group; C, Western blot of the expression of Cyt C in cytoplasm of each group; D to F, representative Western blot bands for Bax and Bcl-2 (D) and histogram of the relative expression levels of Bax (E) and Bcl-2 (F)in each group. *P<0.05, compared with Control group; #P<0.05, compared with CTCC group or TMZ group; n=3
讨 论
脑胶质瘤为临床脑肿瘤常见的恶性病变,具有较强侵袭性和病死率,患者预后不佳[1]。目前医疗技术尚无法实现脑胶质瘤完全治愈的效果,因此如何有效延长患者的生存期成为改善其预后的主要治疗方向[4,5]。TMZ 为烷化剂类化疗药物,机体正常生理酸碱度水平下其能够快速转化为5-咪唑-4-酰胺,可阻断肿瘤细胞的DNA 复制,且具有较高的血脑屏障通过率,对于颅内肿瘤治疗有较佳效果[2]。但随着TMZ 化疗周期的延长,部分脑胶质瘤患者对其产生的抵抗作用逐渐增强,疾病控制率不佳[3]。因此临床治疗中应积极寻求有效联合治疗药物,以进一步完善临床治疗方案,改善脑胶质瘤患者的化疗效果,改善患者预后。
CTCC 已在临床中用于多种肿瘤的治疗或辅助治疗[6-8]。近来研究还显示,CTCC 还能增加如GP(吉西他滨和顺铂)化疗方案对中晚期肺癌患者的疗效并增强免疫功能[9,10],增加BEV(贝伐珠单抗)+TC(紫杉醇+卡铂)[11]或脂质体阿霉素[12]化疗方案对复发性卵巢癌患者疗效,等。但,CTCC 对TMZ在胶质瘤治疗中的作用并不清楚。因此,本研究以体外胶质瘤细胞模型探讨了CTCC和TMZ二者在胶质瘤细胞的化疗中是否具有协同作用,结果显示,相对于单用CTCC 或TMZ,二者联用在U251 细胞的抑增殖和促凋亡中效果更为显著,说明二者在抗胶质瘤中可能具有协同作用。本研究进一步探讨了产生上述结果的可能原因。线粒体途径机制在调控细胞增殖与命运的机制中占据着中心地位[13,14]。众多研究[13-15]显示,诱导线粒体去极化造成线粒体膜通透性改变,进而释放Cyt C,改变Bcl-2/Bax 表达,最终能抑制下游促增殖蛋白如PCNA 和Ki67 表达,而促进凋亡蛋白执行者Caspase 3 的活化。本研究显示,CTCC 和TMZ 二者联用能增加线粒体去极化、降低Bcl-2 并增加Bax 表达,且下游PCNA 和Ki67表达降低和Caspase 3 的剪切,说明CTCC 和TMZ对胶质瘤细胞的化疗协同作用至少与其促进线粒体凋亡途径有关。
综上所述,CTCC 和TMZ 在抑制胶质瘤细胞的增殖和促进细胞凋亡的中具有协同作用,其机制可能与其诱导线粒体凋亡途径有关。

