褪色HE 染色切片ALK 基因融合检测可行性探索
李钦丽,张继伟*
(1 华中科技大学同济医学院附属协和医院病理科,武汉 430022;2 武汉市东西湖区人民医院检验科,武汉 430040)
随着间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂的研发与临床应用取得较大突破,ALK 基因融合已成为非小细胞肺癌(NSCLC)患者重要的驱动靶点,ALK 阳性的NSCLC 患者可显著获益于ALK 抑制剂[1]。临床检测中常用于ALK检测的方法主要包括免疫组织化学(IHC)、荧光原位杂交(FISH)和荧光定量PCR (qRT-PCR)等。因与其他检测方法相比,RT-PCR 法由于检测周期短、结果易于判读及可与EGFR 等其它驱动基因进行联合检测等优点,而得到广泛应用,但RT-PCR 法进行ALK 融合基因检测是基于mRNA 的扩增,其对于样本质量的要求较高[2]。本研究通过对HE 染色切片褪色后用RT-PCR 法行ALK 融合基因的检测进行分析,探讨褪色后的样本能否满足ALK 融合基因的检测,能否为肿瘤组织不足NSCLC 患者的后续治疗提供可靠依据。
材料与方法
1 材料
选取华中科技大学同济医学院附属协和医院病理科经检测确认ALK 基因融合为阳性的NSCLC 标本3 例,每例标本各选取一个蜡块,4 µm 厚连续切片6 张,随机分为对照组(未进行HE 染色的石蜡样本切片)、HE 染色切片高锰酸钾草酸褪色组和HE染色切片盐酸乙醇褪色组,每组2 张切片。
核酸提取试剂盒(FFPE RNA)和人类ALK 基因融合检测试剂盒(荧光定量PCR 法)购自厦门艾德公司;ALK Ventana-D5F3 OptiView DAB检测试剂盒购自美国罗氏公司;ALK 基因重组荧光原位杂交法检测试剂盒(Vysis ALK Break Apart FISH Probe Kit)购自美国雅培公司。Mx3000P 型荧光定量PCR 仪购自美国安捷伦公司;SMA4000 超微量紫外可见核酸蛋白分析仪购自厦门艾德公司;CLEARERTM (康莱)透明脱蜡剂购自武汉同声科技发展有限公司。
2 方法
2.1 HE 染色
组织切片65 ℃烤片3 min,康莱2 次×5 min,康莱1 次×3 min,无水乙醇1 次×3 min,无水乙醇1 次×2 min,90%和80%乙醇各1 次×30 s,水洗2 min,苏木精染液浸染10 min,水洗2 min,0.3%盐酸乙醇分化1 s,水洗1 min,饱和碳酸锂水溶液返蓝15 s,水洗1 min,80%乙醇醇化30 s,1%醇溶性伊红染液浸染40 s,80%乙醇15 s,90%乙醇30 s,无水乙醇2 次×1 min,,二甲苯2 次×2 min,中性树胶封片,显微镜下观察。
2.2 HE 褪色
将HE 切片加热后,置入康莱中浸泡至盖玻片自行脱落。洗净残存的中性树胶后,梯度乙醇(100%、95%、85%、75%)脱去康莱,用蒸馏水冲洗后采用以下2 种方法褪色。方法一:将切片放入新鲜配置的1%盐酸乙醇,待组织完全变白后用蒸馏水冲洗干净,显微镜下观察褪色效果。方法二:将切片放入0.5%高锰酸钾氧化,蒸馏水冲洗干净,2%草酸溶液漂白,待组织完全变白后用蒸馏水冲洗干净,显微镜下观察褪色效果。
2.3 标本RNA 的提取和定量
按照核酸提取试剂盒(FFPE RNA)说明书的操作方法,提取3 组标本的RNA,并用SMA4000 超微量紫外可见核酸蛋白分析仪测量RNA 的浓度及纯度。
2.4 逆转录反应
取出相应数量的ALK 逆转录反应管,室温解冻后,快速离心15 s;取出ALK 逆转录酶,快速离心15 s,放置于冰架上;分别移取0.5 µL ALK 逆转录酶至ALK 逆转录反应管中,混匀后快速离心15 s;移取6 µL 待测样本RNA 至ALK 逆转录反应管中,混匀后快速离心15 s; 42 ℃ 1 h,95 ℃ 5 min 后冰上冷却,得到的cDNA 溶液用于PCR 扩增。
2.5 PCR 扩增和结果判读
取出预分装的PCR 反应试剂,按照人类ALK基因融合检测试剂盒的要求依次分别加入纯化水作为阴性对照、待测样本RNA 逆转录得到的cDNA 和ALK 阳性质控品作为阳性对照,盖紧管盖短暂离心后,放入荧光定量PCR 仪进行扩增。扩增条件为第一阶段:95℃ 5 min,1 个循环;第二阶段:95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15 个循环;第三阶段:93℃ 25 s,60 ℃35 s,72 ℃ 20 s,31 个循环。60 ℃时收集FAM 标记的ALK 荧光探针和HEX 标记的外控荧光探针的荧光信号。EML4-ALK扩增所用引物序列:上游——5’-AAAACTACTGTAGAGCC-3’,下游——5’-AGCTCCATCTGCATGGCTTG-3’;外控HPRT1 扩增所用引物序列:上游——5’-TTTCCTTGGTCAGGCAGTATAATCC-3’,下游——5’-TTATATCCAACACTTCGTGGGGTCC-3’。PCR 扩增结束后,严格按照人类ALK 基因融合检测试剂盒的判读要求进行样本结果判读。
2.6 RNA 完整性检测
RNA 的降解程度可以根据RNA Integrity Number (RIN)值[3]进行评定,RIN 值范围为1~10,不同数值代表着样品RNA 的不同降解程度,RIN 值越高,表明RNA 质量越好。RIN 值用Agilent 2100 Bioanalyser 和 RNA 6000 LabChip 进行检测。
2.7 免疫组织化学与荧光原位杂交
ALK Venana-D5F3 免疫组织化学用OptiView DAB 检测试剂盒在 BenchMark XT 自动染色机上进行染色,染色步骤遵循标准的操作程序,由两名有经验的病理科诊断医生进行结果判读。使用Vysis ALK break-apart FISH probes Kit 进行FISH 检测,按照试剂盒说明书进行手工操作及结果评估。
3 统计学分析
所有数据采用SPSS22.0 统计软件进行数据分析。计量资料用表示,两组间比较采用配对样本t检验,P< 0.05 为结果具有统计学意义。
结 果
1 HE 染色与褪色降低RNA 浓度
按照核酸提取试剂盒的要求进行RNA 提取,各组样本RNA 均用50 µL 的洗脱液进行洗脱。3 组样本RNA 的纯度均在1.8~2.0 之间,差异无统计学意义;高锰酸钾草酸褪色组RNA 浓度低于对照组,盐酸乙醇褪色组RNA 浓度低于高锰酸钾草酸褪色组和对照组(表1)。
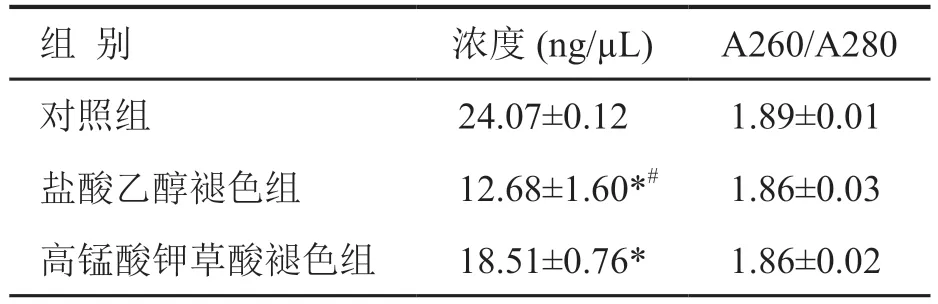
表1 RNA 的浓度和纯度比较Tab. 1 The comparison of RNA concentration and purity
2 HE 染色盐酸乙醇褪色对ALK 融合基因qRTPCR 检测无明显影响
按照人类ALK 基因融合检测试剂盒的要求,各组样本均用60 ng RNA 进行逆转录后,进行ALK 基因融合检测。对照组外控曲线和ALK 基因融合曲线的Ct 值分别为19.98±0.37 和18.23±0.32,盐酸乙醇褪色组外控曲线和ALK 基因融合曲线的Ct 值分别为19.41±0.20 和18.76±0.17,两者之间的差异无统计学意义(图1),符合试剂盒的结果判读标准,为明确的ALK 基因融合阳性,而高锰酸钾草酸褪色组的外控和ALK 基因融合均无扩增曲线升起(图1),无法进行结果判读。

图1 HE 染色盐酸乙醇褪色对ALK 基因融合qRT-PCR 检测的影响分析。A,外控扩增曲线;B,ALK 基因融合扩增曲线;红色曲线,阳性对照;灰色曲线,阴性对照;绿色曲线,白片组;黄色曲线,盐酸乙醇褪色组;蓝色曲线,高锰酸钾草酸褪色组Fig. 1 Analysis of effect of HE stained section discoloration by hydrochloric acid ethanol on RT-qPCR detection of ALK fusion gene. A, externally controlled amplification curve; B, ALK gene fusion amplification curve; red curve, positive control; gray curve, negative control; green curve, control group; yellow curve, hydrochloric ethanol fading group; blue curve, potassium permanganate oxalate fading group
3 HE染色盐酸乙醇褪色对RNA完整性无明显影响
为明确HE 切片褪色样本RNA 对RT-PCR 法检测ALK的影响,本研究利用Agilent 2100 Bioanalyser分析了各组样本RNA 的完整性。通过对3 组样本RNA 的RIN 值分析比较发现,盐酸乙醇褪色组RIN值(2.23±0.13)与对照组(2.28±0.10)相近,高锰酸钾草酸褪色组的RIN 值(1.73±0.12)明显低于对照组和盐酸乙醇褪色组(图2)。
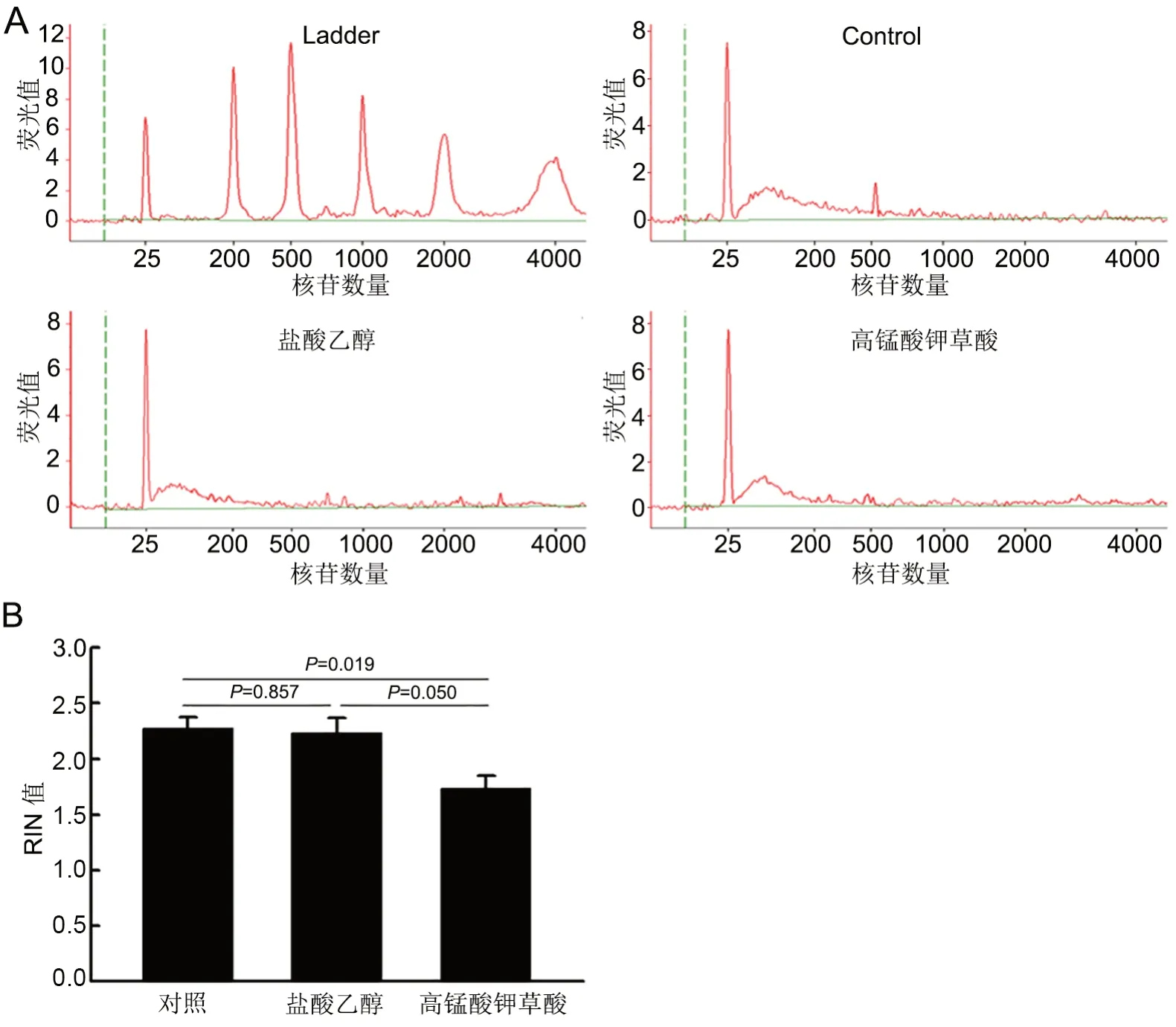
图2 HE 染色与褪色对RNA 完整性影响的的Agilent 2100 检测。A,RNA 完整性代表性Agilent 2100 检测结果; B,RIN 值统计学分析(n=3)Fig. 2 Agilent 2100 detection for the effect of HE staining and fading on the integrity of extracted RNA. A, representative Agilent 2100 detection of RNA intergrity; B, quantitative analysis of RIN value (n=3)
4 HE 染色与褪色不改变ALK 基因融合状态
为保证实验结果的准确性和可靠性,本研究最后通过免疫组织化学与荧光原位杂交对所选择的经RT-PCR 检测ALK 基因融合为阳性的3 例NSCLC标本进行验证,结果表明3 例NSCLC 标本ALK Ventana-D5F3 免疫组织化学染色和ALK-FISH 均为明确阳性(图3)。
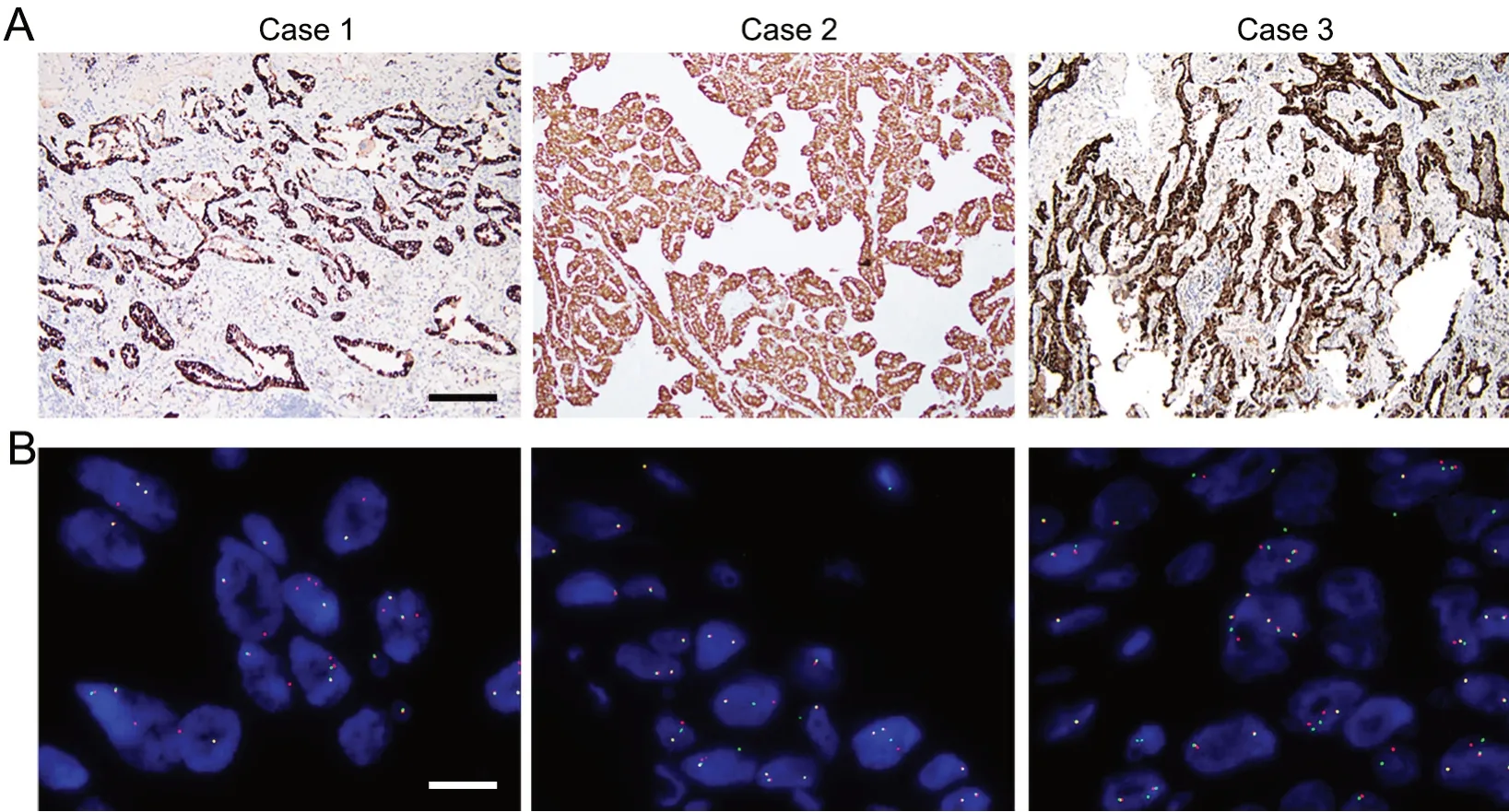
图3 HE 染色与褪色对ALK 基因融合状态的影响。A,ALK Ventana-D5F3 免疫组织化学检测;B,ALK-FISH 检测。比例尺:A,50 µm;B,5 µmFig. 3 The effect of HE staining and fading on the fusion status of ALK gene. A, ALK Venana-D5F3 immunohistochemical examiantion; B, ALK-FISH examination; scale bar∶ 50 µm in A, 5 µm in B
讨 论
对于不可进行手术的晚期NSCLC 患者,如果ALK 基因融合检测阳性可显著受益于ALK 抑制剂治疗,这一发现使得ALK成为NSCLC中除EGFR外的另一个重要检测靶点[4]。中国非小细胞肺癌ALK检测临床实践专家共识推荐的ALK 检测人群主要包括:①病理学诊断为肺浸润性腺癌(包括含腺癌成分)的患者;②经活检组织病理学诊断为非腺癌的晚期NSCLC 患者[2]。NSCLC 患者ALK 基因融合检测标本类型首选肿瘤组织标本;如果肿瘤组织标本不能满足检测需求时,可以用细胞学标本替代;对于组织或者细胞学标本获取均受限的晚期NSCLC患者,也可以用血液或脑脊液进行检测。但在实际检测过程中由于细胞学标本和血液或脑脊液标本受到肿瘤细胞比例和检测方法的限制,利用肿瘤组织标本进行ALK 基因融合检测仍然是目前最可靠、最敏感的检测方法。对于失去手术机会的晚期NSCLC患者,已不能获取肿瘤组织标本,或者仅能获取穿刺活检标本,经常规病理诊断后剩余较少组织,将影响后续检测工作。
研究证实HE褪色后可以进行免疫组织化学[5]、荧光原位杂交(FISH)[6]和特殊染色[7]的检测,由此解决了由于组织量少而无法进行相应检测的问题,对于病理诊断有重要价值。但是利用HE 切片褪色后提取RNA 进行ALK 基因融合检测,目前国内鲜有报道。以往研究发现苏木精染色对PCR 检测可造成显著影响[8],因此,HE 染色切片彻底褪色是进行基因检测的前提。
本研究通过采用盐酸乙醇褪色法和高锰酸钾草酸氧化漂白法对HE 染色切片褪色,并对从褪色HE染色切片提取的RNA的浓度和纯度进行分析比较,结果发现两组RNA 的纯度与对照组相比无显著差异,但RNA 浓度却显著降低,其中盐酸乙醇褪色组的RNA 浓度也显著低于高锰酸钾草酸褪色组。原因可能为由于RNA 不稳定,组织在进行HE 染色和褪色过程中不同程度地导致了RNA 的降解,其中用盐酸乙醇褪色法导致RNA 降解的程度更大。
本研究将3 组标本RNA 用RT-PCR 法行ALK基因融合检测,在RNA 均为 60 ng 条件下,盐酸乙醇褪色组外控Ct 值和ALK 基因融合Ct 值与对照组相比无显著差异,均为明确的ALK 基因融合阳性,而高锰酸钾草酸褪色组外控和ALK 基因融合均无曲线升起。通过检测3 组标本RNA 的RIN 值,发现其原因可能为HE 染色切片经高锰酸钾草酸褪色时,尽管获取的RNA 浓度高于盐酸乙醇褪色组,但是由于高锰酸钾为强氧化剂,在处理过程中严重破坏了RNA 的完整性所致。
综上所述,对于样本量不足或进一步获取组织样本受限时,可以用HE 染色切片褪色后通过RTPCR 法行ALK 基因融合检测,但褪色方法应选择1%盐酸乙醇褪色法,因为该方法与高锰酸钾草酸氧化漂白法相比,能较好地保证有效RNA 的质量,保证ALK 基因融合检测结果的可靠性。同时本研究也为样本量不足的NSCLC 患者进行ROS1 和RET 融合检测及利用二代测序(NGS)技术检测未知的ALK基因融合奠定了基础,有利于NSCLC 患者个体化治疗方案的实施。

