番泻叶苷A 对糖尿病肾病大鼠足细胞自噬的影响
王 凯,孙林成,余 婓,刘凤勋
1.河南省南阳市第一人民医院肾病内科,南阳 473000;2.郑州大学第一附属医院肾内科,郑州 450000
糖尿病肾病(diabetic nephropathy,DN)作为终末期肾功能衰竭的主要原因,是糖尿病患者最严重的并发症之一[1],DN 特征包括持续性白蛋白尿(albuminuria,Alb)、肾小球滤过率降低和出现糖尿病肾脏组织病理学衰退[2]。DN 蛋白尿增多与足细胞损伤相关,其中足细胞上皮-间质转化(epithelial mesenchymal transformation,EMT)通过诱导足细胞脱离或凋亡,广泛参与糖尿病足细胞损伤缺失的早期阶段[3]。自噬过度激活或抑制均可导致足细胞损伤,研究发现,糖尿病引起的代谢紊乱可降低机体细胞自噬水平,导致足细胞自噬不足[4-5]。沉默信息调节因子1(silent information regulator-1,Sirt 1)为自噬核底物,可通过自噬蛋白微管相关蛋白1 轻链3(icrotubule associated protein 1 light chain 3,LC3)参与细胞质自噬体-溶酶体降解[6]激活Sirt 通路,可增强自噬并减轻DN 氧化应激[7]。番泻叶苷A(sennoside A,SA)具有降血糖、抗纤维化、抗炎、抗菌等多种药理特性[8],还可改善DN[9]。本实验拟通过观察SA 对链脲佐菌素(streptozotocin,STZ)诱导的DN 大鼠肾组织及足细胞的作用探讨其可能的机制。
1 仪器与材料
1.1 仪器
FC 型全自动酶标仪(美国赛默飞世尔科技有限公司);FluorChem M 化学发光凝胶成像系统(美国ProteinSimple 公司)。
1.2 试药
番泻叶苷A(sennoside A,SA,质量分数≥98%,批号81-27-6,上海沪峥生物科技有限公司);盐酸贝那普利片(规格为10 mg,成都地奥制药集团有限公司);链脲佐菌素(批号S8050,北京索莱宝科技有限公司);白蛋白尿酶联免疫吸附试验(ELISA)试剂盒(上海瓦兰生物科技有限公司);兔抗LC3 多克隆抗体(Proteintech 中国公司);兔抗Bcl-2 相互作用蛋白(Bcl-2 interacting coiled-coil protein 1,Beclin-1)多克隆抗体(武汉艾美捷生物科技有限公司);兔抗肾病蛋白nephrin 单克隆抗体、兔抗E-钙黏蛋白(Ecadherin,E-cad)、兔抗波形蛋白(vimentin,Vim)、兔抗Sirt1 单克隆抗体均购自美国Abcam 公司。
1.3 动物
SPF 级雄性7 周龄Wistar 大鼠60 只,体质量为(180±20) g,购自长沙市天勤生物技术有限公司,许可证号为SCXK(湘)2019-0013。恒温(24±2) ℃、恒湿(相对湿度为50%~60%)环境下饲养,给予充足水和普通饲料,12 h 光-暗交替,适应性培养1 周。
2 方法
2.1 造模、分组及给药
随机挑选10 只大鼠作为正常组,剩余大鼠用于构建DN 大鼠模型[10]:断食12 h,连续2 d 腹腔注射55 mg·kg-1STZ(柠檬酸缓冲液稀释),每日1 次,72 h后经尾静脉采血检测空腹血糖(fasting blood glucose,FBG),当FBG 值连续3 d≥16.7 mmol·L-1视为糖尿病大鼠,1 周后检测Alb,阳性表达表明功能损害,DN模型大鼠成功构建。正常组大鼠注射等量柠檬酸缓冲液。成功建模的41 只大鼠,随机剔除1 只,剩余大鼠随机分为模型组、SA 低剂量组、SA 高剂量组及贝那普利组,每组10 只。SA 低剂量组、SA 高剂量组大鼠每日分别灌胃给予SA 40、80 mg·kg-1,贝那普利组大鼠每日灌服给予盐酸贝那普利片10 mg·kg-1,模型组及正常组大鼠每日灌服等量生理盐水,连续给药21 d。
2.2 样品采集与处理
末次给药结束后,通过代谢笼单独收集每只大鼠的24 h 尿液以检测Alb 含量;腹腔注射戊巴比妥钠45 mg·kg-1麻醉大鼠,尾静脉采血、眼眶采血,用全自动生化分析仪检测各组大鼠空腹FBG、血清肌酐(serum creatinine,Scr)及血尿素氮(BUN);颈椎脱臼处死大鼠,采集肾脏,将左肾部分保存于多聚甲醛中,用于组织病理学染色;取右肾1 cm3肾皮质保存于戊二醛中,用于超微结构分析;剩余部分均保存于液氮中,用于蛋白印迹法(Western blotting)检测。
2.3 ELISA 法检测24 h Alb 含量
24 h 尿液于4 °C 以3 500 r·min-1离心10 min,收集上清液。设置对照品孔和样本孔,分别加入对应体积对照品及稀释(5 倍稀释)后样品,于各孔加入HRP 标记的抗体,37 °C 温育1 h,洗板,加入底物A、B 避光孵育,终止液终止反应,在450 nm 波长处测定各孔吸光度(A)值,以对照品质量浓度为横坐标(x)、A值为纵坐标(y)绘制标准曲线,并计算Alb 含量。
2.4 HE 染色
肾组织经多聚甲醛固定过夜,常规石蜡包埋并制备成2 μm 厚度切片,常规脱蜡至水,用苏木精染液染色5 min,用盐酸乙醇分化5 s,用伊红染色3 min,脱水、透明,用中性树胶封片,镜下观察并采集图片。
2.5 Masson 染色
组织切片常规脱蜡至水,用Weigert 铁苏木素染色液染色5 min,用盐酸乙醇分化20 s,用蓝化液返蓝,用丽春红染色5 min,用乙酸工作液洗涤,用磷钼酸处理,用乙酸工作液洗涤,脱水、透明,用中性树胶封片,镜下观察并采集图片。胶原纤维染色呈蓝色,用于评估肾纤维化。
2.6 PAS 染色
组织切片经常规脱蜡至水,高碘酸氧化20 min,水洗,用Schiff 染液避光染色15 min,水洗,用苏木素染色5 min,用水洗10 min 返蓝,脱水、透明、封片,用中性树胶封片,镜下观察并采集图片。PAS 糖原阳性呈紫红色。
2.7 透射电镜观察肾组织自噬体的形成
用戊二醛固定过夜,用锇酸溶液固定1.5 h,用梯度乙醇及丙酮脱水,脱水后组织块嵌入丙酮与环氧树脂等体积混合的浸透液中,4.5 h 后包埋,用超薄切片机制成超薄切片(50 nm),覆盖于200 目铜网上,在透射电子显微镜下观察自噬体形成。
2.8 Western blotting 检测肾组织中相关蛋白的表达水平
取液氮保存的肾组织,研钵碾碎,于4 ℃裂解液内裂解,以12 000 r·min-1离心10 min,取上清。测定蛋白质量浓度并加热变性,SDS-PAGE 电泳(压缩胶60 V,25 min;分离胶120 V,70 min)分离蛋白,湿转(200 mA,120 min)蛋白至PVDF 膜,将膜于50 mg·mL-1脱脂乳中封闭2 h,一抗(1×TBST 行1∶1 000 稀释)内4 ℃孵育14 h;1×TBST 洗膜6 次,二抗(1×TBST 行1∶8 000 稀释)内孵育2 h,1×TBST 洗膜6 次,用增强型化学发光(enhanced chemiluminescence,ECL)试剂于化学发光凝胶成像系统显影并记录。用Image J 软件分析条带灰度值,以目的蛋白LC3、Beclin-1、E-cad、Vim、Sirt1、nephrin 与内参GAPDH 灰度值比值表示蛋白的相对表达水平。
2.9 统计学方法
SPSS 26.0 软件分析数据,计量结果以(±s)表示,多计量样本比较用单因素方差分析,进一步组间两两比较用LSD-t检验。P<0.05为差异有统计学意义。
3 结果
3.1 大鼠24 h Alb 含量
组间大鼠24 h Alb 含量比较差异有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠24 h Alb 含量升高(P<0.05);与模型组比较,SA 低剂量组、SA 高剂量组及贝那普利组大鼠24 h Alb 含量降低(P<0.05);与SA 低剂量组比较,SA 高剂量组及贝那普利组大鼠24 h Alb含量降低(P<0.05),贝那普利组大鼠24 h Alb含量最低(P<0.05)。见表1。
表1 各组大鼠24 h Alb 含量的比较 (±s,n=10)Tab.1 Comparison of 24-hour Alb content of rats in each group (±s, n=10)

表1 各组大鼠24 h Alb 含量的比较 (±s,n=10)Tab.1 Comparison of 24-hour Alb content of rats in each group (±s, n=10)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与SA 低剂量组比较,cP<0.05;与SA 高剂量组比较,dP<0.05。
组别正常组模型组SA 低剂量组SA 高剂量组贝那普利组尿Alb/(mg·d-1)6.01±0.55 22.39±2.78a 19.37±2.35ab 14.17±1.96abc 10.88±2.02abcd
3.2 大鼠FBG、Scr 及BUN 水平
组间大鼠FBG 及Scr、BUN 水平比较差异有统计学意义(P<0.05)。与正常组比较,其他4 组3 项水平升高(P<0.05);与模型组比较,SA 低剂量组、SA 高剂量组及贝那普利组3 项水平降低(P<0.05);与SA 低剂量组比较,SA 高剂量组及贝那普利组3 项水平降低(P<0.05),贝那普利组3 项水平最低(P<0.05)。见表2。
表2 各组大鼠FBG 及Scr、BUN 水平的比较 (±s,n=10)Tab.2 Comparison of FBG, Scr and BUN levels of rats in each group (±s, n=10)
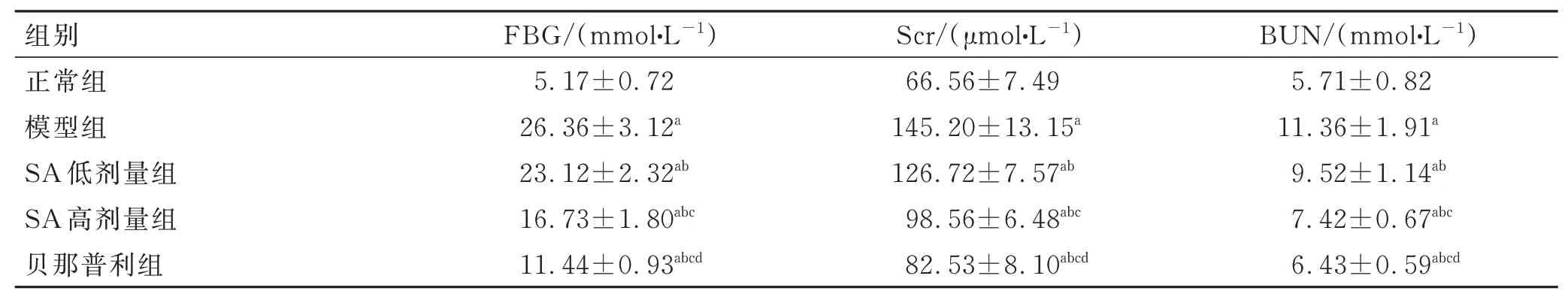
表2 各组大鼠FBG 及Scr、BUN 水平的比较 (±s,n=10)Tab.2 Comparison of FBG, Scr and BUN levels of rats in each group (±s, n=10)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与SA 低剂量组比较,cP<0.05;与SA 高剂量组比较,dP<0.05。
组别正常组模型组SA 低剂量组SA 高剂量组贝那普利组FBG/(mmol·L-1)5.17±0.72 26.36±3.12a 23.12±2.32ab 16.73±1.80abc 11.44±0.93abcd Scr/(μmol·L-1)66.56±7.49 145.20±13.15a 126.72±7.57ab 98.56±6.48abc 82.53±8.10abcd BUN/(mmol·L-1)5.71±0.82 11.36±1.91a 9.52±1.14ab 7.42±0.67abc 6.43±0.59abcd
3.3 大鼠肾脏组织的病理学变化
HE 染色结果显示,正常组大鼠肾组织中肾小球、肾小管形状规则,结构完整,未见有炎性浸润;模型组大鼠肾组织中肾小球增大膨出,肾小管管腔不完整,肾小球系膜及肾小管管腔厚度显著增加;SA低剂量组、SA 高剂量组及贝那普利组大鼠肾组织病理损伤情况有不同程度地减轻。见图1。
3.4 大鼠肾脏组织的胶原纤维沉积情况
Masson 染色结果显示,与正常组比较,模型组大鼠肾组织胶原纤维严重沉积,肾小球及肾小管蓝染较深;与模型组比较,3 个给药组肾组织蓝染范围逐渐缩小,胶原纤维沉积程度均逐渐减轻。见图2。

图2 各组大鼠肾组织Masson 染色结果(400×)Fig.2 Masson staining results of renal tissue of rats in each group (400×)
3.5 大鼠肾小球系膜细胞和基质增生的情况
PAS 染色结果显示,正常组糖原阳性染色区域较小,颜色较浅,肾小球基底膜较薄;模型组大鼠肾组织中肾小球基底膜和系膜糖原沉积明显,肾小球基底膜、系膜增厚;3 个给药组糖原阳性沉积程度逐渐减弱,区域有不同程度地缩小。见图3。

图3 各组大鼠肾组织PAS 染色的结果(400×)Fig.3 Results of PAS staining of renal tissue of rats in each group (400×)
3.6 大鼠肾组织中自噬体的形成情况
透射电镜观察结果显示,细胞中自噬体呈双层囊泡样结构。组间大鼠肾组织中自噬体数量差异有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠肾组织中自噬体数量减少(P<0.05);与模型组比较,3 个给药组组织中自噬体数量增加(P<0.05);与SA 低剂量组比较,SA 高剂量组及贝那普利组自噬体数量增加(P<0.05),贝那普利组自噬体数量显著增加(P<0.05)。见表3、图4。

图4 各组大鼠肾组织在透射电镜下自噬体-溶酶体观察(30 000×)Fig.4 Observation of autophagy lysosome in renal tissue of rats in each group under transmission electron microscope (30 000 ×)
表3 各组大鼠肾组织中自噬体的数量(±s,n=10)Tab.3 The number of autophagosomes in renal tissue of rats in each group (±s, n=10)

表3 各组大鼠肾组织中自噬体的数量(±s,n=10)Tab.3 The number of autophagosomes in renal tissue of rats in each group (±s, n=10)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与SA 低剂量组比较,cP<0.05;与SA 高剂量组比较,dP<0.05。
组别正常组模型组SA 低剂量组SA 高剂量组贝那普利组自噬体数量/(个·视野-1)6.20±0.87 1.60±0.66a 2.70±0.78ab 4.20±0.98abc 5.10±0.83abcd
3.7 大鼠肾组织中蛋白的相对表达情况
组间大鼠肾组织中LC3Ⅱ/LC3Ⅰ比值、Beclin-1、E-cad、Vim、nephrin 及Sirt1 蛋白相对表达量比较,差异有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠肾组织中LC3Ⅱ/LC3Ⅰ比值、Beclin-1、E-cad、nephrin 及Sirt1 蛋白的相对表达量降低,Vim蛋白的相对表达量升高(P<0.05);与模型组比较,3 个给药组LC3 Ⅱ/LC3 Ⅰ比值、Beclin-1、E-cad、nephrin 及Sirt1 蛋白相对表达量升高,Vim 蛋白相对表达量降低(P<0.05);与SA 低剂量组比较,SA 高剂量组及贝那普利组上述指标水平变化规律相同(P<0.05),贝那普利组更显著(P<0.05)。见表4、图5。

图5 各组大鼠肾组织内相关蛋白Western blotting 条带Fig.5 Western blotting bands of related proteins in renal tissue of rats in each group
表4 各组大鼠肾组织内目的蛋白的相对表达量( ±s,n=10)Tab.4 The relative expression of target proteins in renal tissue of rats in each group (±s, n=10)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与SA 低剂量组比较,cP<0.05;与SA 高剂量组比较,dP<0.05。
组别正常组模型组SA 低剂量组SA 高剂量组贝那普利组LC3Ⅱ/LC3I 2.62±0.42 0.31±0.04a 0.42±0.03ab 0.67±0.04abc 1.12±0.27abcd Beclin-1 0.42±0.04 0.11±0.02a 0.15±0.02ab 0.25±0.03abc 0.31±0.04abcd E-cad 0.56±0.05 0.18±0.02a 0.24±0.03ab 0.32±0.03abc 0.39±0.04abcd Vim 0.10±0.02 0.33±0.04a 0.29±0.03ab 0.21±0.03abc 0.13±0.02abcd Nephrin 0.88±0.05 0.13±0.02a 0.19±0.03ab 0.28±0.04abc 0.38±0.04abcd Sirt1 0.92±0.05 0.17±0.02a 0.21±0.03ab 0.32±0.03abc 0.45±0.04abcd
4 讨论
蛋白尿是早期DN 的常见特征,与肾小球肥大、肾小球基底膜增厚和系膜细胞外基质扩张有关[11];足细胞是一种高度分化的上皮细胞,附着在肾小球基底膜外表面,共同形成最终的过滤屏障以防蛋白质流失,其损伤时可致蛋白尿[12]。本研究经连续单次注射STZ,与正常组比较,模型组大鼠FBG、Scr、BUN 水平及24 h Alb 含量显著升高,表明成功构建DN 大鼠模型,另表明DN 大鼠肾脏机能受损;病理染色结果显示,与正常组比较,模型组大鼠肾组织明显可见肾小球及肾小管结构异常、完整性缺失,基底膜及系膜增厚,胶原蛋白严重沉积等病理变化,表明DN 大鼠肾功能受损可能是因为肾组织病理改变引起足细胞损伤进而导致过滤屏障受损。
SA 作为大黄的主要活性成分可广泛用于治疗肥胖和便秘,可通过肠道细菌转化为活性代谢物大黄酸蒽酮[13]。一项关于大黄治疗动物DN 的系统评价和荟萃分析结果显示,大黄酸可降低高血糖、增加胰岛素敏感性、保护肾功能并显著改善DN[14]。徐博等[15]研究表明,SA 可减轻STZ 诱导的DN 大鼠肾组织细胞凋亡及炎症反应。本研究结果显示,SA 可减轻DN 大鼠肾小球、肾小管病理性损伤及胶原纤维沉积,降低FBG、Scr、BUN 及24 h Alb 含量,表明SA 经灌胃后,可能通过减轻足细胞损伤而发挥一系列肾脏保护作用。
足细胞损伤可作为DN 演变的临床预测指标,足细胞自噬能降解蛋白质和细胞器,调节细胞稳态,其功能障碍被认为是足细胞损伤的重要诱导因素,也是提示体外和体内足细胞凋亡/损伤的指标[16-17]。LC3 是自噬体指示蛋白,自噬体膜脂化形式(LC3Ⅱ)/胞质形式(LC3Ⅰ)比值用于监测自噬发生;Beclin1 参与调节自噬体形成与成熟[18],自噬可刺激LC3、Beclin 1 蛋白的表达[19]。本研究结果显示,与正常组比较,模型组大鼠肾组织中自噬体数量显著减少,而经SA 治疗后,自噬体数量显著增加,且LC3Ⅱ/LC3Ⅰ比值及Beclin1 蛋白相对表达水平显著升高,表明足细胞中自噬的抑制导致DN 肾功能障碍,SA 可能通过促进足细胞自噬体形成及成熟,改善其自噬功能,进而减轻DN 大鼠肾组织病理损伤。若足细胞损伤时呈进行性,足细胞将经历EMT 并逃避凋亡,从而导致成熟足细胞上皮样表型标志物(如Ecad)丢失,获得间充质细胞样表型标志物(如Vim)[20]。nephrin 是一种黏附蛋白,在肾小球的足细胞细胞间连接处表达,其表达水平是足细胞脱离、丢失的先兆[21]。LU Z[22]等研究表明,当足细胞免受损伤和EMT 时,nephrin、E-cad 表达上调,波形蛋白表达下调。本研究结果显示,模型组大鼠肾组织中Ecad、nephrin 蛋白相对表达量显著降低,Vim 蛋白相对表达水平显著升高,表明DN 大鼠足细胞可能因损伤刺激而发生EMT,导致足细胞缺失;而经SA 治疗后,nephrin、E-cad 表达上调,波形蛋白表达下调,表明SA 可能通过改善DN 大鼠肾组织病理损伤,促进足细胞自噬恢复,减少足细胞损伤,减缓EMT 防止足细胞丢失,进而减轻肾功能障碍。
Sirt-1 是维持细胞骨架完整性和足细胞存活所必需的蛋白质,WANG W 等[23]研究认为,Sirt-1 涉及DN 发病机制中代谢紊乱、氧化应激、炎症、自噬损害、缺氧、异常血管生成、细胞凋亡和肾素-血管紧张素系统激活等多种信号通路;研究发现,一些合成药物和天然化合物作为Sirt-1 激活剂发挥药理活性时,均涉及通过Sirt-1 通路减轻肾脏组织病理损伤、降低STZ 诱导的DN 大鼠Alb 水平[24]、改善自噬障碍[25]及预防EMT 所致的肾组织纤维化[26]。本研究结果显示,模型组大鼠肾组织中Sirt 蛋白的相对表达量显著降低,经SA 治疗后,其表达量显著升高,结合上述结果,提示SA 可能作为Sirt-1 激活剂参与并激活Sirt-1通路,发挥一系列肾脏保护作用。
综上所述,SA 可减轻肾功能障碍,其机制可能与激活Sirt-1 通路,进而改善DN 大鼠肾组织病理损伤、促进足细胞自噬恢复、减少足细胞损伤及减缓EMT 发生有关。

