川芎嗪基于KDM2B 调控卵巢癌细胞顺铂耐药的机制
蔡月红,麦 燕,钱沁佳
三亚中心医院妇产科,三亚 572000
卵巢癌可分为上皮、间质和生殖细胞肿瘤3 大类型。其中上皮型卵巢癌是最致命的卵巢癌,占所有病例报告的85%[1]。顺铂(cisplatin,DDP)是用于治疗上皮型卵巢癌的一线药物[2],但是,在晚期上皮型卵巢癌患者中常出现DDP 耐药性,并预示预后不良[3]。
赖氨酸特异性去甲基化酶2B(lysine-specific demethylase 2B,KDM2B)是含JmjC 结构域的组蛋白去甲基化酶家族的成员[4-5],KDM2B 通过H3K36me2和H3K4me3 调控基因转录[6]。KDM2B 的异常表达会抑制抑癌基因并促进癌基因表达,从而导致细胞生长失控、肿瘤发生[7-8]。
川芎嗪可通过诱导细胞凋亡在体内和体外抑制肿瘤转移和血管生成[9]。本研究检测了KDM2B 在DDP 耐药卵巢癌细胞中的表达水平,并研究了川芎嗪在DDP 耐药细胞中的潜在作用机制。
1 仪器与材料
1.1 仪器
BIONEER Exicycler 96 荧光定量PCR 仪(韩国Bioneer 公司);SynergyTM4 酶标仪(美国BioTek 公司);Epics XL 流式细胞仪(美国Beckman Coulter 公司);FACSort 流式细胞仪系统(美国FACSCanto Ⅱ公司)。
1.2 试药
川芎嗪(质量分数≥98%,南京景竹生物科技有限公司);DMEM-F12 培养基、胎牛血清均购自美国Sigma-Aldrich 公司;顺铂(DDP,大连美伦生物科技有限公司);siRNA 序列(上海生工生物工程股份有限公司);Lipofectamine 2000 试剂盒(美国英杰生命技术有限公司);Invitrogen TRIzol(美国Thermo Fisher Scientific 公司);Super M-MLV 反转录酶(北京百泰克生物技术有限公司);Annexin V-FITC/PI 双染色法试剂盒(北京索莱宝科技有限公司);RIPA 裂解缓冲液、二喹啉甲酸(bicinchoninic acid,BCA)法蛋白质测定试剂盒均购自上海碧云天生物技术有限公司;BCL2-相关X 蛋白(BCL2-associated X protein,Bax)、半胱氨酸蛋白酶-3(caspase-3)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)均购自美国Abcam 公司。
1.3 细胞
卵巢癌细胞系A2780(武汉普诺赛生命科技有限公司):B 淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2美国Abcam 公司)。
2 方法
2.1 预处理方法
在含有体积分数10%胎牛血清的DMEM-F12培养基中培养A2780,并在37 ℃、体积分数为5%的二氧化碳环境下维持。A2780 的耐药株通过终浓度为8 nmol·L-1的DDP 处理12 周构建。
将耐药细胞接种到4 个6 孔板中,分为对照组、阴性对照组、干扰组和川芎嗪组。 根据Lipofectamine 2000 试剂转染说明,干扰组和阴性对照组分别用si-KDM2B 和si-NC(一种非靶向siRNA)进行转染。 转染序列如下:si-KDM2B 序列为5'-CCCTGTGGAAATATCTGTCAT-3'。 川芎嗪组给予终浓度为5 nmol·L-1川芎嗪培养(培养基溶解)细胞[10]。对照组给予相同体积的培养基培养。每组细胞培养48 h 后,收集耐药细胞,进行下一步分析。
2.2 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,qRTPCR)
用Invitrogen TRIzol 从细胞中提取总RNA,用Super M-MLV 逆转录酶试剂盒合成cDNA。qRTPCR 反应在20 μL 的混合体系中进行,该体系包含cDNA 1 μL、 10 nmol·L-1前/后引物0.5 μL、 SYBR Green 0.3 μL 和 2×Power Taq PCR 10 μL,用Exicycler 96 Real-Time 荧光定量PCR 仪进行PCR 扩增。通过2-ΔΔCT法收集和分析数据。用于PCR 的引物序列如下:KDM2B 前引物5'-CTCACTGCTGTT GGCACCAC-3',后引物5'-TGCTTGCAGTACCTCAGGTCAATA-3';GAPDH 前引物5'-GCAACTAGGATGGTGTGGCT-3',后引物5'-TCCCATTCCCCAGCTCTCATA-3'。
2.3 噻唑蓝(methyl thiazolyl tetrazolium,MTT)法
将细胞(每孔5×103个细胞)接种在96 孔板法中。每组加入不同浓度(0、5、10、20、40、80 nmol·L-1)的DDP。37 ℃孵育48 h。用含有MTT(0.5 g·L-1)的新培养基替换,将培养皿在37 ℃、体积分数为5% 的CO2下孵育4.5 h,小心取出培养液,每孔加入150 μL 二甲基亚砜(DMSO),使生成的甲臜结晶完全溶解。用酶标仪在570 nm 波长处测定吸光度(A)值。
2.4 细胞凋亡率的检测
用Annexin V/FITC 和PI 细胞凋亡检测试剂盒检测细胞凋亡率。根据试剂盒说明书将收集的细胞轻轻重悬在500 μL 结合缓冲液中,将细胞与Annexin V-FITC 5 μL 和PI 5 μL 一起避光孵育10 min。通过流式细胞仪分析细胞。
2.5 蛋白印迹法(Western blotting)
用RIPA 裂解缓冲液裂解细胞获得总蛋白。用BCA 蛋白质测定试剂盒测定蛋白质量浓度。蛋白质样品(30 μg)进行SDS-PAGE,转移到PVDF 膜,并用50 g·L-1的脱脂牛奶封闭。孵育BCl-2、Bax、caspase-3 和GAPDH 抗体并在4 ℃下过夜,在37 ℃孵育辣根过氧化物酶偶联的山羊抗兔或抗鼠二抗45 min。 用电化学发光(electrochemiluminescence,ECL)法显影,用Image J 软件分析条带灰度值,以目的蛋白与内参GAPDH 灰度比值表示目的蛋白的相对表达水平。
2.6 统计学方法
实验至少进行3 次独立实验。用SPSS 24.0 统计软件对实验数据进行统计学分析,计量资料以(±s)表示,两组间比较用t检验,多组间比较用单因素方差分析,进一步两两间比较用LSD-t检验,P<0.05 为差异有统计学意义。
3 结果
3.1 KDM2B 在A2780/DDP 的表达水平
用DDP(8 nmol·L-1)处理A2780 细胞12 周构建A2780/DDP。用MTT 法测定A2780 和A2780/DDP 的A值,见表1。结果显示,A2780/DDP 表现出显著增强DDP 的耐药性(P<0.05)。A2780 的IC50值从(6.55±0.92)nmol · L-1显著增加到(58.35±6.77)nmol·L-1(P<0.05)。此外,通过qRT-PCR 检测 KDM2B 在 A2780 和 A2780/DDP 中的表达水平,A2780/DDP 中表达水平为(2.24±0.07),显著高于A2780 中的(1.00±0.06)(P<0.05)。结果表明,KDM2B 的表达水平可能与卵巢癌细胞DDP 耐药的发展有关。
表1 A2780 与A2780/DDP A 值的比较 (±s, n=3)Tab.1 Comparison of the A values between A2780 and A2780/DDP (±s,n=3)

表1 A2780 与A2780/DDP A 值的比较 (±s, n=3)Tab.1 Comparison of the A values between A2780 and A2780/DDP (±s,n=3)
注:与浓度0 比较,*P<0.05。
浓度/(nmol·L-1)0 5 10 20 40 80 F P A2780/(nmol·L-1)1.05±0.07 0.63±0.07 0.43±0.08 0.38±0.06 0.31±0.05 0.26±0.02 A2780/DDP/(nmol·L-1)0.95±0.10*0.85±0.05*0.65±0.03*0.64±0.02*0.57±0.03*0.52±0.04*263.215<0.001
3.2 KDM2B 抑制耐药细胞增殖的结果
用5 nmol·L-1的川芎嗪(培养基作为溶媒)处理A2780/DDP 48 h,另外用si-KDM2B 或阴性对照(si-NC)转染A2780/DDP 细胞,在48 h 后收取细胞。用qRT-PCR 检测每组KDM2B 的表达水平。与对照组和阴性对照组比较,川芎嗪组和干扰组中A2780/DDP 细胞KDM2B 的相对表达水平显著降低(P<0.05)。用MTT 实验检测每组细胞的增殖差异,川芎嗪组和干扰组都显著抑制了A2780/DDP 的细胞增殖(P<0.05)。见表2。
表2 各组细胞KDM2B 表达水平和A 值的比较 (±s, n=3)Tab.2 Comparison of KDM2B expression and A value among groups (±s,n=3)

表2 各组细胞KDM2B 表达水平和A 值的比较 (±s, n=3)Tab.2 Comparison of KDM2B expression and A value among groups (±s,n=3)
注:与对照组比较,#P<0.05;与阴性对照组比较,*P<0.05。
项目对照组阴性对照组干扰组川芎嗪组F P KDM2B 蛋白表达水平1.00±0.12 0.94±0.07 0.51±0.06*0.68±0.01#27.283<0.001 A 值1.10±0.06 0.93±0.07 0.78±0.08*0.68±0.06#21.768<0.001
3.3 KDM2B 调控细胞凋亡的结果
流式细胞术结果分析表明,分别与对照组和阴性对照组比较,用川芎嗪处理或敲减KDM2B 后,A2780/DDP 中细胞凋亡率显著上升(P<0.05),见图1、表3。

图1 各组细胞凋亡差异的比较Fig.1 Comparison of differences in apoptosis among groups
表3 各组细胞凋亡差异的比较 (±s,n=3)Tab.3 Comparison of differences in apoptosis among groups(±s,n=3)

表3 各组细胞凋亡差异的比较 (±s,n=3)Tab.3 Comparison of differences in apoptosis among groups(±s,n=3)
注:与比照组比较,#P<0.005;与阴性对照组比较,*P<0.005。
项目对照组阴性对照组干扰组川芎嗪组FP细胞凋亡率38.15%±4.12%41.62%±3.15%75.63%±5.12%*72.31%±4.13%#66.886<0.001
3.4 KDM2B 调控凋亡相关蛋白的表达水平
Western blotingt 分析结果显示,分别与对照组和阴性对照组比较,用川芎嗪处理或者敲减KDM2B后,A2780/DDP 中BCl2 的蛋白水平显著降低(P<0.05),而Bax、caspase-3 的蛋白表达水平显著升高(P<0.05),见图2、表4。

图2 各组凋亡相关蛋白表达水平的比较Fig.2 Comparison of the expression levels of apoptosis-related proteins in each group
表4 各组细胞中BCl2、Bax 和caspase-3 蛋白水平的比较(±s, n=3)Tab.4 Comparison of BCl2, Bax and caspase-3 protein levels among groups (±s,n=3)
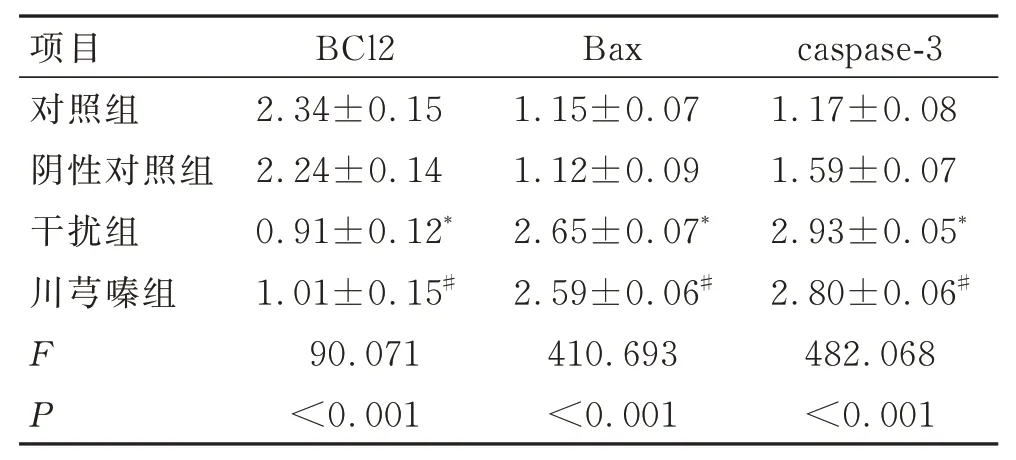
表4 各组细胞中BCl2、Bax 和caspase-3 蛋白水平的比较(±s, n=3)Tab.4 Comparison of BCl2, Bax and caspase-3 protein levels among groups (±s,n=3)
注:与对照组比较,#P<0.05;与阴性对照组比较,*P<0.05。
项目对照组阴性对照组干扰组川芎嗪组FP BCl2 2.34±0.15 2.24±0.14 0.91±0.12*1.01±0.15#90.071<0.001 Bax 1.15±0.07 1.12±0.09 2.65±0.07*2.59±0.06#410.693<0.001 caspase-3 1.17±0.08 1.59±0.07 2.93±0.05*2.80±0.06#482.068<0.001
4 讨论
近期有研究表明KDM2B 以JmjC 依赖性方式调控基因表达,可能参与肿瘤发生,在小鼠胚胎成纤维细胞中过表达可促进细胞增殖并抑制细胞凋亡,从而导致正常细胞的永生化[11-12]。KDM2B 可在癌症干细胞中过表达并表现出致癌作用[13-14]。在KUANG Y 等[15]的研究中,KDM2B 在正常卵巢组织、良性肿瘤、交界性肿瘤和卵巢癌中的表达水平逐渐升高,并与组织学类型、肿瘤分级、FIGO 分期和淋巴结转移密切相关。用慢病毒载体沉默KDM2B 基因在体外和体内抑制卵巢癌细胞的增殖和迁移。因此,将KDM2B 作为卵巢癌细胞的分子靶点进行研究。在本研究中,选择A2780 人卵巢癌细胞,通过DDP 诱导其成为A2780/DDP 耐药细胞株,并发现KDM2B 高表达,通过RNAi 技术干扰KDM2B 在A2780/DDP 中的表达水平,随后检测了其细胞生物学功能,发现KDM2B 被敲减后,可以明显抑制细胞增殖、促进细胞凋亡。
川芎嗪是中药川芎的主要生物活性成分,已广泛应用于心脑血管疾病的治疗[16-17]。研究还表明川芎嗪对黑色素瘤有抗癌活性,可抑制肿瘤血管生成和转移[18]。在川芎嗪处理的细胞中观察到肿瘤细胞凋亡增加,尤其是多药耐药恶性细胞[19-21]。川芎嗪可增加细胞内活性氧的积累,增加肿瘤细胞的凋亡率[22]。本研究表明川芎嗪可下调A2780/DDP 中KDM2B 的表达水平,从而表现出抑制细胞增殖、促进细胞凋亡的生物学作用。
综上所述,本研究初步发现中药单体川芎嗪可促进人卵巢癌耐药细胞株A2780/DDP 细胞增殖和细胞凋亡,其可能通过抑制KDM2B 的表达,从而下调凋亡抑制蛋白BCl-2、上调Bax 和caspase-3。

