黄斑、视盘旁与周边脉络膜新生血管
王文吉
(复旦大学附属眼耳鼻喉科医院眼科 上海 200031)
脉络膜新生血管(choroidal neovascularization,CNV)无论发生在黄斑、视盘旁或周边都将导致视功能减退,尤其是发生在黄斑的。脉络膜发生新生血管的病因很多,其中以老年性黄斑变性最为常见,预后也最差,其他如病理性近视、血管样条纹、外伤、视网膜葡萄膜炎症及肿瘤等也可导致。本文以文献为基础并结合本人从医经验,对黄斑、视盘旁及周边CNV 有重点地做一简要介绍,以期引起眼底病医师的兴趣,提升我们日常诊治工作的质量。
1 黄斑CNV
1.1 病因
黄斑CNV 最常见的病因为老年黄斑变性,在亚洲则以息肉样脉络膜病变(polypoidal choroidal vasculopathy,PCV)的形式出现更为常见。干性老年性黄斑变性的发病原理:随着年龄增长,视网膜色素上皮层(retinal pigment epithelium,RPE)变性,Bruch 膜增厚,产生玻璃疣及色素上皮的增生与萎缩,从而出现干性老年性黄斑变性。干性病变发展到最后结果是地图样萎缩,严重损害中心视力。部分患者在此基础上,脉络膜毛细血管通过Bruch 膜裂痕进入色素上皮下,引起色素上皮的浆液性及血性脱离,CNV 血管进而长入视网膜下,产生视网膜的浆液或血性脱离。长期脱离引发色素上皮及胶质细胞增生,最终形成纤维胶质瘢痕,彻底破坏了视网膜感觉细胞,无可挽回地损伤了中心视力,这就是湿性老年黄斑变性(neovascular age-related macular degeneration,nAMD)。虽nAMD 的发病率远低于干性,但对老年人中心视力的影响更严重。
1.2 治疗
临床上关于湿性CNV 的治疗,经历了无法治疗、热激光、光动力疗法(photodynamic therapy, PDT),直到21 世纪初抗血管内皮生长因子(vascular endothelial growth factor,VEGF)玻璃体内注射的出现,才真正给患者带来福音。抗VEGF 治疗,不仅能抑制新生血管增长、血管渗漏,还能促使视网膜内水肿与出血吸收,从而提高视力。它克服了热激光或PDT 仅能抑制血管生长而无法提高视力的严重缺陷,成为目前对活动性nAMD 的一线治疗方法。不幸的是,在日常诊疗实践中,并不是所有病例都对抗VEGF 有效,Krebs等[1]报道14.37%的病例对药物缺乏反应。分析无反应的原因可能存在以下几种因素。①诊断错误,误将PCV 诊为nAMD。虽然两者眼底表现相似,都表现为黄斑区的出血、渗出,但仔细观察,还是能发现有些差异,如检查PCV 时,眼底可能见到橘红色的息肉样病变,有比较显著的RPE 脱离、渗出及出血等。更为重要的是,PCV 的治疗方法与nAMD 不尽相同,有其针对性治疗方案,这将在PCV 节中再叙述。②患者可能是对目前使用的抗VEGF 药物产生了耐受或抗体,尤其是较长时间使用一种抗VEGF 药物后[2-4]。对前一种情况,可加大剂量或缩短注射时间进行调整;对后者情况,考虑更换一种抗VEGF 药,如以前使用的是雷珠单抗(ranibizumab),可改为阿柏昔普(Aflibercept)。2019年,新上市的抗VEGF 药布西珠单抗(brolucizumab)[5]治疗nAMD 不仅有效,且可3 个月注射1 次,大大减轻了医、患双方的负担;当然它还存在些不足之处,如引起炎症反应及血管阻塞等。③对抗新生血管治疗无反应,可能不仅仅是新生血管因子,还有其他因素如炎症共同参与其间[6-7],这时加用抗炎药物如糖皮质激素(曲安奈德眼内注射或地塞米松眼内缓释装置Ozoudex)可能取得成效。
1.3 PCV 的诊断及治疗要点
1982 年, Yannuzzi 等首先报道了PCV[8],其特征表现为视网膜下息肉样血管病变伴浆液或血性RPE 脱离。PCV 与nAMD 具有同样的基因背景与高危因素,它更好发于亚洲人群。虽也表现为老年人的视网膜下新生血管伴黄斑区的出血与渗出,但其临床表现、影像检查、治疗方案及预后等与nAMD仍有差别。与nAMD 相比,PCV 的发病年龄稍轻,视网膜及RPE 下的出血与渗出更为显著,预后较好。
有关PCV 的诊断及治疗要点,本文着重叙述两点:一是影像学特别是光学相干层析成像(optical coherence tomography,OCT)上的改变,二是关于治疗方案的共识。历来都认为吲哚菁绿血管造影(indocyanine green angiography,ICGA)是诊断PCV的金标准,即ICGA 造影上见到分支血管网及其末端膨大的血管球也即息肉样病变。随着多模式影像的不断改进与广泛应用后积累的经验,仅借助OCT检查也能帮助我们怀疑PCV 的诊断,OCT 为我们提供了不少有价值的重要线索。如OCT 发现一个或多个高高凸起的拇指样色素上皮脱离,尤其是脱离的色素上皮下见到息肉样病变的高反射灶及其外围的低反射晕,或在色素上皮与Bruchs 膜间的高反射影,即双层征(double layer sign)或分支血管网(branching neovascular network, BNN)[9]。这些OCT 改变,高度提示了PCV 病变的可能性,完全可供筛查用。对PCV 的治疗,经过多个多中心临床试验[10-13],目前的共识是:单一抗VEGF 治疗,可使黄斑水肿减退,提高视力。Lee等[12]的研究显示:①单一阿柏昔普的疗效并不比联合PDT 者差;②单用PDT 治疗息肉样病变可消退,不过视力无提高,且经多次治疗后,易出现脉络膜、RPE 的萎缩;③抗VEGF 与PDT 联合治疗,不仅息肉样病变及黄斑水肿消退,视力提高还减少了注药次数,是目前的最佳选择。
2 视盘旁CNV
2.1 症状及病因
视盘旁CNV 本质与黄斑CNV 相同,不过是新生血管生长在视盘旁而已。本病不常见,患病率约为0.29%,占眼内新生血管的10%。病变发生在老年患者中的,仍属老年黄斑变性范畴,约占45%,其次为特发性(即找不到病因)的,约占39%。年轻患者的病因则多种多样,包括视盘玻璃膜疣、视盘先天发育不良以及视盘旁的脉络膜视网膜炎症及肿瘤等[14-15]。
视盘旁CNV 定义为视盘旁一个视盘范围内的CNV 病变,可发生在视盘周围的任一象限,从1~12点时钟范围内均可出现,以鼻侧好发,占41.7%[16],不过鼻侧病变由于缺乏症状常被忽视。病变位于颞侧者,早期就因累及乳头黄斑束纤维而出现视觉症状,促使患者及时就医。
视盘旁CNV 的症状:位于鼻侧的,一般无症状;位于颞侧的,因影响乳斑束而出现视力下降或视野缺损症状。此外,当CNV 从视盘旁直接伸展到黄斑部视网膜下,或者视盘旁CNV 导致的视网膜内、视网膜下水肿或出血达到黄斑时,可有飞蚊症、视物模糊、视物变形甚或中心暗点等症状。眼底检查见视盘旁有视网膜深层出血,仔细辨认,还可能在出血区发现视盘旁黄白或灰色、略微隆起的CNV 病灶,视盘周围可有视网膜水肿或棉毛斑。这些表现与黄斑区nAMD 的CNV 相同[15-16]。当CNV 继发于其他眼底病时,视网膜、视盘或盘周还可见到相关的病变,如视盘玻璃膜疣[17]、视盘发育异常、高度近视、血管样条纹、葡萄膜视网膜炎症(如中间葡萄炎[18]、肉样瘤)、接近视盘处的脉络膜视网膜肿瘤如脉络膜黑色素瘤等,另外还有特发性高颅压[19-21]。搜查这些病变甚为重要,它们是导致发生CNV 的原发病变,具有治疗学上的意义。
为何会出现视盘旁CNV,经研究存在两条通道:一是脉络膜毛细血管通过视盘旁Bruchs 膜的破裂口达到视网膜下,如发生在病理近视、血管样条纹等疾病中;二是经过视盘与Bruchs 膜连接处的缝隙,这见于高颅压[19-21]或葡萄膜炎等疾病中。高颅压视乳头水肿将视盘旁组织向外推挤而导致发生视盘与Bruchs 连接处的缝隙。
2.2 分型及诊断
视盘旁CNV 也分3 型:①Ⅰ型即隐匿型,CNV位于色素上皮下,多见于老年黄斑变性及特发性者;②Ⅱ型即典型型,位于视网膜下,好发于葡萄膜炎患者;③兼有两型的联合型。对Ⅱ型即位于视网膜下者,曾有采用视网膜下手术将其摘除治疗的。
关于视盘旁CNV 的诊断,除前面描述的视盘旁深层出血与灰色稍隆起的斑块,以及盘周的渗出与水肿提示有视盘旁新生血管的可能时,进一步可通过荧光素眼底血管造影(fundus fluorescein angiography,FFA)、ICGA、OCT 及OCT 血 管 造 影(OCTA)来确认。FFA 与ICGA 早期显示视盘旁新生血管的强荧光与后期渗漏(图1A)。OCT 可见视盘旁视网膜增厚,视网膜水肿或视网膜下积液或出血,以及色素上皮上或下的高反射新生血管膜团块。当CNV 延伸到黄斑时,则见黄斑视网膜水肿,视网膜下积液或出血及黄斑下新生血管膜高反射团块。或者仅仅是视盘旁CNV 引发的出血水肿延伸到黄斑,造成黄斑视网膜的水D肿 与渗出,并E无黄斑区的CNV。无论黄斑水肿是视盘旁CNV 的出血水肿延伸而来或是视盘旁CNV 的直接侵犯,都将引起视力下降,需要治疗。近年上市的OCTA 检查更能直接显示出新生血管。与FFA 相比,OCTA 更具无创、快速、可重复等优点。并且当FFA 因出血遮挡不能清晰显示新生血管时,OCTA 则不受出血的影响。多模式影像检查不仅能帮助确诊,选择治疗方法,并能观察治疗反应及判断预后。治疗后,FFA 渗漏消失、OCT 显示视网膜水肿与积液减少都说明治疗有效;黄斑区视网膜外层结构的破坏则预示视力预后不佳。
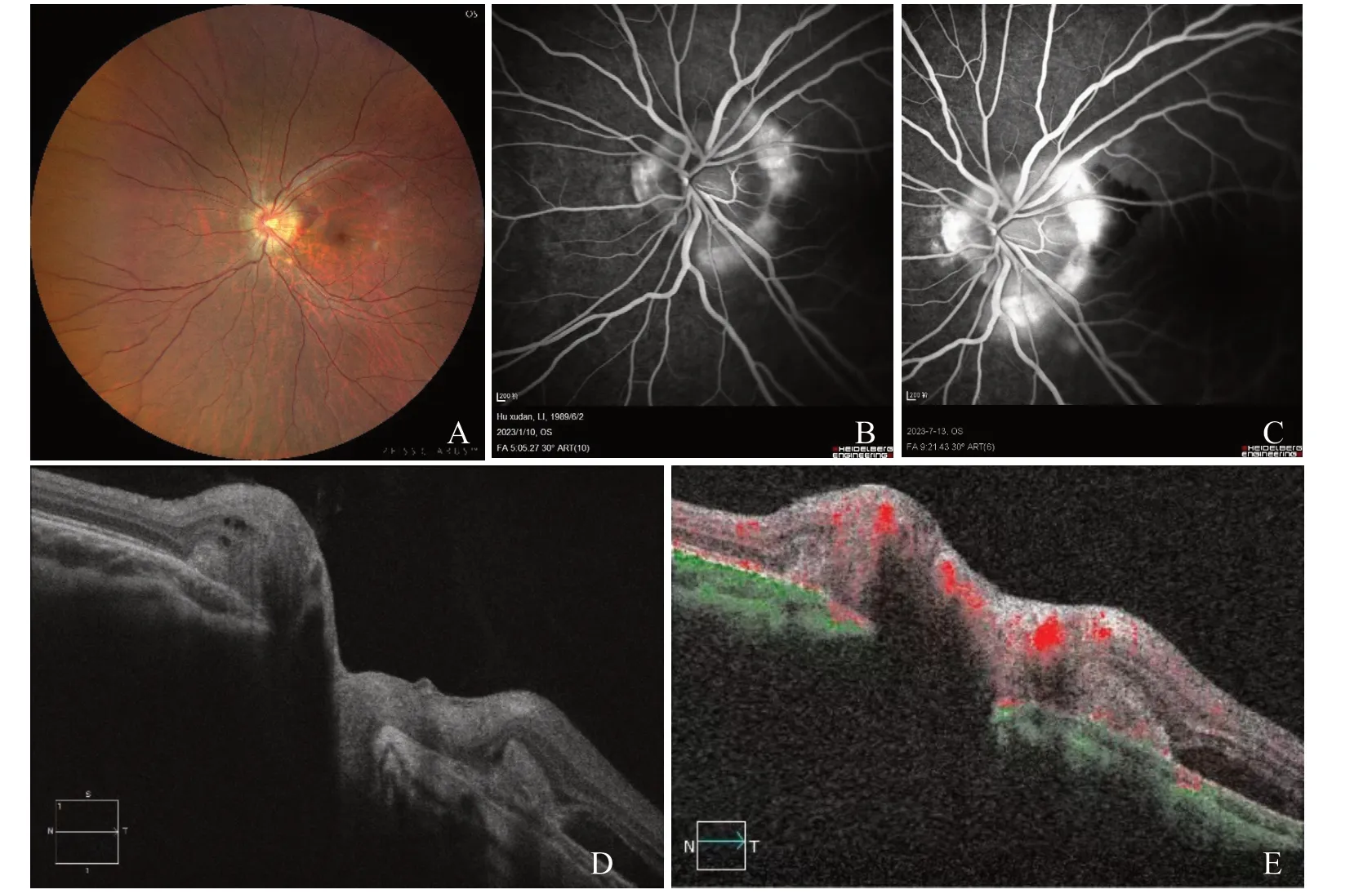
图1 视盘旁CNV 的相关检查 A.眼底彩照;B.FFA 早期;C.FFA 晚期显示渗漏;D.OCT 显示视网膜下水肿和出血;E.OCTA显示视网膜下新生血管。
2.3 治疗
对视盘旁CNV 治疗:无症状者只需定期观察;黄斑发生出血、水肿或病变直接延伸到黄斑时,应立即治疗。过去最常用的方法是热激光,以后又有PDT,也有通过手术摘除的[22],手术只限于Ⅱ型(视网膜下CNV)。抗VEGF 药物出现后,已成为本病首选,也是目前最常用的一线治疗[23]。
预后一般较好,但可复发,复发常在原CNV 的边缘或是原先正常的视网膜上,因此宜长期随访。随访时不仅要检查治疗过或未予治疗的患眼,了解其不可预测的发展方式及有无复发,还要观察另眼,因双眼发病率甚高[16]。
3 周边CNV
周边CNV,可能与周边渗出性出血性脉络膜视网膜病变 (peripheral exudative hemorrhagic choroiretinopathy,PEHCR )有一定联系。病变表现为周边视网膜或色素上皮下有一个或多个出血与渗出病变[24],病变中可能存在CNV 或PCV[25],故而以往有用周边AMD,黄斑外AMD,或周边PCV 来称呼本病的。本病病变位于周边,赤道与锯齿缘间的颞侧周边视网膜多见。欧美报道好发于老年人(70~80 岁),亚洲发病年龄也在70 岁左右,但更罕见[26]。女性好发,双眼受累占18%~37%。常伴高血压、动脉粥样硬化。不少患者伴有黄斑区的老年黄斑变性改变,如drusen、色素改变或盘状瘢痕等。
3.1 症状及病变转归
症状:早期常无症状,但如颞侧周边视网膜或色素上皮下的出血、渗出扩展到黄斑,可有视力下降、视物变形或暗点,当视网膜下出血进入玻璃体时视力下降明显。
眼底表现:颞侧周边视网膜可见一个或多个大小约10 mm×2.5 mm 的视网膜或RPE 下的出血病变,伴有渗出及脱离(图2)。病变呈拱形隆起、棕黑色,极似脉络膜黑色素瘤。Shields等[27]在173 例的报道中指出,PEHCR 是仅次于脉络膜痣,位列第二的假性脉络膜黑色素瘤病变。因此极需与黑瘤相鉴别。除周边病变外,黄斑区往往可见drusen、去色素或色素增生病变或盘状瘢痕。
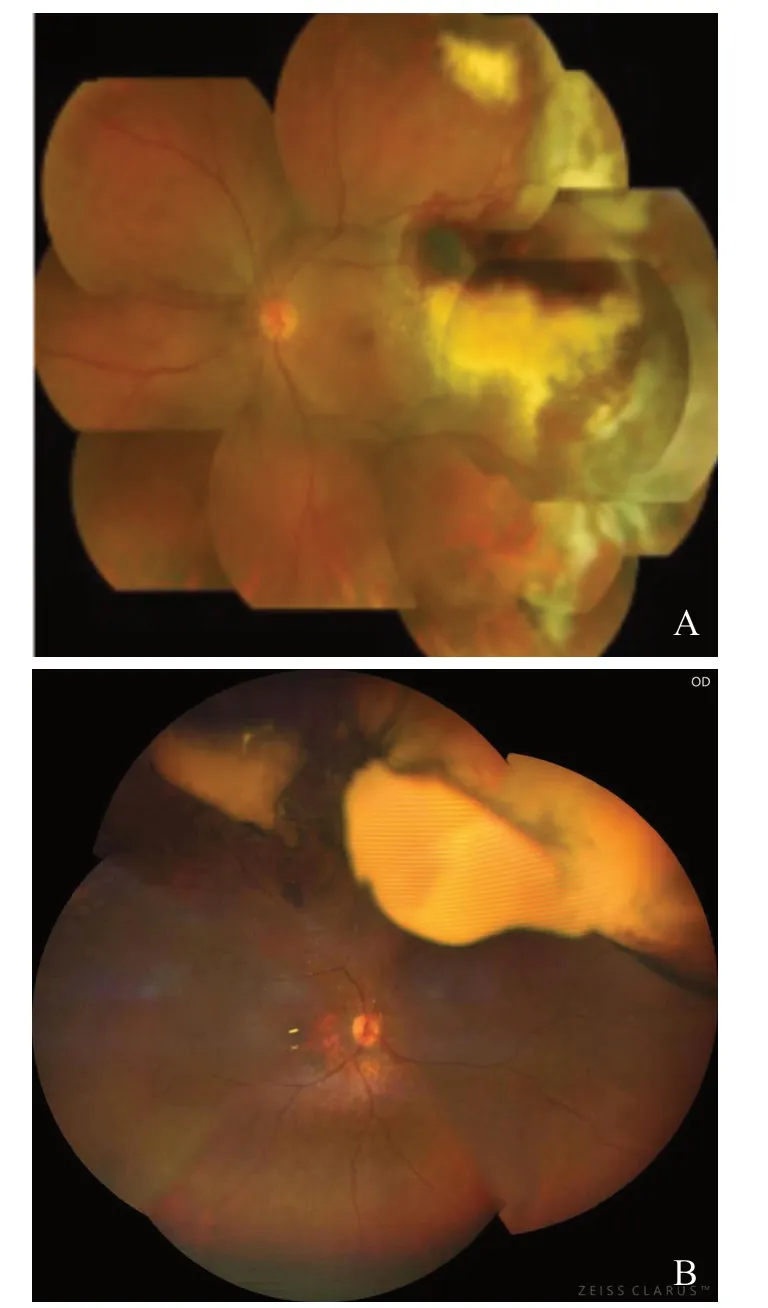
图2 PEHCR 眼底表现 A.瘢痕期;B.活动期。
影像学表现,将在鉴别诊断中提及。
病变转归:本病为自限性疾病,多数在数月或数年后出血、渗出逐步吸收,留下不规则的机化瘢痕及去色素或色素增生改变。
3.2 诊断与鉴别诊断
老年人颞侧周边视网膜及色素上皮下有一或几个出血隆起,伴视网膜脱离及渗出时,要考虑诊断本病。
此外,需要与如下疾病作鉴别诊断。①脉络膜黑色素瘤(以下简称黑瘤)。脉络膜黑瘤是脉络膜的肿瘤,而PEHCR 主要病变在视网膜,通过OCT 检查即可明确,不过病变位于很周边时,OCT 检查可能困难。此外,黑瘤发病年龄较轻,病变通常位于后极与赤道部间,呈单个眼底肿块。黑瘤常伴渗出性视网膜脱离,如肿瘤生长快速,少数情况下亦可突破视网膜,出血到玻璃体,但极少见到黑瘤周围出现视网膜或色素上皮下出血或渗出的情况。影像检查更有助确诊,由于视网膜下或RPE 下出血或RPE 增生,FFA 及ICGA 一般都被遮蔽见不到病变内血管,仅少数情况下病变内可能见到新生血管或息肉样病变。黑瘤则可见到视网膜及肿瘤的双重血管影。B 超检查显示,PEHCR 多数呈中、高反射,黑瘤则为中、低反射,并伴肿块内中空与脉络膜凹陷等特征。②视网膜血管瘤或Von-Hippel-Landau。视网膜血管瘤好发于20~30 岁的年轻人。肿瘤源于视网膜血管,鲜红色桑葚样肿物常凸向玻璃体腔,并有一对粗大、扭曲的滋养动脉与引流静脉与之相连,常伴渗出或牵拉性视网膜脱离,独特的眼底改变甚易与PEHCR 鉴别。③视网膜血管增生性肿瘤。虽也好发颞侧周边,也多见于女性,但发病年龄较轻(40~50 岁)。它也是视网膜内血管性肿瘤,由血管及胶质组织组成,色泽比血管瘤稍淡,凸向玻璃体内,可有不甚显著的滋养动脉与引流静脉,常伴渗出性视网膜脱离或玻璃体积血,后期可有视网膜前膜增殖。FFA 显示肿瘤早期强荧与晚期渗漏。A超为中到高反射,B 超示周边球壁隆起及视网膜脱离。
一经考虑PEHCR 诊断后,应了解黄斑区有无drusen,RPE 改变,AMD 及盘状瘢痕,同样对诊为nAMD 的患者也须扩瞳检查周边可能存在PEHCR,因两者可并存。
3.3 治疗
PEHCR 为自限疾病,可观察。出现黄斑部水肿、出血时,给予抗VEGF 治疗。经FFA、ICGA 发现病变中伴有CNV 或PCV[28]时也予抗VEGF 治疗。并发玻璃体积血且不见吸收时,可做玻璃体手术,玻璃体手术是最能提高本病视力的治疗方法。
最近研究发现,nAMD 病变中黄斑下方脉络膜变薄,而PEHCR 则是越向颞侧周边,脉络膜的厚度逐渐变厚,到达PEHCR 下方时,脉络膜最厚,这与正常眼中心凹下的脉络膜最厚也不一致[29],且有时ICGA 检查可显示病变内有息肉样病变。并且更有PEHCR 与PCV、中心性浆液性脉络膜视网膜病变(CSR)及厚脉络膜频谱病群并存的报道[29-30]。综合这些现象,推测PEHCR 也有可能属于厚脉络膜频谱病群中的一员,但这还有待更多科学研究来证实。
致谢:感谢复旦大学附属眼耳鼻喉科医院江睿医师和金华市中心医院李肖春医师提供的珍贵照片。

