植物磷营养与非生物胁迫的互作机理及其在农业上的潜在应用
昂叶菲,郭 悦,陈慧颖,2,刘若仪,朱秋晴,王 龙,朱毅勇,易可可,曾后清*
(1 杭州师范大学生命与环境科学学院,浙江杭州 311121;2 杭州师范大学哈尔科夫学院,浙江杭州 311121;3 中国农业科学院农业资源与农业区划研究所 / 北方干旱半干旱耕地高效利用全国重点实验室,北京 100081;4 南京农业大学资源与环境科学学院,江苏南京 210095)
磷是植物必需的一种大量营养元素,在植物的整个生命过程中都发挥至关重要的作用,参与了能量代谢、信号转导、生物大分子合成、光合作用和呼吸作用等过程。植物主要以H2PO4-和HPO42-的形式从土壤中获取磷。然而,磷通常是土壤中一种限制性养分,这是由于磷酸盐容易与碱性土壤中的钙和镁或与酸性土壤中的铝和铁等阳离子反应,形成不溶性化合物,从而被固定在土壤中[1-2]。据估计,全球1/3 的耕作土壤中存在缺磷的问题[1-2]。土壤中能被植物根系吸收的磷酸盐被称为土壤有效磷,其含量容易受外界环境条件影响。土壤低磷是影响作物产量和品质的一个主要因素。针对土壤低磷的问题,传统生产上,一般靠增施磷肥来解决。虽然增施磷肥能够缓解土壤低磷,然而施入土壤的磷很容易被固定,导致利用率较低。大量施用磷肥不仅耗竭有限的磷矿资源,还会带来环境污染和生态平衡的破坏,并且增加作物对病原体入侵的易感性[3]。
随着气候变化的逐渐加剧,全球生态环境面临严峻挑战,干旱、盐碱、冷害、高温等自然灾害频繁发生,作物不可避免地同时面临非生物胁迫、生物胁迫、营养胁迫等多重胁迫的困扰,因此,迫切需要培育抗逆性强、养分利用效率高的作物品种。越来越多的研究表明,磷营养信号与生物和非生物胁迫反应之间存在紧密的互作。比如,干旱、高盐、低温等非生物胁迫会显著降低土壤中的有效磷含量,限制植物对磷素的吸收与利用[4-6]。在干旱、盐、高温、低温等胁迫条件下,增施磷肥可增加磷的吸收并增强植物对这些胁迫的抗性。有关磷营养在植物和微生物互作中的调控作用,前人[7-8]已经做了很好的总结,而磷营养与非生物胁迫之间的互作还缺乏系统性的总结。本文对植物磷营养与非生物胁迫之间的相互作用进行综述,主要包括干旱、盐、温度和重金属等非生物胁迫对磷营养平衡的影响及作用机制,以及磷营养对非生物胁迫反应的调控作用与机制,并对磷营养与非生物胁迫互作在农业生产中的潜在应用进行探讨和展望。
1 植物缺磷反应与磷营养平衡的调控
植物体内磷营养的稳态平衡对生长发育至关重要。植物磷稳态是通过协调多种生理过程来实现,主要包括根际磷的吸收、木质部磷的装载、器官间磷的分配和再利用等。这些过程涉及植物组织或器官间信号的传递与交流[9-10]。植物主要通过根系的磷酸盐转运蛋白(主要是PHT1 家族蛋白)从土壤中吸收磷酸盐,并通过PHO1 等蛋白将磷酸盐转运到地上部[11]。液泡是磷酸盐储存的主要场所,其膜上的转运蛋白VPT1/PHT5;1 和VPE1/2 等在维持液泡中磷的进出与平衡中发挥重要作用[12-13]。为了应对外界磷素供应不足的情况,植物在长期的进化过程中形成了一系列缺磷适应机制,主要包括增强磷酸盐的吸收和转运,将储存在液泡中的磷释放,改变生物膜的结构,将磷从衰老器官向幼嫩器官转移,改变根系构型,分泌有机酸和酸性磷酸酶以及与丛枝菌根真菌共生等[9]。比如,植物在低磷条件下会通过改变根系的构型,包括抑制主根生长、促进侧根生长、增强根毛发育和排根形成来适应低磷胁迫[14]。
目前,研究人员已经鉴定了一些调控植物磷素平衡和缺磷反应的重要的调控因子(图1)。比如,MYBCC 转录因子PHR1及其同源基因PHL1、PHL2,以及WRKY、bHLH、ARF等家族的转录因子在植物缺磷反应中发挥了重要的调控作用[15-17]。PHR 转录因子正向调控植物缺磷反应,它与缺磷响应基因启动子区域中的P1BS 基序结合,从而激活下游基因的表达。SPX 蛋白作为磷感受器,通过与拟南芥PHR1或水稻PHR2 相互作用,并抑制它们在正常条件下的转录活性,从而避免磷过量积累引起的毒害[18]。研究表明,SPX 蛋白并不直接感知磷酸盐,而是感知可溶性的肌醇多磷酸盐(InsPs)[19]。焦磷酸肌醇InsP8 作为细胞内的磷酸盐信号物质通过调节SPX1与PHR1 的相互作用而调控磷的平衡[20]。拟南芥在磷充足条件下积累InsP8 并促进InsP8-SPX 复合体与PHR 转录因子的CC 结构域结合,从而抑制PHR介导的缺磷响应基因的表达[21]。水稻InsP6-SPX1 复合体与PHR2 的MYB 和CC 结构域也存在相互作用,从而破坏PHR2 二聚体的形成,并抑制PHR2 介导的缺磷响应基因的表达[22]。此外,STOP1-ALMT1转录模块介导的苹果酸分泌和LPR1/2-PDR2 模块介导的铁氧化在低磷抑制主根生长的过程中发挥重要作用[23-24]。
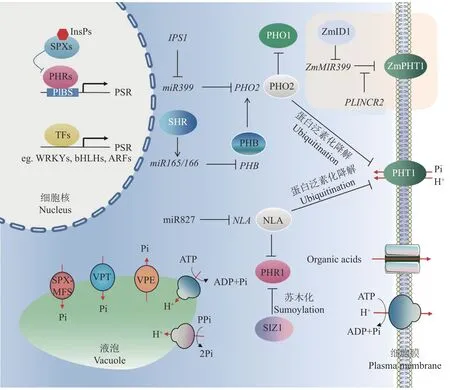
图1 植物磷营养平衡的分子调控模式图Fig.1 Schematic diagram of molecular regulation of plant phosphorus homeostasis
小分子RNA,如miR399、miR827 等,通过转录后调控的方式在磷素平衡和缺磷反应中发挥关键作用。miR399 在缺磷条件下诱导表达并受PHR1 正向调控,其通过抑制靶基因泛素E2 结合酶PHO2的表达,进而提高PHO2 下游PHO1、PHT1 等蛋白的含量,从而促进磷的吸收和转运[25]。PHO2-PHO1 模块还受到上游SHR-miR165/166-PHB 转录调控模块的调节。拟南芥长期缺磷会抑制根系中SHR 转录因子的积累,进而促进下游PHB 转录因子对PHO2的正向调控,从而抑制PHO1 介导的磷酸盐从根系向地上部转运[26]。miR399-PHO2 调控模块在其他植物中也发挥类似的作用。比如,玉米miR399 受低磷胁迫特异诱导,过表达miR399b使玉米在地上部过量积累磷酸盐,并出现磷中毒症状[27]。有趣的是,玉米miR399 还负向调控磷酸盐转运蛋白ZmPHT1;1、ZmPHT1;3和ZmPHT1;13等的表达,而且该调控受到长链非编码RNAPILNCR2的调节;PILNCR2受缺磷诱导并与ZmPHTs形成RNA/RNA 二聚体,从而干扰miR399 对ZmPHTs的靶向作用[28]。玉米MIR399基因还受到上游一个开花转变调控因子INDETERMINATE1(ID1)的负向调控;ZmID1 通过抑制MIR399的表达,缓解了miR399 对ZmPHO2的抑制作用,从而帮助维持磷的稳态[29]。miR827 也受缺磷诱导表达,其通过抑制泛素E3 连接酶NLA基因的表达而参与调控磷的吸收与缺磷反应,其靶基因NLA可以介导PHT1、PHR1 的泛素化降解[30-31]。此外,生长素、细胞分裂素、乙烯、赤霉素、独脚金内酯等激素和蔗糖等信号物质都参与调控植物磷营养平衡或缺磷反应[32-33]。蛋白的磷酸化和去磷酸化在磷转运蛋白的胞内运输和磷酸盐稳态调节中也发挥重要作用[34-35]。
2 非生物胁迫对植物磷营养平衡的影响
2.1 干旱胁迫对磷营养平衡的影响
土壤中磷素的有效性与干旱胁迫存在紧密联系。干旱胁迫通过降低土壤的含水量,使土壤中可溶性无机磷矿化并固定,从而阻遏了磷素在土壤中的移动[5]。在干旱胁迫下,土壤无机磷的浓度显著降低,而有机磷浓度显著增加[36]。研究表明,长期干旱引起土壤pH 下降,促进了磷酸钙中的磷酸盐的溶解,使磷酸钙中磷的占比下降,而使铝/铁氧化物结合的无机和有机磷的比例增加。长期干旱还使土壤中磷的生物有效性降低,并可能通过影响质子(H+)和有机酸等物质的分泌而影响土壤溶液中无机磷的补充[37]。干旱胁迫还可能通过减少根系PHT1 蛋白的含量或减弱其活性,降低磷的吸收效率,使组织中磷浓度降低[38]。此外,磷酸盐转运蛋白基因响应干旱胁迫。比如,杨树PtPHT1.2在干旱条件下表达量提高了约90 倍[39];油菜在干旱胁迫下,叶片中有18个PHT基因上调,而根系中有11 个PHT基因下调[40]。
2.2 盐胁迫对磷营养平衡的影响
盐浓度的增加会降低磷的有效性。一方面,盐渍土中pH 较高,土壤中75%以上的磷酸盐会与Ca2+、Mg2+等离子结合形成难溶解性化合物,导致磷的有效性降低[41]。另一方面,过高浓度的盐会降低植物对养分的吸收。在盐胁迫下,土壤中的盐离子会竞争性的抑制矿质营养的吸收,导致植物对养分离子的吸收不均衡[42]。盐胁迫降低植物对磷的吸收,也可能与盐胁迫对磷酸盐转运蛋白的影响有关[43]。研究表明,在油菜49 个PHT1基因家族成员中,叶片和根系分别有24 和19 个PHT1s受到盐胁迫影响[40]。
2.3 温度胁迫对磷营养平衡的影响
高温胁迫可以阻碍植物对养分和水分的吸收和利用[44]。有研究表明,温度升高影响植物对磷的吸收与转运。高温胁迫降低了番茄叶片中的氮、磷、钾和脯氨酸水平[45]。高温胁迫显著抑制了水稻叶片氮、磷、钾的转运效率[46]。然而,也有研究表明,温度升高在一定范围内能加快水稻光合作用中的光合磷酸化速率,并提高根系对磷酸盐的吸收速率[47]。
低温胁迫可分为冷害(0~15℃)和冻害(<0℃),是限制植物生长、地理分布、作物产量的主要因素[48]。低温带来的土壤冻融过程会引发磷素随土壤水分迁移,导致磷素流失,从而降低土壤有效磷含量[6]。低温还会降低土壤中微生物的分解代谢和磷酸酶活性,从而抑制植物对磷的吸收,导致植物出现生理性缺磷[49]。也有研究表明,低温抑制了玉米根系对磷的吸收[50]。
2.4 重金属胁迫对磷营养平衡的影响
重金属一般是指原子质量大于20 的金属和类金属。土壤中过量的重金属会影响植物的生长发育和新陈代谢。本文主要阐述砷(As)、镉(Cd)、铅(Pb)等重金属胁迫对磷营养平衡的影响。
As 主要以砷酸盐[As(Ⅴ)]和亚砷酸盐[As(Ⅲ)]两种无机形式存在,其中As(Ⅴ)是一种明确的致癌物,也是全球饮用水中广泛存在的化学污染物。As(Ⅴ)进入植物细胞后可以被还原成As(Ⅲ),这两种形式的As 都会破坏植物的新陈代谢。As(Ⅴ)与磷酸盐是类似物,因此As(Ⅴ)可以通过PHT1 从外界转运进入细胞,并在三磷酸腺苷(ATP)合成的磷酸化反应过程中取代磷酸盐,从而使植物代谢发生紊乱[51]。As(Ⅲ)是厌氧条件下的主要产物,是一种毒性更大的无机砷形式,其通过Nod-26-like 水通道蛋白进入植物体内。As(Ⅲ)与许多蛋白质的巯基基团具有相互作用,从而扰乱蛋白质的功能[52]。研究表明,As(Ⅴ)胁迫使拟南芥对磷素缺乏的敏感性增强[53]。
Cd 是我国农田土壤污染率最高的重金属[54]。较高浓度的Cd 会对植物产生毒性,使植物出现叶片卷曲与萎黄、根系生长缓慢和光合色素降低等表型[55]。研究表明,Cd 胁迫下滨海獐毛(Aeluropuslittoralis)的磷浓度增加[56]。另有研究表明,Cd 胁迫会诱导水稻中一些磷酸盐饥饿诱导基因(如OsIPS1、OsPT6和OsPT10)的表达,并且使水稻地上部的磷含量升高[57]。也有研究表明,Cd 对胡萝卜和生菜中的磷含量没有显著影响[58]。因此,Cd 对不同植物的磷营养具有不同的影响,但具体机制有待进一步研究。
Pb 是土壤中最常见的重金属污染物之一,土壤中的Pb 是可溶性的,因此可被植物吸收[59]。过量的Pb 通过改变细胞膜的渗透性,与抗氧化酶等代谢有关酶的活性基团发生反应,还会与ADP 或ATP 的磷酸基团反应,以及通过替换植物细胞内必需养分离子,从而使植物产生毒害[60]。有研究表明,卷心菜各部位Pb 浓度与Pb 供应量呈正相关,而磷浓度的测定结果与之相反[61]。在水稻中的研究发现,Pb 胁迫限制了磷在水稻地上部的积累[62]。也有研究表明,随着Pb 浓度的升高,小麦根系的磷含量呈先升高后降低的趋势,但地上部磷含量出现降低的趋势。同时,磷的转运系数与根系Pb 含量呈显著负相关,表明根系中Pb 含量的增加能够显著抑制磷向地上部的转运,可能是由于Pb 与磷酸盐形成了沉淀[63]。
磷营养平衡与非生物胁迫之间的相互作用图示见图2。植物磷营养相关基因在非生物胁迫反应中的作用见表1。

表1 植物磷营养相关基因在非生物胁迫反应中的作用Table 1 Roles of genes related to phosphorus nutrition in abiotic stress responses of plants

图2 磷营养平衡与非生物胁迫之间的相互作用图Fig.2 Schematic representation of the interaction between phosphorus homeostasis and abiotic stress responses
3 磷营养在植物非生物胁迫抗性中的作用
3.1 磷营养在干旱胁迫抗性中的作用
充足的磷营养可以促进植物对干旱胁迫的抗性。施用磷肥可以促进根系发育,从而提高根系获取水分和养分的能力[64]。施磷对根系生物量、净光合作用速率、叶绿素荧光、叶片相对含水量和叶绿体色素均有显著的正向作用,从而提高了桉树等植物对干旱胁迫的耐性[65-66]。此外,干旱胁迫下施用磷肥相比不施磷肥,超氧阴离子(O2-,一种活性氧)的产生降低了50%,植物细胞膜脂过氧化产物丙二醛(MDA)的含量也降低。可见,植物磷营养有助于减少干旱胁迫下活性氧引起的损伤[66]。
最近的研究表明,一些干旱响应基因,比如干旱诱导的DRIR(一种长链非编码RNA)、AT12CYS-2和PYL10也受低磷诱导,并且可能受到PHR1 和PHL1 的调控[67]。此外,编码定位于液泡膜上的无机焦磷酸酶(H+-PPase)的AVP1(Arabidopsisvacuolar proton-pump 1)基因,在植物抵御低磷胁迫、干旱胁迫、盐胁迫中均发挥着重要作用[68]。研究表明,过表达AVP1通过增加根系吸收面积和增强根际酸化来增加植物对磷的吸收,进而增强植株对低磷环境的抗性[69-71]。过表达AVP1番茄植株在低磷条件下磷从叶片到果实的转运增加,果实发育增强,产量显著增加[72]。此外,在拟南芥、烟草、棉花等植株中过表达AVP1均使其抗旱性增加[73-75]。
干旱引起的渗透胁迫是限制植物生长和农业生产的一个重要因素[100]。脱落酸(ABA)是一种关键的植物抗旱激素,ABA 积累和信号传导在植物干旱抗性中起着至关重要的作用[101]。研究表明,磷信号组分PHO1 参与ABA 介导的种子萌发和早期幼苗发育,并受ABA 信号通路中的关键调节因子ABI5 的转录调控[83]。脯氨酸是一种渗透保护剂,可以稳定细胞结构和酶活性,并帮助清除活性氧,以便在不利条件下维持氧化还原的平衡[102]。积累脯氨酸是植物抵抗干旱或盐引起的渗透胁迫的一种反应。脯氨酸合成酶P5CS1基因受干旱和ABA 诱导,从而调节逆境下脯氨酸的生物合成[103]。研究表明,脯氨酸积累与磷酸盐信号有关;PHR1 可以正向调控P5CS1基因的转录,从而使磷营养与胁迫反应之间建立联系[76]。然而,PHO1 和PHR1 等是否参与调控植物对干旱等胁迫的抗性还有待研究。
3.2 磷营养在盐胁迫抗性中的作用
增加磷的供应可以缓解盐胁迫对植物生长的抑制作用。例如,在盐胁迫下增加磷的供应,可以增加高梁对氮和磷的吸收以及脯氨酸的积累[104],可以促进番茄的根长和增加根表面积[105],也可以增加小麦的生物量和光合产量[106]。在盐胁迫下,增加磷肥供应可以促进植物对必需养分的吸收[107]。钙离子(Ca2+)是植物细胞中的第二信使,参与植物多种胁迫响应的信号转导过程。在不同的非生物胁迫下,Ca2+内流和外排机制的协同作用会导致细胞质游离钙离子浓度([Ca2+]cyt)产生波动,即Ca2+信号[108]。研究表明,植物磷营养可以改变[Ca2+]cyt对盐胁迫、渗透胁迫等非生物胁迫的反应[109]。植物在盐胁迫处理几秒钟内,胞质Ca2+水平会迅速升高,而磷饥饿会强烈抑制由NaCl 诱导产生的[Ca2+]cyt信号,并可能对Ca2+依赖性的SOS (salt overly sensitive)抗盐途径产生影响[109]。
拟南芥MYB2 是在盐、干旱等胁迫响应中发挥作用的一个转录因子[85]。miR399f 在维持磷酸稳态平衡中起着关键作用[86]。研究表明,MYB2 通过正向调控miR399f 的表达参与调节植物对缺磷的反应[86]。研究表明,PHO2的突变导致磷酸盐积累增加,使Na+的摄取和积累减少,从而增强植物对盐胁迫的抗性[84]。AVP1不仅参与植物磷营养调控,而且在盐胁迫抗性方面也发挥作用。在盐胁迫下,AVP1过表达增加了拟南芥、大麦、水稻等植物的地上部生物量[73,92-93]。AVP1过表达植株的耐盐性增强,主要是由于AVP1 产生的质子驱动力可以促进更多的Na+通过液泡膜Na+/H+反向转运蛋白进入到液泡中,从而减轻Na+对细胞质的毒害,同时还能降低细胞渗透势[73]。C2H2型锌指蛋白转录因子ZAT6 是主根生长的抑制因子,并通过调节根系构型来调节磷稳态[110]。研究表明,ZAT6过表达增强了种子萌发过程中对盐胁迫的耐性[90]。拟南芥PHT4;6 定位于高尔基体膜,pht4;6突变体与野生型相比更不耐盐,表现出主根生长减少、侧根增多和根尖膨大的表型;PHT4;6 可能通过将糖基化释放的磷酸盐从高尔基体腔中转运出来用于磷酸盐的再循环,从而影响植物抗盐[82]。这些研究都表明磷营养与盐胁迫反应之间具有关联。此外,在拟南芥中过表达大豆中的一个PHO1的同源基因GmPHO1;H8,使植物对盐胁迫的耐性增强[99],但其抗盐性是否与磷营养转运的增强有关尚不清楚。
此外,目前大多数研究主要关注单一的高盐或低磷因素对植物生长和养分吸收的影响,而对二者叠加的效应和作用机制还不清楚。研究表明,盐胁迫与低磷胁迫对植物生物量的影响并不是叠加的,植物对盐和缺磷双重胁迫的反应与单独盐胁迫下生长的植物相似[43,111]。有研究表明,磷的有效性对兼性盐生植物海滨獐毛的盐外排并没有显著影响,其盐外排可能不需要消耗ATP[43]。也有研究表明,盐生植物的盐外排是一个依赖ATP 酶和磷的过程[112]。
3.3 磷营养在高温胁迫抗性中的作用
磷营养可以缓解高温胁迫对植物的破坏,提高植物对高温胁迫的耐受性。在高温胁迫下,增施磷肥可以提高光合作用、水分利用效率以及水稻产量[113]。此外,土壤增施磷肥可以通过增加脂质和蛋白质合成,减少脂质氧化来提高玉米的耐热性[114]。
高温胁迫还会通过影响植物中缺磷响应基因的表达,使植物在高温胁迫下更好的维持磷素的稳态平衡[94]。大麦在高温胁迫处理1 h 后,PHT1;1、PHT1;4和PHT1;6等基因的表达水平降低,但并没有导致根系中的磷浓度水平降低。这可能是由于PHO1、PHO2和SPX-MSF基因的表达水平也降低,使磷从根系向地上部的转运减少,从而使根系中的磷酸盐浓度保持不变[94]。
3.4 磷营养在低温胁迫抗性中的作用
施加磷肥是植物抵御低温胁迫的一种常用方法[115]。通过增施磷肥可明显提高水稻等植物叶片质膜透性及抗氧化酶如超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等的活性,从而有利于提高水稻的抗寒性[116-117]。类似地,施磷能降低小麦MDA 的含量,从而减少MDA 积累对细胞膜的损伤,并且改善小麦叶片光合作用[118],增加小麦开花前干物质的运输和开花后营养器官中干物质的积累[119]。然而,磷肥的施加只能在一定范围内减缓低温对作物产量的不利影响,过量施加磷肥超出植物的承受能力会产生毒害作用[49]。
研究表明,耐冷的鹰嘴豆品种在低温胁迫下维持磷稳态的能力更强,从而可以更好的维持花和豆荚的生长[120]。在水稻中磷稳态的关键调控因子OsSPX1的沉默会导致植物对低温胁迫更加敏感[95]。在拟南芥和烟草中过表达OsSPX1均使植物耐寒性增强[89]。许多磷响应基因的启动子区域存在低温响应元件LTR,表明这些基因可能受到低温与磷信号的共同调控[121]。此外,过表达油菜PHR1后,可能通过调控冷胁迫相关基因如BnCOR15B,BnCOR78,BnCBF2等的表达,从而提高油菜对低温的耐受性[96]。
3.5 磷营养在重金属胁迫抗性中的作用
环境中磷的供应水平会影响植物对重金属胁迫的耐受能力[122]。磷富集有助于植物在重金属胁迫下的解毒[123]。值得注意的是,磷营养不仅能通过调节植物代谢等方式抵抗重金属胁迫,还能与重金属在土壤或植物体内发生相互作用从而降低重金属的有效性。
3.5.1 磷营养在As 胁迫抗性中的作用 研究表明,磷通常会减少植物对As [主要是As(Ⅴ)]的吸收,并通过与As 转运体竞争性结合,从而影响As 在植物体内的生物转化,如转化为毒性较强的有机砷[124]。很多研究表明,添加磷酸盐能够抑制植物对As(Ⅴ)和As(Ⅲ)的吸收[125]。在小麦中,As(Ⅴ)被砷酸盐还原酶ARQ1/HAC1 还原成As(Ⅲ),而As(Ⅲ)能与植物谷胱甘肽(GSH) 形成复合物进而隔离到液泡中,降低细胞质中游离态As 对细胞的损害[126]。研究表明,高磷酸盐处理可能通过调节植物中GSH 的生物合成来提高谷胱甘肽还原酶(GR)的活性,促进As(Ⅲ)与GSH 结合,从而降低植物对As 的吸收[127]。水培试验表明添加磷酸盐能减少植物对As 的吸收,从而减轻As 的毒性[128]。但土壤中磷与As 的浓度通常比水培试验低几个数量级[129]。因此,水培试验中磷酸盐与As 相互作用的结果并不能完全适用于土壤环境。土壤中磷对As 毒害抑制的作用机制还有待明确。
通过转录和翻译后水平调控PHT1 的表达与活性可以调节植物对As(Ⅴ)的吸收。WRKY6转录因子的表达受As(Ⅴ)的高度诱导,而WRKY6 可以负向调节PHO1的表达,从而抑制As 的吸收[77]。As(Ⅴ)和As(Ⅲ)均促进PHR1 的降解,从而通过抑制PHT1的表达,削弱As(Ⅴ)的吸收。As 促进PHR1 降解的过程需要受As(Ⅲ)诱导的SKP1-like 蛋白ASK18 和F-box 蛋白PHIF1 的参与,它们是SKP1-CULLIN-FBox (SCF)复合体的组成成分,可以介导PHR1 的降解[77-78]。此外,在As(Ⅴ)胁迫下,与As(Ⅴ)响应有关的WRKY6 迅速抑制As(Ⅴ)或磷酸盐转运蛋白PHT1;1的表达,并伴随PHT1;1在囊泡的内化,从而抑制植物对As(Ⅴ) 的吸收[77]。因此,当植物受到As(Ⅴ)胁迫时,将As 信号与磷酸盐信号整合,通过抑制磷营养信号途径,从而限制As(Ⅴ)的吸收并降低其毒性[130]。
3.5.2 磷营养在Pb 胁迫中的作用 磷酸盐能有效清除污染土壤中的Pb。磷会诱导活性Pb 转化为不太稳定的磷酸铅,并且在磷充足的情况下,磷酸铅的可溶性显著降低,进而降低土壤中Pb 的生物有效性,减少植物对Pb 的吸收[131]。研究表明,在土壤磷含量充足(即磷含量高于0.3%)的情况下,加Pb 土壤中作物产量未见下降,并且在Pb 胁迫下,水培溶液中加入磷酸盐可立即形成磷酸铅沉淀[132]。此外,增施磷肥可有效辅助植物抵抗Pb 胁迫。磷酸盐可通过吸附、沉淀和共沉淀等多种形式与Pb 结合,抑制作物对Pb 的吸收,尤其能够降低土壤Pb 活性[133]。施加磷酸盐能够增加Pb 在水稻营养器官的细胞壁中的比例,从而降低Pb 从营养器官向籽粒的运输[134]。有趣的是,小麦磷高效品种比磷低效品种对Pb 胁迫具有更强的耐性。相比磷低效品种,磷高效品种的根系对磷和Pb 的吸收量更少,但转运到地上部分的量更大[63]。
3.5.3 磷营养在Cd 胁迫中的作用 研究表明,施加磷酸盐能降低植物体内Cd 的迁移[135-136],并减轻Cd 对植物的毒害作用[137]。添加磷后,Cd 转运蛋白基因OsHMA2、OsIRT1和OsABCC1表达量显著下调[138]。因此,磷营养可以通过调节相关基因表达,减少Cd 积累,从而增强水稻对Cd 的抗性。通常情况下,小麦抗氧化酶活性在含Cd 土壤中被抑制,而如果添加了磷,小麦抗氧化酶如SOD、POD、CAT等以及非酶促抗氧化物质如α-生育酚、抗坏血酸(AsA)的活性均增强,从而保护细胞膜免受Cd 胁迫的伤害[139]。此外,植物对Cd 胁迫的抵抗机制与植物螯合肽的合成有关,这些化合物能够将植物叶片中的Cd 与谷胱甘肽复合物隔离,以降低细胞中Cd 的浓度;该过程受到植物螯合肽前体分子和谷胱甘肽的协同调节[123-140]。
然而,也有研究表明增磷处理提高了植物体内尤其是根部Cd 的积累[141]。在水稻水培试验中,缺磷处理显著降低了水稻幼苗Cd 的积累,但增加了Cd从根系向地上部的转移,从而加重了Cd 毒害症状;相反,磷加倍处理下,水稻幼苗中Cd 积累增加,但降低了Cd 从根系向地上部的转移,从而减轻了Cd的毒性[141]。因此,Cd 对植物的毒性与其在植物体内的积累并非完全正相关。缺磷可以通过竞争性地增加铁的吸收和积累来降低水稻对Cd 的吸收,缺磷还可以通过抑制生物量积累和减少植物螯合素合成来增强水稻对Cd 的敏感性[142]。类似地,在应对As 和Cd 双重胁迫下,增施磷肥虽然能有效增强植物对As 和Cd 的解毒能力,但也会增加水稻幼苗As 和Cd 积累的风险[143]。在分子机制方面,施磷通过提高Lsi6/OsNIP2;2、OsNRAMP1和OsNRAMP5基因的表达水平,提高植物对As 和Cd 的耐受能力[143]。虽然磷在Cd 毒害缓解中发挥着不容忽视的作用,但具体机制仍有待研究。
3.5.4 磷营养在其它重金属胁迫中的作用 铁元素是植物必需的微量元素,但如果过量,也会对植物产生毒害。磷和铁是两种相互拮抗的营养元素。在植物根际,磷酸盐可以和铁离子形成不溶性化合物。因此,施加磷酸盐能够缓解介质中过量铁对植物的伤害[144]。在分子机制上,磷与铁营养存在相互作用。研究表明PHR1 和PHL1 也可以调节铁的稳态平衡。PHR1 正向调控参与铁稳态的基因FER1(编码铁储存蛋白)的表达,而在拟南芥phr1phl1双突变体中,铁的分布和铁相关基因的表达发生改变[81]。
低浓度的铜有利于提高植物对铁、锌、钾的吸收,但高浓度的铜则抑制植物对氮、磷、钾等营养元素的吸收[145]。磷营养通过提高植物的抗氧化能力,可以有效地缓解铜毒害[146]。在铜胁迫下,增加磷的供应能显著增加ROS 相关酶如SOD,POD 和CAT 等的活性,降低植物中MDA 的含量,并且提高非酶促抗氧化物质如AsA 和GSH 的含量,从而降低铜毒对植物的伤害[146]。
铝(Al) 是地壳中含量最丰富的金属元素,而Al 毒是酸性土壤限制作物产量的一个主要因素。在酸性条件下,Al 会从土壤矿物中释放出来,从而抑制植物根系的生长,并干扰根系对磷等营养元素的吸收与利用[147]。研究表明,Al 毒和磷营养之间存在相互作用。例如,Al 胁迫处理可以使酸柚根、茎、叶中磷含量下降,而磷添加处理可以通过增加根中Al 的固定,并减轻Al 胁迫对光合电子传递链的阻碍作用,从而缓解Al 毒害[148]。油茶幼苗在Al 胁迫下添加磷处理可以使根系中Al 含量显著降低,并可能通过促进根系中蛋白质合成和碳水化合物的积累而缓解Al 毒害[149]。然而,也有研究表明缺磷处理通过降低水稻根系细胞壁中可结合Al 的磷脂和果胶含量,从而降低根系和叶片Al 含量,并增强植物对Al 毒的耐受性[150]。
4 展望
目前,植物磷营养与非生物胁迫相互作用的研究以土壤化学与植物生理学的内容为主,亟待从以下几方面加深研究:植物磷营养与非生物胁迫之间错综复杂的互作关系中涉及到哪些信号分子和通路;不同非生物胁迫与磷营养互作在植物体内存在的生物学意义是什么,如果从更广义的生态学和进化生物学角度来看,其又具有何意义;如何通过转基因、基因编辑等技术手段利用或调整非生物胁迫与磷营养之间的相互作用,从而同时提高作物对非生物胁迫的抗性和磷素利用效率;土壤微生物在磷营养与非生物胁迫互作中又具有什么样的作用。这些问题的回答将有助于我们了解磷营养信号与非生物胁迫反应之间互作的分子机制,并有助于它们在农业生产上的应用。
此外,改良某些基因可以同时提高作物对低磷和非生物胁迫的抗性。在农业生产上,应当深入挖掘和开发兼具磷高效吸收与利用以及环境胁迫抗性的基因资源,并通过现代分子设计育种的手段同时提高作物的养分利用效率和抗逆性。利用基因组学、转录组学、蛋白质组学等多种技术,有助于挖掘这类基因,采用基因编辑、启动子编辑与合成生物学等手段有助于开发和利用这类基因,从而实现作物养分利用率、抗逆性和产量同时提高的目标。

