CC类趋化因子22、叉头框蛋白P1在急性髓系白血病外周血中的表达及对预后的预测价值
胡婕,刘瑞菡,王高翔,熊婷,黄欣,程利民
作者单位:1孝感市中心医院,a血液内科,b检验科,湖北 孝感 432099;2华中科技大学同济医学院附属同济医院血液内科,湖北 武汉 430030;3咸宁市中心医院血液内科,湖北 咸宁 437199
急性髓系白血病(acute myeloid leukemia,AML)是一种常见的血液系统疾病,是白血病中发病率最高的类型[1],近年来,其发病率和病死率均呈不断上升趋势,严重影响到病人的生活质量和生命安全,导致病人5 年生存率降低[2]。该病可能由遗传因素、化学因素以及环境因素等共同作用导致[3],然而其具体发病机制仍未知。CC 类趋化因子22(C-C class chemokine 22,CCL22)作为一种趋化因子,可以趋化T淋巴细胞、单核细胞等,通过抑制机体对肿瘤细胞的免疫反应从而促进恶性肿瘤的发展[4]。Wu等[5]研究发现,CCL22水平对AML病人的总体生存时间产生较大的威胁,有望成为潜在的预后标志物。叉头框蛋白P1(Forkhead box P1,FOXP1)属于重要的叉头转录因子,与心肌细胞发育、免疫细胞分化以及运动神经元多样性等相关[6]。有研究报道,诊断时FOXP1基因表达升高的AML病人在强化诱导化疗和自体干细胞移植后的总生存期明显缩短,表明FOXP1 是AML 的不良预后标志物[7]。但有关CCL20、FOXP1 两者在AML 病人外周血中的表达情况及预后价值的临床研究少之又少。因此,本研究通过检测AML 病人外周血中CCL22、FOXP1 的表达,探讨两者在AML 中的作用及关系,初步讨论外周血中CCL22、FOXP1 表达与病人预后的关系,以期为改善AML病人预后提供新的思路。
1 资料与方法
1.1 一般资料选择2018 年5 月至2019 年5 月在孝感市中心医院及华中科技大学医学院附属同济医院,咸宁市中心医院确诊的68 例AML 病人设为观察组,纳入标准:病人经临床病理诊断确诊为AML[8];病人及其近亲属了解本研究并签署知情同意书;首次确诊并接受治疗;研究对象入院前未进行过手术、放疗、化疗等治疗;研究对象随访资料齐全。排除标准:研究对象精神状态异常,无法正常交流沟通者;合并其他部位肿瘤;有自身免疫性疾病、全身感染性疾病者;研究对象临床信息不完整。收集整理病人年龄、性别、脾肿大、染色体预后、血红蛋白(HGB)、血小板计数(PLT)、白细胞计数(WBC)及病人的基因突变情况,主要包括FMS 样酪氨酸激酶3-内部串联重复基因(FLT3-ITD)、核仁磷酸蛋白基因1(NPM1)等临床资料。观察组中男性35 例,女性33 例;年龄范围为20~76 岁,年龄(46.67±7.89)岁;FAB 分型:M1型11例、M2型40例、M3 型10 例、M4 型7 例;AML 危险分层:低危组12例,中危组34 例,高危组22 例。另选取同期健康体检者68 例为对照组,其中男性30 例,女性38 例;年龄范围为22~75岁,年龄(46.11±8.09)岁。两组性别(χ2=0.74,P=0.391)和年龄(t=0.41,P=0.683)比较均差异无统计学意义。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 治疗方案3 个中心的所有AML 病人入组后均接受以下标准治疗方案,主要包括DA 方案,柔红霉素+阿糖胞苷;IA 方案,去甲氧柔红霉素+阿糖胞苷;MA 方案,米托蒽醌+阿糖胞苷;HA 方案,高三尖杉酯碱+阿糖胞苷,需根据病人的病情及自身耐受情况选择合适的治疗方案。
1.3 仪器与试剂全自动多功能酶标仪购买于Thermo 公司(型号PerkinElme EnSpirer);人CCL22酶联免疫吸附测定法(ELISA)试剂盒(货号SP10226)购买于武汉赛培生物科技有限公司,人FOXP1 ELISA 试剂盒(货号JH-H10478)购买于上海继和生物科技有限公司。
1.4 方法
1.4.1ELISA 法检测 采集AML 病人初诊时外周血与健康体检者体检当日的空腹外周血5 mL,静置30 min 后,3 000 r/min,离心10 min,收取上清液,分装于无菌EP 管中,保存在-20 ℃冰箱定时统一检测。采用ELISA 法检测AML 病人与健康体检者外周血中CCL22,FOXP1 表达情况,具体操作步骤严格按照说明书进行,利用多功能酶标仪测定各样本在450 nm 处的吸光度值,依据标准回归曲线计算两组外周血CCL22,FOXP1水平。
1.4.2随访 所有病人出院后采用门诊、电话等形式定期随访,随访截至2022 年5 月,终点事件为病人死亡。统计病人总体生存时间(OS),OS 为手术开始至末次随访或死亡的时间,计算3年总生存率。
1.5 统计学方法数据以SPSS 25.0 软件进行统计学分析,经正态性检验,计量数据均符合正态分布,以±s描述,行t检验;计数资料以例(%)表示,行χ2检验;Pearson 法分析AML 病人外周血中CCL22 与FOXP1 表达的相关性;采用Kaplan-Meier 生存法分析AML 病人术后OS,比较采用log-rank 检验;采用Cox 回归分析AML 病人预后死亡的影响因素。P<0.05表示差异有统计学意义。
2 结果
2.1 两组外周血中CCL22,FOXP1 表达水平比较与对照组相比,观察组初诊时外周血中CCL22,FOXP1表达均明显升高(P<0.05),见表1。
表1 急性髓系白血病68例与对照组外周血中CC类趋化因子22(CCL22)、叉头框蛋白P1(FOXP1)的表达情况/(ng/L,± s)
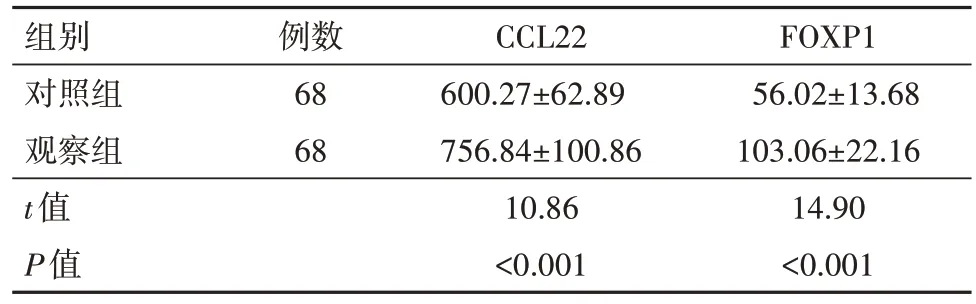
表1 急性髓系白血病68例与对照组外周血中CC类趋化因子22(CCL22)、叉头框蛋白P1(FOXP1)的表达情况/(ng/L,± s)
组别对照组观察组t值P值例数68 68 CCL22 600.27±62.89 756.84±100.86 10.86<0.001 FOXP1 56.02±13.68 103.06±22.16 14.90<0.001
2.2 CCL22,FOXP1 表达与AML 病人临床特征的关系为维持两组样本例数的一致性,本研究分别以CCL22,FOXP1 表达水平中位值753.39 ng/L,101.00 ng/L 为临界值,将病人分为CCL22 高、低表达、FOXP1 高、低表达组,各34 例。CCL22,FOXP1表达水平与病人年龄、性别、染色体预后、HGB、PLT、FLT3-ITD、NPM1 突变无关(P>0.05),与脾肿大、WBC有关(P<0.05),见表2。
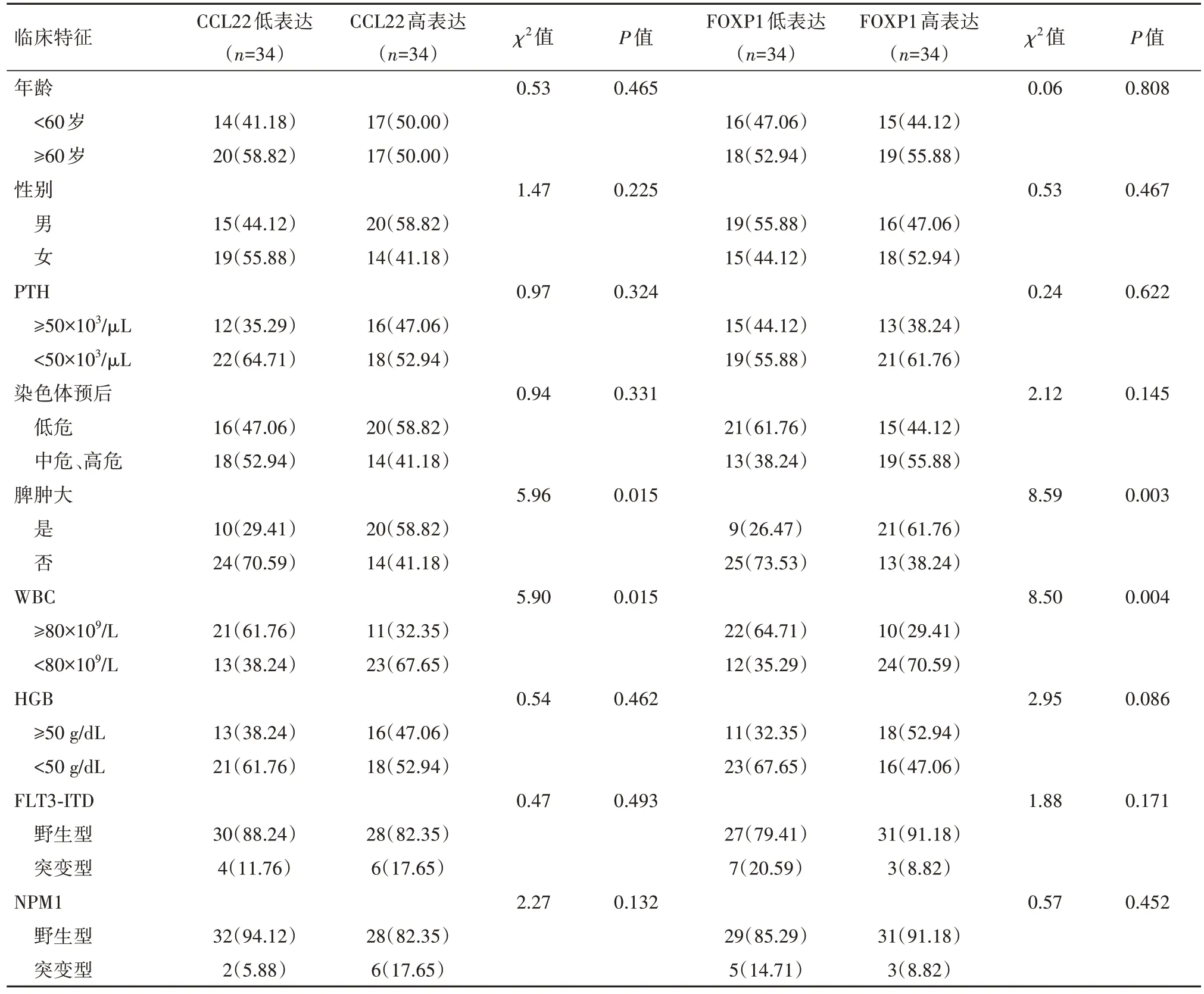
表2 AML外周血中CCL22、FOXP1表达与临床特征的关系/例(%)
2.3 AML 病人外周血CCL22,FOXP1 的相关性Pearson 法分析结果显示,AML 病人外周血中CCL22,FOXP1表达呈正相关(r=0.27,P<0.05)。
2.4 AML 病人外周血CCL22,FOXP1 表达与病人预后的关系Kaplan-Meier法分析结果显示AML 病人外周血CCL22高表达组和低表达组病人3年生存率分别为47.06%(16/34),70.59%(24/34),CCL22 高表达组OS 短于低表达组(χ2=4.39,P<0.05);FOXP1高表达组和低表达组病人3 年生存率分别为44.12%(15/34),73.53%(25/34),FOXP1 高表达组OS短于低表达组(χ2=6.50,P<0.05)。
2.5 AML 病人预后的影响因素分析以AML 病人预后情况为因变量(赋值1=死亡,0=存活),以病人外周血CCL22,FOXP1 水平为自变量进行多因素Cox 回归分析,显示外周血CCL22,FOXP1 是影响AML病人预后的独立危险因素(P<0.05),见表3。

表3 Cox回归分析急性髓系白血病预后的影响因素
3 讨论
AML 是一种髓系造血干细胞和祖细胞的恶性克隆性疾病,以骨髓和外周血中的原始细胞和幼稚细胞异常增生为主要特征[9]。AML的临床表现无特异性,大部分表现为贫血、出血、发热、畏冷、各脏器的浸润及全身器官代谢异常等等。尽管现在医疗技术已不断完善,AML 病人可以通过治疗减轻痛苦,但是该疾病易复发和转移,并且治疗效果存在明显的个体差异,导致病人的5 年生存率较低[10-11]。因此,寻找AML 有效的临床诊断指标,对提高病人生存状况有积极意义。趋化因子CCL20,转录因子FOXP1 是学者们研究的新热点基因,但是两者在AML 病人中的作用鲜有报道。本研究主要探讨AML 病人外周血CCL22,FOXP1 的表达水平及预后价值,以期为改善AML病人预后提供新的方向。
CCL22 基因定位于人染色体16q21,属于趋化因子家族,对单核细胞、树突细胞、自然杀伤细胞和活化的T 淋巴细胞具有明显趋化作用,并且趋化因子CCL22 在器官发育和白细胞迁移过程中起着至关重要的作用。研究报道,CCL2 作为CC 趋化因子家族的一员,与AML 进程密切相关[12]。靶向趋化因子可能影响AML 对化疗的敏感性,并有助于开发治疗AML 的新型方法。张彬彬等[13]研究发现,在宫颈癌组织中CCL22 高表达,并且CCL22 高表达者3 年总体生存率明显低于CCL22 低表达者,这提示CCL22高表达与宫颈癌病人预后不良有关。在低氧条件下巨噬细胞分泌CCL22 可促进乳腺癌的转移[14]。目前,CCL22 在AML 中的研究较少,CCL22基因在AML 中发挥何种功能呢?本研究结果发现,与健康体检者(对照组)相比,AML 病人初诊时外周血中CCL22 表达水平明显升高(P<0.05);CCL22 表达水平与病人年龄、性别、染色体预后、HGB、PLT、FLT3-ITD、NPM1 突变无关(P>0.05),与脾肿大、WBC 有关(P<0.05)。这提示,CCL22 的表达在AML中被增强,其在AML 的发生发展中可能起到一定的促进作用。王晓龙等[15]研究发现,CCL22 在胃癌病人外周血中表达增高,CCL22 对胃癌细胞具有趋化作用,CCL22 可能与胃癌的发生发展密切相关。并且有研究报道,CCL22 是一种重要的新型适应性免疫调节因子,靶向CCL22 与其受体的相互作用可能代表一种有效且潜在危害较小的免疫治疗策略,该策略对恶性肿瘤和炎症具有重要的影响[16]。由此可见,CCL22在癌症和炎症中的作用并不单一,值得进一步地探讨。
FOXP1 定位于染色体3p14.1,是叉头框(Forkhead box,FOX)转录家族的成员,在早期发育到成年的基因转录调控中发挥着重要作用。FOXP1 在人体组织中广泛表达,参与调节大脑、心脏、肺、免疫系统和脊髓运动神经元的发育。李永良[17]研究报道,与癌旁组织相比,结肠癌组织中FOXP1 基因表达水平上调,FOXP1 阳性表达病人存活率显著低于阴性表达病人。白娟等[18]研究报道,上皮性卵巢癌病人癌组织FOXP1 呈异常高表达,且与分化程度、临床分期、肿瘤转移密切相关。也有研究报道,FOXP1高表达与弥漫性大B细胞淋巴瘤的病理进展及预后恶化有关[19]。在复发难治型急性淋巴细胞白血病病人中Foxp3+Tregs水平明显升高[20],这提示该疾病可能与FOX 家族的调控作用有关。目前,FOXP1 在AML 中的研究报道较少,其在AML 中扮演何种角色还未可知。本研究结果显示,与健康体检者相比,AML病人初诊时外周血中FOXP1表达水平明显升高(P<0.05)。有研究发现,FOX 家族与白血病的发生发展密切相关[21]。FOXP1 在糖尿病视网膜病变病人玻璃体中普遍高表达,沉默FOXP1 可抑制高糖刺激下的VEGF/PEDF信号通路,也降低了内皮细胞的增殖、迁移和成管能力[22]。这进一步证明FOXP1 作为癌基因在癌症和炎症中发挥作用。并且本研究发现,FOXP1 表达水平与病人年龄、性别、染色体预后、HGB、PLT、FLT3-ITD、NPM1突变无关(P>0.05),与脾肿大、WBC 有关(P<0.05)。这提示,FOXP1 可能参与AML 的病理进展,外周血FOXP1 水平或许能成为评价AML 恶化程度的检测指标。
赵敏伊等[23]研究发现,CCL22 和FOXP3 在宫颈组织中过表达,且两者表达呈正相关,可引起肿瘤微环境的免疫失衡。研究发现,在头颈鳞状细胞癌中CD25+调节性T 细胞与CCL22 均呈高表达,并且CD25+调节性T 细胞分别与FOXP3、CCL22 呈正相关[24],这提示CCL22 和FOXP3 共同作用时可增强免疫抑制作用,加剧局部免疫失衡。那么,AML 病人外周血中CCL22 与FOXP1 的表达是否存在相关性?又是否影响AML 病人预后呢?本研究通过进一步分析发现,AML病人外周血中CCL22与FOXP1表达呈正相关(P<0.05)。对病人进行了3 年随访结果显示,AML 病人外周血CCL22 高表达组病人3 年生存率为47.06%,低于低表达组70.59%(P<0.05);FOXP1 高表达组病人3 年生存率为44.12%,低于低表达组病人73.53%(P<0.05),提示检测CCL22 及FOXP1 水平有助于指导AML 病人的预后情况。分析其影响预后原因,可能与CCL22、FOXP1 高表达组病人脾肿大、WBC 数量多有关。logistic 分析结果显示,CCL22,FOXP1 是影响AML 病人预后的独立危险因素。结果表明CCL22,FOXP1 在AML 的发生发展中作为致癌基因发挥作用,且CCL22 与FOXP1高表达与AML 不良预后存在密切联系,CCL22,FOXP1 可能是影响AML 病人预后的分子生物标志物,或许为AML新药开发提供新的研究方向。
综上所述,AML 病人外周血中CCL22,FOXP1均呈高表达,CCL22,FOXP1 高表达与AML 病人预后不良有关,是影响病人预后不良的独立危险因素,二者有望成为预测AML 病人预后的生物标志物,同时也为AML的靶向治疗提供了新思路。

